Высокая метаболическая активность что это такое
Что такое метаболический синдром? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чернышев А. В., кардиолога со стажем в 32 года.
Определение болезни. Причины заболевания
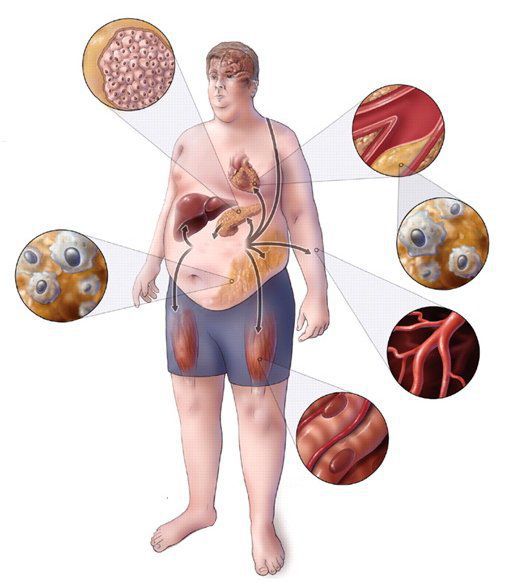
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне). [4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа. [5]
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям. [3] [7]
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Инсулинорезистентность — первопричина развития метаболического синдрома. Представляет собой нарушение утилизации глюкозы в органах-мишенях (поперечнополосатой мускулатуре, липоцитах и печени), связанное с дисфункцией инсулина. Инсулинорезистентность уменьшает усвоение и поступление в клетки скелетной мускулатуры глюкозы; стимулирует липолиз и гликогенолиз, что приводит к липидным и углеводным патологическим изменениям. Кроме того, инсулинорезистентность усиливает секрецию инсулина, в результате чего возникает компенсаторная гиперинсулинемия и активация эндокринных систем (симпатоадреналовой, ренин-ангиотензин-альдостероновой) с формированием артериальной гипертензии, дальнейшим нарушением метаболических процессов, гиперкоагуляции, субклинического воспаления, дисфункции эндотелия и атерогенеза. Эти изменения, в свою очередь, способствуют усилению инсулинорезистентности, стимулируя патогенетический «порочный круг».
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м 2 ), классифицируются следующие типы массы тела (МТ):
Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Центральным патологическим звеном метаболического синдрома является изменение углеводного обмена. Концентрацию глюкозы оценивают в капиллярной крови (норма 1
жен. >1,2
Осложнения метаболического синдрома
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
Лечение метаболического синдрома
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии. [10]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.). [9]
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
Метаболический синдром и ожирение
Что такое метаболический синдром?
Метаболический синдром – это сочетание нарушенного углеводного обмена, абдоминального ожирения, дислипидемии и гипертензии, и связан с развитием сахарного диабета 2 типа и сердечно-сосудистых заболеваний.
Для того, чтобы подтвердилось наличие метаболического синдрома, у человека должны присутствовать, по крайней мере, 3 из этих 5 синдромов:
1) Абдоминальное ожирение. Врачи используют термин «ожирение» для людей, которые имеют «индекс массы тела» от 30 и более. Объем талии при абдоминальном ожирении у мужчин более 94 см, у женщин – более 80 см.
3) Высокий уровень сахара в крови. Для того, чтобы все клетки вашего организма нормально работали необходима глюкоза. Сахар попадает в клетки с помощью гормона инсулина. Если не хватает инсулина, или если тело перестает реагировать на инсулин, глюкоза накапливается в крови. Нарушением обмена сахара в организме считается уровень глюкозы крови натощак более 5,6 ммоль/л, или лечение сахароснижающими препаратами.
4) Высокий уровень триглицеридов (нарушение липидного обмена). Триглицериды жироподобные вещества в крови. У Вас высокий уровень триглицеридов, если они выше, чем 1,7 ммоль/л.
5) Низкий уровень ЛВП в крови (липопротеидов высокой плотности). Липопротеиды высокой плотности – это » Хороший холестерин», потому что снижают риск сердечных приступов и других проблем со здоровьем. У вас считается низкий уровень ЛВП, если они составляют у мужчин менее 1,0 ммоль/л, у женщин – менее 1,2 ммоль/л.
Как диагностируется метаболический синдром?
В рамках обследования доктор:
1) Измеряет артериальное давление
2) Измеряет ваш рост и вес, чтобы определить ИМТ
3) Измеряет самую широкую часть вашего живота при помощи рулетки. Такое измерение называется «окружность талии».
Вы также сдаете анализ крови для определения уровня сахара и липидов в крови. Липиды крови, включают в себя такие показатели как триглицериды и холестерин. Люди, которые имеют высокий уровень триглицеридов часто имеют высокий уровень холестерина, тоже.
Можно ли предотвратить метаболический синдром?
Вы можете снизить шансы приобретения метаболического синдрома, если:
1) теряете в весе, при наличии избыточной массы тела;
2) едите много фруктов и овощей, обезжиренных молочных продуктов, мало мяса или жирной пищи;
3) много ходите или выполняете физическую активность ежедневно;
4) бросаете курить, если вы курите.
Как лечится метаболический синдром?
Лечение включает в себя:
Диета. Среди здоровых диет, которые помогут вам похудеть выделяют:
Упражнения. Рекомендуется физическая нагрузка, по крайней мере, 30 минут в день 5 или более дней в неделю. Если вы не можете выполнять физические упражнения в течение 30 минут за один раз, попробуйте выполнять упражнения в течение 10 минут 3 или 4 раза в день. Быстрая ходьба является хорошим выбором в такой ситуации.
Лекарства. Рекомендуется приём препаратов для снижения артериального давления, липидов и сахара в крови.
В том случае, если консервативные методы лечения морбидного ожирения и других проявлений метаболического синдрома неэффективны, пациентам могут быть показано хирургическое лечение, направленное на уменьшение объёма желудка и снижение всасывания пищи в кишечнике. Это называется бариатрическая хирургия.
Диагностика и лечение морбидного ожирения и заболеваний, ассоциированным с метаболическим синдромом должно происходить в специализированном отделении с участием эндокринолога, гастроэнтеролога, диетолога и бариатрического хирурга.
Материалы конгрессов и конференций
X РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ПЭТ В ОНКОЛОГИЧЕСКОЙ КЛИНИКЕ
А.М. Гранов, Л.А. Тютин, Н.А. Костеников, Д.В. Рыжкова, М.С. Тлостанова,
А.А. Станжевский, Д.Б. Фрейдман, А.А. Балабанова
Центральный научно-исследовательский рентгенорадиологический институт Росздрава, Санкт-Петербург
Онкологические заболевания относятся к числу наиболее распространенных среди населения экономически развитых стран и занимают лидирующее положение по показателям смертности. Так, в США ежегодно регистрируются около 1,5 млн. случаев злокачественных опухолей и более 560 тыс. больных в год умирает. Хорошо известно, что исход онкологических заболеваний во многом зависит от своевременной диагностики и объективной оценки эффективности проводимого лечения. Однако, несмотря на внедрение в клиническую практику высокоинформативных методов диагностики (УЗИ, СКТ, МРТ и др.), большая часть больных поступает в медицинские центры уже с запущенными стадиями заболевания, а адекватность проводимых лечебных мероприятий своевременно не оценивается. В связи с этим дальнейшее совершенствование методов диагностики является весьма актуальным. По мнению специалистов, наиболее перспективным в этом отношении может быть всестороннее изучение и внедрение в клиническую практику позитронной эмиссионной томографии (ПЭТ), позволяющей получать уникальную информацию о метаболизме и перфузии нормальных и патологически измененных тканей на клеточно-молекулярном уровне. Эти данные могут иметь решающее значение для диагностики и дифференциальной диагностики злокачественных опухолей на ранних этапах их развития. Кроме того, с помощью ПЭТ удается своевременно установить изменения, происходящие в опухоли под влиянием лекарственной и лучевой терапии, а также выявить признаки продолженного роста или рецидива новообразования. Однако имеющиеся в литературе данные свидетельствуют о том, что многие аспекты использования ПЭТ в онкологии изучены недостаточно. В настоящее время весьма противоречивым является вопрос об эффективности ПЭТ при различных опухолях. Так, согласно данным систематизированного анализа возможностей ПЭТ в онкологии III всеобщей конференцией врачей ФРГ признана недоказанной эффективность использования этого метода при раке щитовидной железы, пищевода, опухолях костей и мягких тканей, рецидиве и оценке эффективности лечения рака молочной железы, феохромацитоме, опухолях головы и шеи, низкодифференцированной лимфоме Ходжкина. Однако в ряде других публикаций имеются сведения об успешном применении ПЭТ при большинстве из указанных онкологических заболеваний. Очевидно, что использование ПЭТ в онкологической клинике, по существу, находится в начале своего пути. Широкому внедрению метода должно предшествовать полное, всестороннее изучение его диагностических возможностей с применением различных технологий исследования и специфических туморотропных препаратов.
В настоящем сообщении нами обобщен коллективный 9-летний опыт применения ПЭТ при обследовании больных онкологического профиля.
Всего обследованы более 5000 пациентов, которым выполнены 7220 исследований. При этом опухоли различных локализаций выявлены у 2045 больных. Распределение онкологических больных в зависимости от нозологической формы опухолевого заболевания представлено в табл. 1.
Таблица 1.
Распределение онкологических больных по диагнозу.
| Нозологическая форма | Число обследованных больных | |
|---|---|---|
| Количество | % | |
| Объемные образования головного мозга | 542 | 26,5 |
| Рак молочной железы | 192 | 9,4 |
| Злокачественные опухоли печени | 381 | 18,6 |
| Рак поджелудочной железы | 240 | 11,7 |
| Лимфопролиферативные заболевания | 128 | 6,3 |
| Рак легкого | 117 | 5,7 |
| Герминогенные опухоли | 82 | 4 |
| Рак предстательной железы | 53 | 2,6 |
| Колоректальный рак | 119 | 5,8 |
| Меланома | 67 | 3,3 |
| Прочие | 124 | 6,1 |
| Всего | 2045 | 100 |
ПЭТ в нейроонкологии. Всего обследованы 542 больных с объемными образованиями головного мозга. Основную группу составили пациенты с опухолями глиального ряда (преимущественно злокачественными), метастатическим поражением головного мозга и менингиомами. Результаты ПЭТ больных со злокачественными новообразованиями головного мозга представлены в табл. 2 и 3.
Таблица 2.
КДН, полученные при ПЭТ с различными РФП у больных со злокачественными новообразованиями головного мозга.
Таблица 3.
Информативность ПЭТ с различными РФП при диагностике злокачественных новообразований головного мозга.
| Название методики | Чувствительность (%) | Специфичность (%) | Диагностическая точность (%) |
|---|---|---|---|
| ПЭТ с 18 F-ФДГ (n=385) | 82,2 | 99,6 | 94,8 |
| ПЭТ с 11 C-БН (n=159) | 94,1 | 82,4 | 88,7 |
| ПЭТ с 11 C-метионином (n=33) | 84,6 | 65,0 | 72,7 |
| ПЭТ с 18 F-ФДГ и 11 C-БН (n=36) | 96,0 | 100,0 | 97,2 |
Рак молочной железы (РМЖ). ПЭТ с 18 F-ФДГ выполнена 192 больным раком молочной железы. В 141 случае исследование проводилось до операционного вмешательства. При этом в 21 случае ПЭТ одним и тем же больным проводилась дважды: до начала и после завершения неоадъювантной химиотерапии. Кроме того, 51 больной ПЭТ с 18 F-ФДГ проведена после удаления первичного очага с целью определения регионарных и отдаленных метастазов.
Таблица 4.
Диагностические показатели ПЭТ с 18 F-ФДГ у пациенток в основной и контрольной клинических группах.
| Клиническая группа | Количество пациенток | Характер накопления РФП | SUVmax | SUVmean |
|---|---|---|---|---|
| Фиброзно-кистозная мастопатия | 55 | Диффузно-неравномерное | 1,50±0,08 | 1,12±0,03 |
| Рак молочной железы | 139 | Очаговое | 3,71±0,21 | 2,33±0,08 |
Во всех случаях для злокачественной опухоли было характерно повышенное накопление РФП в зоне поражения. Визуализировать злокачественное новообразование не удалось лишь в 3 случаях в связи с крайне малыми размерами первичного очага (ниже разрешающей способности метода). Ложноположительное заключение сделано в 1 случае при наличии у пациентки с фиброзно-кистозной мастопатией воспалительного процесса. Чувствительность, специфичность и диагностическая точность ПЭТ с 18 F-ФДГ при РМЖ составила 97,8%, 98,2% и 98,0%, а при поражении регионарных лимфоузлов – 92,0%, 100% и 97,8% соответственно.
Рак поджелудочной железы (РПЖ). Распределение обследованных больных по диагнозу представлено в табл. 5.
Таблица 5.
Распределение больных с объемными образованиями поджелудочной железы по диагнозу.
| Характер патологии | Количество больных | |
|---|---|---|
| n | % | |
| Рак поджелудочной железы | 150 | 62,5 |
| Хронический псевдотуморозный панкреатит в стадии ремиссии | 81 | 33,7 |
| Хронический псевдотуморозный панкреатит в стадии обострения | 9 | 3,8 |
| Всего | 240 | 100,0 |
Первичные опухоли печени и метастазы. Нами было обследован 381 пациент с первичными опухолями печени и метастазами. Контрольную группу составили 65 пациентов с нормальной паренхимой печени и доброкачественными новообразованиями. Распределение больных в зависимости от морфологического типа поражения и метаболической активности злокачественной опухоли представлено в табл. 6.
Таблица 6.
Распределение больных в зависимости от морфологического типа поражения и метаболической активности злокачественной опухоли.
| Морфологический тип опухоли | Количество больных | SUVмакс | SUVср | |
|---|---|---|---|---|
| n | % | |||
| Холангиоцеллюлярный рак | 31 | 8,1 | 3,00±0,15 | 2,05±0,09 |
| Гепатоцеллюлярный рак | 54 | 14,2 | 2,22±0,25 | 1,63±0,13 |
| Метастатическое поражение печени | 296 | 77,7 | 4,76±0,21 | 2,86±0,11 |
| Всего | 381 | 100 | ||
В 189 из 192 случаев злокачественного поражения паренхимы печени нами были получены истинноположительные результаты. Ложноположительные данные определялись у 2 пациентов с локальным нарушением перфузии печени. Таким образом, чувствительность, специфичность и диагностическая точность метода составили 98,4%, 96,9% и 98,0% соответственно.
Таблица 7.
Распределение больных лимфопролиферативными заболеваниями в зависимости от метаболического ответа опухоли на проводимое лечение (n=54).
| Выраженность метаболического ответа | Количество больных | SUVмакс до лечения | SUVмакс после лечения | SUVср до лечения | SUVср после лечения | |
|---|---|---|---|---|---|---|
| n | % | |||||
| Полная метаболическая ремиссия | 28 | 51,8 | 3,00±0,15 | Отсутствие накопления | 2,22±0,25 | Отсутствие накопления |
| Частичная метаболическая ремиссия | 14 | 25,9 | 4,76±0,21 | 4,1±0,18 | 2,31±0,15 | 2,10±0,10 |
| Стабилизация процесса | 8 | 14,9 | 3,93±0,25 | 3,89±0,27 | 2,67±0,21 | 2,56±0,19 |
| Прогрессирование заболевания | 4 | 7,4 | 3,84±0,16 | 5,1±0,19 | 2,93±0,18 | 3,11±0,17 |
Таким образом, представленные данные свидетельствуют о том, что ПЭТ является высокоинформативным методом диагностики большинства наиболее социально значимых злокачественных новообразований, в т.ч. на ранних стадиях их развития, и, как правило, позволяет установить истинные размеры, распространенность и степень злокачественности опухолевого поражения, а также объективно оценить эффективность проводимого лечения. Вместе с тем, накопленный опыт показал относительно низкие диагностические возможности ПЭТ с 18 F-ФДГ при некоторых опухолях головы и шеи, раке почки, предстательной железы (выявление первичного опухолевого узла), раке мочевого пузыря и др. Мировой клинический опыт по использованию для диагностики специфических туморотропных РФП, в силу целого ряда причин, крайне ограничен. До настоящего времени не решен вопрос об оптимальных сроках выполнения контрольных исследований при лечении различных онкологических заболеваний. Требует совершенствования и технология проведения ПЭТ сканирования. Другими словами, очевидно, что диагностические возможности ПЭТ еще далеко не исчерпаны. На базе проводимых исследований эффективность метода должна быть существенно повышена.