Вспомните чем отличаются понятия валентности и степени окисления что
Валентность и степень окисления
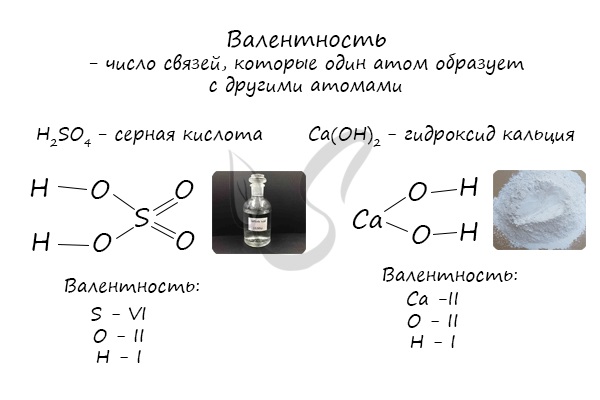
Валентность
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
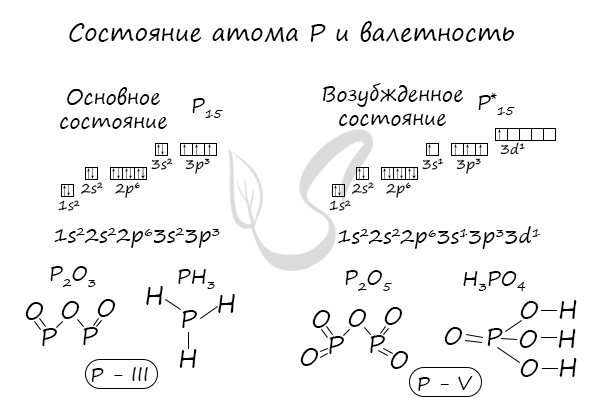
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
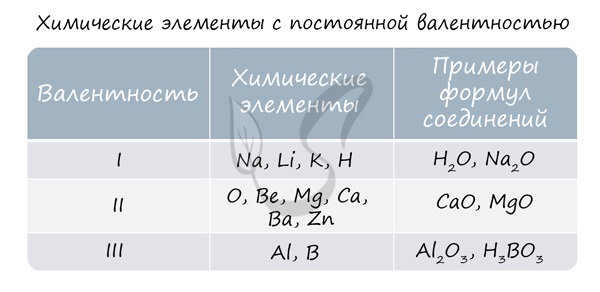
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Степень окисления
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
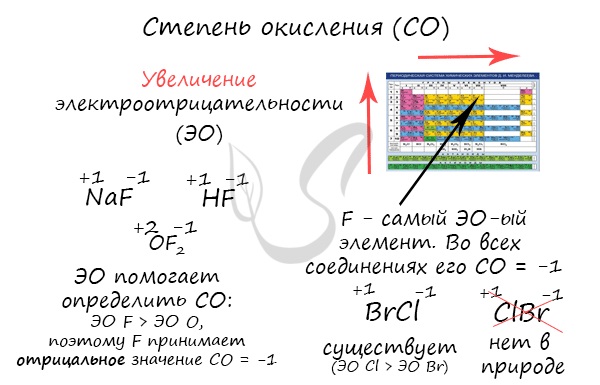
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Химия
Именная карта банка для детей
с крутым дизайном, +200 бонусов
Закажи свою собственную карту банка и получи бонусы
План урока:
Валентность
Представьте на минуточку, что атомы не могли бы соединяться между собой, какой вид имела бы планета, а вопрос: «Существовала ли вообще Солнечная система?» Именно благодаря тому, что атомы соединяются между собой, существуют вещества, а также и мы.
Вернёмся к деталям, мы их будем сравнивать с атомами, а их внешний вид, с количеством связей, которые они могут образовать.
Представим, что в нашем распоряжении есть вот такие детали.
Валентность элементов обусловлена количеством неспаренных электронов на внешнем уровне.
Они могут отличаться цветом, формой, однако их объединяет количество связей, которые они способны образовать. Иначе говоря, что щелочные металлы одновалентны.
Это правило срабатывает и для элементов II группы, только они будут иметь вид двойных деталей.
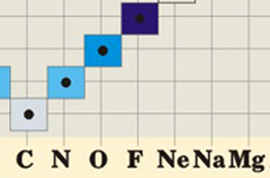
Как возможно Вы заметили, или вспомнили с темы строение атома, что высшая валентность определяется номером группы, но не всегда ей равна. Исключением с данного правила являются атомы элементов таких как азот, фтор и кислород.
Почему фтор, находясь в VII группе, имеет валентность постоянную равную единице. В то время, для других его родственников, она будет равнять I, III, V или даже VII.
Причины постоянной и переменной валентности
Для большинства элементов характерно иметь переменную валентность. Но для некоторых она будет постоянной. Некоторые элементы Вам уже известны, пополнит этот список кислород и цинк, которые всегда двухвалентны, алюминий имеет число связей III.
Расположение элементов в периодической таблице подсказывает, о количестве связей, которые могут они образовать.
Определение валентности элементов по формулам
На рисунке изображены молекулы известных Вам веществ: это аммиак NH3, запах этого газа очень резкий и его трудно забыть, если хоть раз ощущали запах нашатырного спирта, с помощью его приводят людей в чувство после обморока.
Молекула Н2О окружает нас повсюду. Во всех этих соединениях имеются атомы водорода, только в разных количествах. Давайте попробуем определить валентность по формуле вещества. Вспомним, что водород одновалентен. Если в аммиаке водорода насчитываем 3 атома, значит азот, условно, можем изобразить в виде такой детали.
Как видно с рисунка, он имеет валентность III. Поэтому принципу определим валентность углерода, приходим к выводу, что он четырёхвалентен.
Но не всегда мы видим структурные формулы, которые отображают связи между атомами, и не всегда имеем дело с одновалентными элементами. Возьмём, к примеру, вещество состава Р2О5. На два атома фосфора приходится 5 атомов кислорода. Постоянную валентность имеет кислород, которая равняется II. Чтобы определить, какую валентность будет иметь фосфор, необходимо выполнить следующие математические действия.
Встречаются такие соединения, где необходимо определить валентность остатков, входящих в состав кислот. Например, вещество состава Mg3(PO4)2.
Выполним согласно алгоритму. Магний всегда двухвалентен.
Искомая валентность кислотного остатка равна III. Следует заметить, что в веществе всегда находиться элемент, который проявляет постоянную валентность.
При написании уравнений реакций возникает необходимость составления формул веществ. Рассмотрим реакцию обмена между оксидом алюминия и соляной кислотой.
В результате обмена образуется два вещества состава AlCl и НО. Чтобы определить количественный состав в веществах, воспользуемся следующим алгоритмом.
Составление химических формул по валентности
Уравнение приобретает вид
Обратите внимание, что количество атомов отличается в реагентах и продуктах, его необходимо уравнять.
Составим формулы веществ по валентности элементов.
Немаловажную роль наравне с валентностью играет такое понятие как степень окисления (СО).
Термин валентность применим для соединений, имеющих молекулярное строение. Но, как известно, ещё существуют вещества ионного строения, которые образуются за счёт электростатического притяжения между разноимёнными зарядами. Каким образом они образуются? Чтобы ответить на данный вопрос, вспомним об электроотрицательности.
При образовании вещества, одни атомы будут отдавать свои электроны, другие – принимать. Рассмотрим на примере соединений молекулярного строения Cl2, HCl и ионного NaCl.
Обратите внимание, что вещества молекулярного строения, имеют структурную формулу, соединение атомов между собой показывается в виде черты – между ними. Для веществ имеющих строение, отличающее от молекулярного, более применимо понятие степени окисления, которое имеет универсальное применение для всех типов веществ.
А вот какую степень окисления имеет простое вещество. Атомы равноценные партнёры, поэтому она будет нулевая.
Правила определения степени окисления
Подобно валентности, для определённых элементов свойственна постоянная степень окисления. Это металлы, которые отличаются малым количеством электронов внешнего слоя. Отличительной характеристикой их будет невозможность иметь отрицательный заряд, поскольку они ВСЕГДА отдают электроны.
Все эти значения вытекают с периодической системы, которая помогает определить степени окисления элементов.
С таблицы видно, что для большинства элементов эта величина не постоянная.
Чтобы вычислить степень окисления элементов в соединениях, будем руководствоваться следующими правилами.
Как бы то ни было, природа не ограничивается бинарными соединениями. Существует множество веществ состоящих из 2 и более элемента. Впрочем вычисление совсем не отличается, первоначально определяем элементы, имеющие постоянную степень окисления, а дальше проделав нехитрые математические действия находим СО для остальных. Главное правило, чтобы вещество было нейтральным, количество плюсов должно равняться количеству минусов.
К примеру, в веществе H2SO3 самым электроотрицательным является кислород, он заберёт электроны как в водороде, так и в серы, вследствие этого имеет отрицательную СО, а Hи Sстанут положительными. В этом соединение имеются 2 элемента, имеющих известную СО – это Н и О.
Обратите внимание, на нахождение СО в кислотном остатке. В данном случае, мы приравниваем не к 0, а к заряду аниона.
Здесь у серы х внизу
Чем валентность отличается от степени окисления
Валентность и степень окисления – понятия, часто применяемые в неорганической химии. Во многих химических соединениях значение валентности и степень окисления элемента совпадают, именно по этой причине у школьников и студентов часто возникает путаница. У этих понятий действительно есть кое-что общее, но отличия более существенны. Чтобы понять, чем же отличаются эти два понятия, стоит узнать о них больше.
Сведения о степени окисления
Степень окисления – вспомогательная величина, приписываемая атому химического элемента или группе атомов, которая показывает, каким образом распределены общие пары электронов между взаимодействующими элементами.
Это вспомогательная величина, не имеющая физического смысла как такового. Ее суть достаточно просто объяснить с помощью примеров:
Молекула пищевой соли NaCl состоит из двух атомов – атома хлора и атома натрия. Связь между этими атомами ионная. У натрия на валентном уровне 1 электрон, значит у него с атомом хлора одна общая электронная пара. Из этих двух элементов хлор более электроотрицателен (обладает свойством смешать к себе электронные пары), то единственная общая пара электронов сместится к нему. В соединении элемент с более высокой электротрицательностью имеет отрицательную степень окисления, менее электроотрицательный, соответственно, положительную, а ее значение равно количеству общих пар электронов. Для рассматриваемой молекулы NaCl степени окисления натрия и хлора будут выглядеть так:
Хлор, со смещенной к нему электронной парой, теперь рассматривают как анион, то есть атом, присоединивший к себе дополнительный электрон, а натрий – как катион, то есть атом, отдавший электрон. Но при записи степени окисления на первом месте идет знак, а на втором числовое значение, а при записи ионного заряда – наоборот.
Степень окисления простого (чистого) вещества, не зависимо от его физических и химических свойств, равна нулю. Молекула О2, например, состоит из двух атомов кислорода. У них одинаковые значения электроотрицательности, потому общие электроны не смещаются ни к одному из них. Значит, электронная пара находится строго между атомами, потому степень окисления будет нулевой.
Для некоторых молекул бывает сложно определить, куда смещаются электроны, особенно если элементов в ней три или больше. Чтобы высчитать степени окисления в таких молекулах, нужно воспользоваться несколькими простыми правилами:
Так как фтор – элемент с наивысшей электроотрицательностью, потому он всегда смещает к себе взаимодействующие электроны. Согласно международным правилам, элемент с меньшим значением электроотрицаельности записывается первым, потому в этих оксидах кислород на первом месте.
При вычислении степеней окисления нужно помнить, что наибольшая степень окисления элемента равна номеру его группы, а минимальная — номер группы минус 8. Для хлора максимальное возможное значение степени окисления +7, потому что он в 7-ой группе, а минимальная 7-8=-1.
Общие сведения о валентности
Валентность – число ковалентных связей, которые может образовывать элемент в разных соединениях.
В отличии от степени окисления, понятие валентности есть реальный физический смысл.
Самый высокий показатель валентности равен номеру группы в таблице Менделеева. Сера S расположена в 6-ой группе, то есть ее максимальная валентность 6. Но она может быть также 2 (H2S) или 4 (SO2).
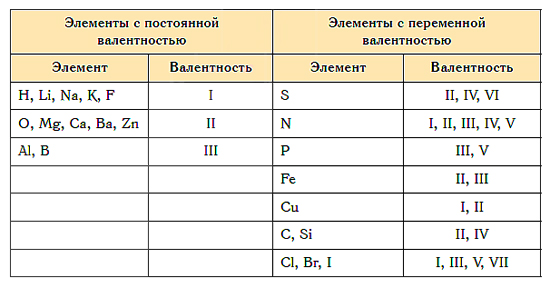
Почти для всех элементов характерна переменная валентность. Однако есть атомы, для которых эта величина постоянная. К ним относятся щелочные металлы, серебро, водород (их валентность всегда равна 1), цинк (валентность всегда 2), лантан (валентность равна 3).
Что же общего у валентности и степени окисления
Основные отличия между этими понятиями
Урок 5 Бесплатно Валентность. Степень окисления. Количество вещества
Валентность
Атомы соединяются в молекулы в определенных соотношениях.
Приведем пример широко распространённых соединений водорода.
Это связано с количеством электронов на внешнем электронном уровне атома (подробнее про электронные уровни в одном из следующих уроков).
Эти электроны часто называют валентными электронами.
Это значение легко узнать из периодической системы химических элементов: число валентных электронов равно номеру группы, в которой находится химический элемент.
Элементы третьего периода системы химических элементов
Номер группы и число валентных электронов обозначены цифрой в центре клетки.
Суть химического взаимодействия между двумя атомами состоит в том, чтобы в итоге внешний электронный уровень атома оказался полностью завершенным.
Такое положение похоже на состояние атомов VIII группы – инертных газов (гелий, неон, аргон, криптон, ксенон).
Атомы этих элементов «самодостаточны», т.е. «не желают» вступать в химические реакции.
Поэтому их ещё называют благородными.
Чтобы получить полностью завершенную внешнюю электронную оболочку, атомы объединяются в таких соотношениях, что получают друг от друга необходимое количество электронов.
Недостающие электроны, которые атом как бы «получает» или «отдаёт», в составе молекулы для обоих атомов являются общими.
То количество электронов, которое атом получает или отдаёт в процессе химической реакции, а следовательно, количество других атомов, которые способен присоединить наш атом, и называется валентностью этого атома.
У некоторых элементов валентность постоянная, но у большинства есть по несколько значений валентности.
Один и тот же элемент в разных соединениях проявляет разную валентность.
Элементов, валентность которых всегда постоянна, немного, и их нужно просто запомнить.
Химический элемент
или группа элементов
Валентность
Литий, натрий, калий, рубидий, цезий (все щелочные металлы);
Водород, фтор, серебро
Бериллий, магний, кальций, стронций, барий (все щелочно-земельные металлы);
Бор, алюминий, галлий
Углерод, кремний, германий
Атомы проявляют валентность только в химических соединениях!
Пройти тест и получить оценку можно после входа или регистрации
Степень окисления
Валентность показывает, сколько электронов «отдал» или «приобрел» атом, но не показывает, отдал атом эти электроны или приобрёл.
Разные элементы обладают разной степенью активности, и в зависимости от этого при реакциях электроны, хотя и являются общими для двух атомов, являются как бы «сдвинутыми» в сторону какого-то одного из них.
Степень окисления – это условный заряд атома в составе молекулы, если предположить, что принятый электрон полностью принадлежит атому, а отданный полностью не принадлежит.
Рассмотрим степени окисления атомов азотной кислоты HNO3
Известно, что в химических формулах количество атомов в 1 единицу не пишут, но для наглядности мы это сделаем. Получилось H1N1O3
Азотная кислота в природе существует в виде устойчивого соединения, это значит, что сумма всех степеней окисления составляющих ее атомов равна нулю.
Азотная кислота состоит из 1 атома водорода, 1 атома азота и 3-х атомов кислорода.
Водород имеет степень окисления +1
Посмотрим на алгоритм определения степени окисления:
Вам придется часто определять степени окисления веществ в составе молекул.
Это просто. Главное надо знать степени окисления атомов, там, где вариантов немного или всего один.
Зная, что сумма всех произведений степеней окисления в одной молекуле равна нулю, мы сможем очень легко определить неизвестную степень окисления.
Рассмотрим алгоритм определения степени окисления азота в молекуле азотистой кислоты.
Часто степень окисления и валентность совпадают. Но это происходит не всегда. Наиболее ярко это различие проявляется в простых веществах, образованных некоторыми газами, но также проявляется и в других соединениях.
Химический элемент
Вещество
Валентность
Степень окисления
HNO3 (азотная кислота)
Главное отличие степени окисления от валентности: валентность не имеет знака, а степень окисления имеет знак.
Положительное число говорит об отдаче электрона (т.к. заряд электрона отрицательный), отрицательное – наоборот.
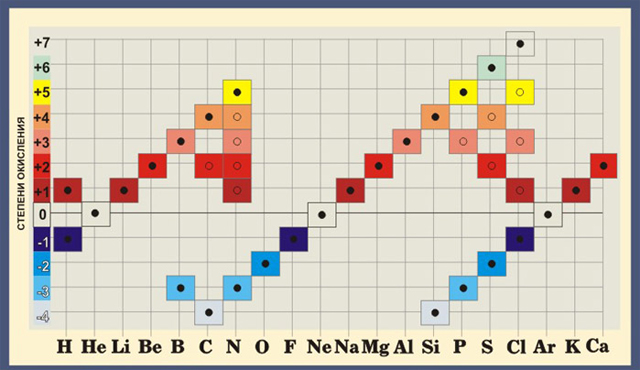
Высшая положительная степень окисления элемента равна номеру группы периодической системы.
Химический элемент
Номер группы в периодической системе
Высшая положительная степень окисления
Натрий
Магний
Алюминий
Кремний
Фосфор
Сера
Хлор
Большинство элементов имеют переменную степень окисления.
Например, марганец имеет степень окисления в разных его соединениях +2, +3, +4, +6, +7
В природе элементы встречаются в таких соединениях, где проявляют самую устойчивую степень окисления.
Химический элемент
Наиболее распространенное в природе вещество и степень окисления элемента в нём
Другие вещества и степени окисления элемента в них
Кварц (оксид кремния)
Пирит (сульфид железа)
Cоль (хлорид натрия)
NaCl
Пройти тест и получить оценку можно после входа или регистрации
Количество вещества
До этого речь шла об отдельных атомах и молекулах.
Но химики не работают с индивидуальными молекулами.
Например, формула поваренной соли NaCl. Содержание атомов натрия и хлора в этом веществе относятся как 1:1.
Значит ли это, что для получения соли нужно взять равные массы натрия и хлора?
Нет, потому что у этих атомов разные массы, а значит, в одном килограмме натрия и в одном килограмме хлора будет содержаться разное количество молекул.
Поэтому химики измеряют количество вещества в таких единицах, которые обозначают не массу, а количество молекул (или атомов – в тех случаях, когда речь идет о простых веществах, молекулы которых одноатомны).
Такое количество вещества химики назвали «моль» (от слова «молекула»).
Для простоты обозначений химики постановили, что моль – это количество вещества, содержащее такое число молекул, которое совпадает с числом атомов в 12 г углерода.
1 моль любого вещества имеет такую массу, которая численно равна молекулярной массе данного вещества, выраженной в атомных единицах массы. Например, относительная атомная масса меди равна 64, значит, 1 моль меди имеет массу 64 грамма. Масса вещества, взятого в количестве 1 моль, называется молярной массой и выражается единицами г/моль. Молярная масса меди равна 64 г/моль.
Из этого следует важный вывод: 1 моль любого вещества содержит одно и то же число молекул, хотя и имеет для разных веществ разную массу.
В математическом виде это обозначается так:
Таким образом, независимо от того, сколько весит вещество, 1 его моль будет содержать всегда одинаковое количество атомов, равное 6,022 · 10 23 единиц.
У меня есть дополнительная информация к этой части урока!
С именем Амедео Авогадро (1776-1856) также связан Закон Авогадро, который в определенной степени перекликается с постоянной Авогадро, но только касается газов. Авогадро предположил, что все газы при одинаковых условиях (температура и давление) в равных объемах содержат одинаковое количество молекул. Свои выводы он аргументировал тем, что молекулы газов находятся на значительном расстоянии друг от друга, поэтому их масса не играет значения в количестве самих молекул в единице объема.
1. один моль любого газа при равных условиях (температура и давление) занимает один и тот же объем.
2. один моль любого газа при нормальных условиях (t=0°С и давлении 10 5 Па= 100 кПа= 1 бар= 1 атмосфера) занимает один и тот же объем, равный 22,41 литрам (м 3 )
Величина 22,41 л/моль (22,41 м 3 /моль) называется моляным объемом газа и обозначается Vm
Закон Авогадро можно изучить на нашем уроке «Понятие о газах».
Зная количество вещества, можно судить о числе частиц в определенной его порции и брать вещества для реакций в необходимых количествах.
На картинках ниже вы увидите, какой объем занимает одинаковое количество разных веществ, равных одной моли.
Пройти тест и получить оценку можно после входа или регистрации
Валентность. Степень окисления химических элементов
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
Правила определения валентности элементов в соединениях
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
Пример
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
Задание 2
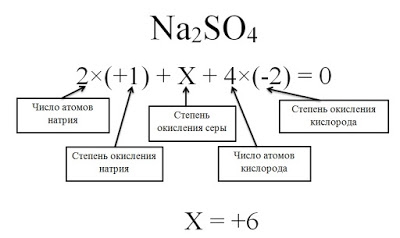
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.