чем вредны анаболики для мужчин
Побочные эффекты стероидов и как снизить вред стероидов
Содержание
Побочные эффекты стероидов [ править | править код ]
Стоит заметить, что большинство отрицательных эффектов можно предотвратить, если соблюдать простые рекомендации, связанные, прежде всего, с выбором препаратов, продолжительностью курса, дозами и PCT (послекурсовой терапией). Все данные взяты из авторитетных иностранных источников, которые перечислены в примечаниях.
Общие меры по профилактике вреда [ править | править код ]
Противопоказания к приему стероидов [ править | править код ]
Частные случаи [ править | править код ]
Подавление выработки собственного тестостерона [ править | править код ]
Это так называемый механизм обратной связи. Организм постоянно стремится к гомеостазу, и если концентрация того или иного гормона начинает повышаться, рецепторы фиксируют это и эндокринная система снижает продукцию данного гормона, для того чтобы восстановить эндокринный баланс. Таким образом регулируется секреция практически всех гормонов.
На приведенных рисунках видно, что при увеличении концентрации нандролона в крови, уровень тестостерона в плазме начинает зеркально снижаться, затем происходит обратный процесс.
В нашем организме ФСГ (фолликулостимулирующий гормон) и ЛГ (лютеинизирующий гормон) вырабатывается постоянно, именно они поддерживают функцию яичек (как сперматогенез, так и выработку эндогенного тестостерона). Во время стероидного курса выработка ЛГ и ФСГ подавляется и яички начинают атрофироваться. Введение хорионического гонадотропина (который действует как ЛГ и ФСГ) позволяет восстановить гормональный баланс и сохранить функцию яичек.
Часто можно услышать мнение, что введение гонадотропина необходимо только по окончанию курса, однако это неправильно, поскольку в данном случае ткани яичка не будут получать стимуляцию длительное время, и начнут атрофироваться, а этого нельзя допустить, более того, включение хорионического гонадотропина в послекурсовую терапию чаще всего оказывается контр-продуктивным. Введение гонадотропина на протяжении всего курса позволяет добиться поддержания функции яичек. Стоит также подчеркнуть, что необходимость его применения в данном случае связана не с набором массы, а с безопасностью, именно поэтому дозировки нужны небольшие.
Для восстановления секреции собственного тестостерона с успехом проводится послекурсовая терапия с применением антиэстрогенов в различных дозировках.
Повреждение печени [ править | править код ]
Во-первых, повреждение печени вызывают только таблетированные формы препаратов, которые имеют метильную группу в положении 17. Эта группа предотвращает разрушения препарата в печени, однако делает его токсичным для нее. Во-вторых, побочное действие на печень возникает только при употреблении очень больших доз на значительных временных отрезках.
В качестве подтверждения этим словам можно привести результаты исследований Флюоксиместерона, Дианабола и Винстрола на лабораторных животных. Ученые установили, что повреждения ткани печени возникает только при использовании доз, которые в 10 раз выше рекомендуемых. [2] Так, например, токсические свойства Метандростенолона начинают проявляться только при суточной дозировке выше 80 мг в сутки, тогда как рекомендуемая доза составляет примерно 20-30 мг.
Еще одно исследование было уже проведено на людях. Две группы атлетов, в одной из которых участники использовали стероиды, а в другой тренировались при использовании только натуральных средств, были обследованы на предмет изменений в печени. Спортсмены, которые использовали стероиды в больших дозах имели признаки поражения печени, однако уже через 3 месяца не было обнаружено никаких изменений. [3] Таким образом, можно сделать вывод, что побочные эффекты на печень носят обратимый характер.
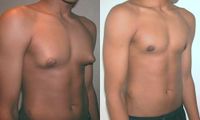
Гинекомастия [ править | править код ]
Гинекомастию вызывают только те препараты, которые конвертируются в эстрогены (Метандростенолон, Тестостероны, Сустанон и др.).
Очень часто можно услышать глупые рекомендации, типа: антиэстрогены нужно использовать только после окончания курса или только когда возникли первые признаки гинекомастии. Это серьезная ошибка, благодаря которой так много атлетов имеют гинекомастию (реальный пример). Антиэстрогены следует применять на протяжении всего курса. Гинекомастия часто носит необратимый характер, поэтому ее нужно профилактировать, а не лечить!
Оптимальным решением является выполнение анализов на эстрогены с последующей корректировкой дозы ингибиторов ароматазы.
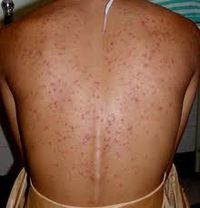
Акне (угри) [ править | править код ]
Еще одно распространенное побочное действие. Акне возникает благодаря тому, что анаболические средства усиливают секрецию кожного сала, что приводит к воспалению волосяных фолликулов и образованию угрей. Особенно выражено это действие у высокоандрогенных препаратов. [5]
Подъем уровня холестерина в крови [ править | править код ]
Анаболические стероиды могут понижать липопротеины высокой плотности (полезные), и увеличивать липопротеины низкой плотности (вредный холестерин). Гипотетически это может привести к атеросклерозу.
Однако на практике этого не происходит, по причине кратковременности этого эффекта. За 4-6 недель повышенный уровень холестерина не приводит к изменениям в органах и сосудах, а после отмены препаратов уровень холестерина возвращается к исходному.
Надо заметить, что подъем холестерина возникает далеко не всегда, и этим побочным эффектом обладают не все препараты.
Сердечно-сосудистые проблемы [ править | править код ]
Известно, что употребление анаболиков связано с заболеваниями сердечно-сосудистой системы. Вероятно, это взаимосвязано с их влиянием на холестерин. Помимо этого, злоупотребление препаратами этой группы может вызывать гипертрофию желудочков сердца. Однако стоит заметить, что к этому приводит и силовой тренинг.
Повышенное артериальное давление [ править | править код ]
Эта проблема возникает по причине того, что АС:
Нормальное артериальное давление должно быть ниже 140/90 мм рт. ст. (при наличии сахарного диабета этот показатель снижается до 130/80 мм рт. ст.). Систематически измеряйте уровень артериального давления крови с помощью тонометра. Желательно два раза в день.
Данный побочный эффект стероидов довольно легко устраняется с помощью 50 мг Метопролола и 5 мг Эналаприла. Для экстренного снижения повышенного давления применяется капотен (каптоприл). Если этого недостаточно, можно увеличить дозировку гипотензивных средств до нормализации артериального давления. При этом следует отметить, что при условии соответствующего контроля за уровнями Эстрадиола и Пролактина в организме применение антигипертензивных препаратов требуется крайне редко.
Проблемы с почками [ править | править код ]
Почки осуществляют фильтрацию крови и удаление побочных продуктов обмена из организма. Прием анаболических стероидов может увеличить нагрузку на почки, однако препараты не обладают непосредственным токсическим влиянием, а увеличение нагрузки связано с повышением артериального давления, описанного в разделе выше.
Есть стероиды (например, нандролон), которые используются даже для лечения некоторых заболеваний почек.
Когнитивный дефицит и уменьшение объема мозга [ править | править код ]
Многие авторы и сами атлеты отмечают, что во время курса снижаются когнитивные способности и вообще мотивация к выполнению интеллектуальной деятельности. [6] [7] Не совсем понятно почему это происходит: поскольку угнетается мыслительная функция мозга или за счет изменения приоритетов в сторону агрессии и физической активности.
В 2016 году Astrid Bjørnebekk и соавторы изучили [8] долгосрочный эффект приема анаболических стероидов на мозг. Оказалось, что чем больше человек злоупотребляет стероидами, тем меньше объем его мозга и толщина коры. Полученные данные носят корреляционный характер, то есть, не ясно, что является первопричиной: факт употребления АС или же наоборот, люди с меньшим объемом мозга имеют большую склонность к злоупотреблению.
Психические проблемы [ править | править код ]
Одно из исследований показало, что главную роль играет темперамент, и если вы не склонны к агрессии в обычной жизни, то употребление АС не приведет к этой проблеме. [9]
Облысение [ править | править код ]
Анаболические стероиды могут способствовать развитию алопеции у мужчин, при чем это касается только волосистой части головы, тогда как волосяной покров на других частях тела может незначительно сгущаться.
Ученые считают, что облысение связано с геном, который находится в Х хромосоме, поэтому АС способны спровоцировать этот процесс только в случае наличия генетической предрасположенности. Если в вашей семье по отцовской и материнской линии никто не имел алопеции, то и вам она очевидно тоже не грозит. В противном случае, это практически неизбежный процесс.
Причина, по которой стероиды способствуют облысению, лежит в дигидротестостероне, поэтому вы можете использовать те препараты, которые не конвертируются в этот метаболит.
Образование тромбов [ править | править код ]
Использование анаболических препаратов приводит к увеличению протромбинового времени или, иными словами, к повышению свертываемости крови. В редких случаях, у людей старшего возраста это может повышать риск инфаркта и инсульта, которые возникают по причине образования микротромбов в питающих сосудах.
Чтобы исключить вред стероидов для сердца, в возрасте старше 40 лет, а также лицам с повышенным содержанием тромбоцитов в крови и повышенной свертываемостью крови в анамнезе рекомендуется использовать антиагреганты: Аспирин кардио в дозе 100 мг в сутки, кардиомагнил в дозе 75 мг на ночь после ужина. Данные препараты подавляют агрегацию тромбоцитов и исключают возможность образования тромбов в сосудах. Однако не рекомендуются лицам, страдающим гастритом и язвенной болезнью желудка и двенадцатиперстной кишки, а также любыми заболеваниями ЖКТ в фазе обострения.
Вирилизация [ править | править код ]
Данные симптомы возникают особенно часто при использовании препаратов с низким анаболическим индексом.
Остановка роста [ править | править код ]
Это необратимое состояние. Актуально только в молодом возрасте, когда зоны роста костей еще не закрыты. По этой причине не рекомендуется принимать анаболические стероиды в возрасте моложе 25 лет. [11]
Особенно выражен этот эффект у ароматизируемых препаратов.
Гипертрофия простаты [ править | править код ]
Прежде всего нужно сказать, что стероидные средства только в редких случаях способствуют увеличению простаты, и это происходит как правило в возрасте после 40, при наличии генетической предрасположенности.
В качестве основной причины, также как и в случае с облысением, выдвигается дигидротестостерон.
В качестве профилактики и лечения с успехом применяется Финастерид. Читайте также: Низкоандрогенные курсы
Бесплодие [ править | править код ]
Правильнее будет сказать не бесплодие, а временная стерильность, что связано с изменением гормонального фона в организме. К счастью, это полностью обратимое состояние. [12]
Для более быстрого восстановления используются антиэстрогены (Тамоксифен, Кломифен, Торемифен), хорионический и менопаузальный гонадотропины человека.
Атрофия яичек [ править | править код ]
За счет механизма обратной связи, который был упомянут выше, снижается выработка естественного гонадотропина. Этот гормон постоянно стимулирует яички, если его концентрация снижается, ткани яичка начинают атрофироваться.
Атрофия яичек может быть необратима в тяжелых случаях! Это в свою очередь может приводить к импотенции.
К счастью его легко предотвратить с помощью инъекций гонадотропина, по описанной выше схеме. Атрофия яичек развивается крайне редко и только при использовании больших доз во время длительных курсов.
Гонадотропин необходим только при длительных курсах (более 1,5-2 месяцев) с использованием больших доз.
Мифический вред стероидов [ править | править код ]
В данном разделе постараемся перечислить наиболее популярные мифы, связанные с побочными эффектами стероидов:
Читайте также [ править | править код ]
Предупреждение [ править код ]

Злоупотребление анаболическими стероидами
Злоупотребление анаболическими стероидами – регулярный прием стероидных гормонов, которые являются производными естественного гормона тестостерона. Широко распространено среди спортсменов, особенно профессиональных. Нередко возникает у людей, занимающихся бодибилдингом (в том числе и на любительском уровне). Анаболики стимулируют рост мышечной массы, увеличивают силу мышц. При постоянном употреблении негативно влияют на печень и эндокринную систему. Существуют исследования, подтверждающие развитие психологической зависимости от анаболических стероидов.
Общие сведения
Злоупотребление анаболическими стероидами – распространенная проблема среди спортсменов. Анаболики используют практически во всех видах спорта, существуют данные о том, что в олимпийских видах спорта «чистыми» от анаболических стероидов остались только фигурное катание и женский хоккей на траве. С 1974 года анаболики включены в список спортивных допингов, что позволило сократить их употребление. Препараты этой группы пользуются большой популярностью среди поклонников бодибилдинга, нередко их начинают употреблять чуть ли не с первого посещения тренажерного зала.
Многие пациенты на момент первого приема еще не достигли возраста 16 лет. Ранний возраст начала употребления увеличивает вероятность развития разнообразных осложнений. Во-первых, употребление гормонов до завершения взросления может нанести серьезный вред эндокринной системе и другим органам. Во-вторых, подростки нетерпеливы, им нужно «все и сразу», что приводит к приему запредельно высоких доз. Вместе с тем, анаболики представляют опасность не только для подростков, но и для взрослых. Препараты этой группы не являются психоактивными веществами, однако из-за развития зависимости данной проблеме уделяют внимание не только эндокринологи и спортивные врачи, но и специалисты в сфере психиатрии и наркологии.
Анаболические стероиды
Анаболические стероиды – группа препаратов, изготовленных на базе тестостерона. Тестостерон является основным мужским гормоном. Он оказывает влияние на развитие мужских половых органов и появление вторичных половых признаков (оволосение, в том числе – появление волос на лице, формирование заметного кадыка, облысение, малое количество жира, мужской тип фигуры с узким тазом и широкими плечами). Все перечисленные эффекты называются андрогенным действием. Кроме того, тестостерон оказывает анаболическое действие, замедляя выведение азота и стимулируя синтез белка в мышцах.
В клинической практике анаболические стероиды у мужчин используют при задержке полового созревания, недостаточности функций половых желез вследствие гипоплазии яичек или их удаления (например, по поводу злокачественного образования). У женщин небольшие дозы анаболиков применяют при фиброзно-кистозной мастопатии, эндометриозе и некоторых расстройствах в постменопаузе. Кроме того, препараты этой группы назначают пациентам обоих полов при лечении после тяжелых травм, крупных операций, обширных ожогов, хронических инфекций и т. д.
Распространение и причины приема анаболических стероидов
Среди спортсменов анаболики стали популярными в 50-х годах прошлого века. Вначале препараты принимали только мужчины-тяжелоатлеты, затем к ним присоединились другие спортсмены, в том числе и женщины. Бесконтрольный прием продолжался до 1964 года. Затем употребление гормонов постепенно стали ограничивать, а 1974 году они были официально включены в список допингов. Тем не менее, анаболики продолжают использоваться, часто – в любительском спорте, где нет таких жестких проверок и ограничений. Препараты этой группы особенно популярны среди поклонников бодибилдинга. Производные тестостерона покупают в тренажерных залах (в том числе и в виде биодобавок), выписывают через Интернет и т. д.
Стероиды принимают внутрь, внутривенно или внутримышечно. Средства для перорального приема оказывают более выраженное разрушительное действие на печень. Они быстрее выводятся из организма, поэтому спортсмены выбирают их в период подготовки к соревнованиям, чтобы потом благополучно пройти допинг-контроль. Растворы для внутривенного и внутримышечного введения меньше действуют на клетки печени, однако при их приеме возрастает опасность инфицирования через нестерильный шприц. Возможны флебиты, абсцессы и другие осложнения.
Впервые анаболики употребляют, как правило, в юношеском возрасте. Стимулом к приему препарата становится пример ровесников, присущая возрасту нетерпеливость и желание как можно быстрее обрести спортивное привлекательное тело. В группах людей, занимающихся бодибилдингом, может быть распространена «философия» приема анаболиков, как обязательного условия хорошего эффекта от занятий. Молодые люди с неокрепшей психикой перенимают эту «философию», что ведет к резкому повышению значимости анаболических стероидов в личной системе мировоззрения. При длительном приеме возникает психологическая зависимость.
Действие анаболических стероидов на организм
Стероиды способствуют быстрому росту мышечной массы и усилению силы мышц. Однако эти эффекты достигаются только при постоянных, грамотно организованных тренировках. Прием анаболиков без физической нагрузки приводит к некоторому уменьшению содержания жира и немного активизирует рост мышц, но эти изменения малозаметны и практически не отражаются на внешнем облике. Даже при тренировках для достижения заметного эффекта необходимы дозы препаратов, во много раз превышающие уровень естественного тестостерона в организме. Такое грубое вмешательство в обмен веществ оборачивается целым рядом побочных эффектов.
Прием анаболиков в подростковом возрасте приводит к преждевременному прекращению роста. Увеличивается вероятность появления угревой сыпи. Может развиться облысение (как у юношей, так и у девушек). Иногда алопеция сохраняется даже после отмены средства. У взрослых мужчин стероиды угнетают продукцию тестостерона яичками. При длительном употреблении возможна стерильность и уменьшение размера яичек. Обычно эти процессы обратимы, при полной отмене анаболиков синтез естественных гормонов и продукция спермы восстанавливаются, сперматозоиды примерно в течение полугода обретают способность к оплодотворению. У некоторых мужчин развивается необратимая гинекомастия (увеличение молочных желез).
У женщин нередко наблюдается рост волос на лице и на теле, при большом «стаже» употребления может возникать необратимое увеличение и огрубление клитора. Прием анаболических стероидов лицами обоих полов влечет за собой нарушение функций печени. При длительном приеме развивается стероидный токсический гепатит, исходом которого может стать цирроз печени и прогрессирующая печеночная недостаточность. Повышается вероятность развития сахарного диабета. Кожа становится более жирной и чаще инфицируется. Возможно выпадение волос на голове.
Стероиды негативно влияют на иммунную систему, приводя к снижению уровня глобулинов в крови. Организм пациента становится более восприимчивым к инфекциям, возникают частые простуды, нередко – с осложнениями (бронхитами, пневмониями, синуситами). Чаще нагнаиваются случайные раны и ссадины. Сердце при приеме анаболиков увеличивается, однако рост сердечной мышцы опережает рост сосудов. В толще мышечной ткани, не получающей достаточно питательных веществ, возникают очаги некроза. Описаны случаи внезапной смерти в результате сердечного приступа.
Прием анаболиков провоцирует повышение уровня коллагена и снижение уровня эластина в сосудистой стенке. Сосуды становятся менее эластичными. Повышается уровень холестерина. Все перечисленное увеличивает риск развития сосудистых осложнений. Соединительная ткань «отстает» в росте от мышечной ткани, что влечет за собой высокий уровень травматизации. У пациентов, регулярно употребляющих анаболики, чаще возникают разрывы связок и сухожилий.
Стероиды не оказывают непосредственного повреждающего действия на клетки мозга, однако они определенным образом влияют на поведение пациента. Возможны выраженные колебания настроения – от радости до апатии и уныния. Часто наблюдается повышение уровня агрессии, склонность к спорам, вспышки раздражительности. Нередко возникает тяга к насилию или рискованному поведению. У некоторых больных развиваются депрессивные расстройства и стероидные психозы.
Синдром отмены при употреблении анаболических стероидов пока недостаточно изучен. Установлено, что прекращение приема часто сопровождается субдепрессиями, депрессиями и мыслями о суициде. Выделяют две фазы синдрома отмены. Продолжительность первой фазы составляет около 1 недели. Может наблюдаться повышение температуры, боли в суставах (артралгии), насморк и другие симптомы, напоминающие простудное заболевание.
Вторая фаза длится до полугода. Острые соматовегетативные проявления не выражены, превалируют расстройства настроения, нарушения сна, снижение аппетита, быстрая утомляемость и недовольство собой. Отмечается потребность принять анаболические стероиды. Спортсмены часто употребляют анаболики циклами. Чтобы избежать синдрома отмены, пациенты даже во время перерыва продолжают принимать небольшие дозы препарата, мотивируя это необходимостью не допустить отвыкания организма, которое якобы повлечет за собой снижение эффектов стероидов.
Лечение и прогноз при злоупотреблении анаболическими стероидами
Выраженные колебания настроения, суицидальные мысли и потребность в стероидах при попытке прекратить прием препарата являются поводом для обращения к наркологу. Из-за опасности развития депрессии план отмены анаболических стероидов определяется индивидуально для каждого пациента, возможно как единовременное, так и постепенное прекращение употребления. Препараты отменяют на фоне поддерживающей психотерапии. Медикаментозная терапия обычно не требуется, при необходимости могут назначаться успокоительные и антидепрессанты.
Прогноз при злоупотреблении анаболическими стероидами зависит от состояния организма пациента и уровня его мотивации. Отмена препарата не влечет за собой выраженных физических страданий, психологические нарушения обычно корректируются в течение полугода. Большинство соматических и эндокринных расстройств носят преходящий характер и постепенно исчезают после отмены препаратов. Наибольшую опасность представляет поражение печени. При наличии токсического гепатита необходимо лечение у гастроэнтеролога. При отсутствии мотивации прогноз ухудшается, наблюдаются срывы.
Чем вредны анаболики для мужчин
В последнее время бесплодие становится проблемой для все большего количества пар. Одной из причин бесплодия является вторичный гипогонадизм. Использование определенных лекарственных препаратов и некоторых видов лечения, различные токсины могут привести к снижению выработки гонадотропин-рилизинг-гормона (ГнРГ). Вторичный дефицит ГнРГ приводит к снижению выработки передней долей гипофиза гонадотропных гормонов гипофиза лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) и, как следствие, к недостаточности гонад. К лекарственным препаратам, влияющим на выработку ГнРГ, относятся анаболические андрогенные стероиды (ААС). К группе риска немедицинского применения ААС относятся непрофессиональные спортсмены и лица, занимающиеся рекреационной физической активностью [1].
Следует учитывать и тот факт, что, помимо целенаправленного применения ААС для совершенствования физической формы и повышения мышечной массы и силы, в организм спортсмена стероиды могут попадать и со спортивным питанием. В 15% случаев ААС обнаруживают в спортивном питании, что ассоциировано с риском его негативного влияния на репродуктивную систему [2].
Вместе с отрицательным отношением общества к стероидам как к допингу, стали накапливаться данные о негативном влиянии этой группы препаратов на организм человека. Оказалось, что злоупотребление ААС может быть причиной вторичного гипогонадизма и бесплодия.
Цель нашего обзора – изучение использования ААС, оценка патологического влияния ААС на организм человека и методов по восстановлению фертильности у пациентов после их отмены. Для выполнения поставленной цели оценивали имеющиеся данные по распространенности применения ААС, уточнили спектр применяемых препаратов, выяснили негативное воздействие ААС на организм человека, уточнили механизм воздействия их на репродуктивную систему мужчин, выявили особенности диагностики стероид-индуцированного гипогонадизма, рассмотрели применяемые методы по восстановлению фертильности у пациентов после отмены ААС. Полученные данные необходимы для разработки современных алгоритмов лечения стероид-индуцированного гипогонадизма у мужчин. Поиск и отбор литературы осуществлялись на сайте eLIBRARY.RU и в базах научных публикаций PubMed (MEDLINE), Google Scholar, The Cochrane Librar. Поисковыми запросами служили термины «анаболические андрогенные стероиды» («Anabolic Androgenic Steroids»), «тестостерон» («Testosterone»), «мужской гипогонадизм» («Male Hypogonadism»), «атлеты и непрофессиональные спортсмены» («Athletes and Recreational Users»), «распространенность» («Prevalence»), «злоупотребление стероидами» («Steroid Abuse») как по отдельности, так и в комбинации друг с другом. Поиск в PubMed ограничивали фильтрами: тип статей (Review article, Practict Gudeline, Journal Article), дата публикации (publication date: 20 years), возрастная группа (age group: 19+ years). Критерии включения исследований в обзор: участники были спортсменами или рекреационными пользователями 19 лет и старше, мужского пола; использование любых AAС и в любой форме и дозах; мужской гипогонадизм.
История открытия андрогенных анаболических стероидов
Первая половина XX века ознаменовалась открытием и синтезом стероидов. Этим событиям предшествовала долгая история изучения роли семенных желез в организме. В научной литературе впервые упоминание о пересадке яичек датировано 1767 г. На важную роль семенных желез указал Бертольд в 1846 г., связав изменения в физиологии и поведенческих реакциях после кастрации с секретом тестикул [3]. В 1889 г. Шарль Броун-Секар опубликовал свой личный опыт подкожного введения экстракта, полученного из яичек морских свинок и собак, с омолаживающей целью [4]. Некоторое время была популярна хирургическая пересадка или «прививка» срезов яичек с целью увеличения работоспособности, выносливости, мышечной силы (С. Воронов, 1930). Однако, действие подсадки было кратковременным, требовались повторные операции, приносящие еще меньший эффект. Эффективность метода была признана сомнительной.
Нобелевская премия 1939 г. по химии была вручена Адольфу Бутенданту за синтез половых гормонов эстрогенов и андростерона, а также Леопольду Ружичка за определение молекулярной структуры тестостерона и частичный синтез андростерона и тестостерона из холестерина [5]. Промышленное производство тестостерона способствовало быстрому развитию целого направления в медицине – андрологии, отрасли науки и медицины, занимающейся репродуктивными функциями мужчины в физиологических и патологических условиях. С 1958 г., когда FDA одобрила Метилтестостерон (синтетическую форму для орального применения), началась новая эра применения стероидов [5]. Тестостерон и его производные начали активно использовать бодибилдеры для увеличения мышечной массы и силы в конце 1940-х, начале 1950-х годов [5]. Более того, в 1997 г. ученый N. Evans обратил внимание на факт использования ААС в большей мере для улучшения композиции тела и достижения желаемого косметического эффекта, а не для улучшения спортивных показателей [6]. Вместе с тем в 1960-х годах вновь стало популярным введение клеток яичек из-за убеждения, что это приводит к увеличению синтеза производных тестостерона. Среди получавших данный вид терапии были такие известные люди, как Папа Римский Пий XII, Бернард Барух, Аристотель Онассис [3]. Во всех перечисленных примерах главным действующим веществом был основной мужской гормон тестостерон, обладающий уникальными свойствами.
Свойства тестостерона
Под влиянием тестостерона происходит развитие мужских половых органов, появление вторичных половых признаков, активируется сперматогенез, формируется поведение по мужскому типу, регулируются азотистый и фосфорный обмены. Тканями-мишенями для тестостерона являются клетки семенных канальцев, придатки яичка, предстательная железа, семенные пузырьки, гипоталамус. В этих тканях в основном и проявляется основное биологическое действие тестостерона.
Регуляция выработки тестостерона в организме
Тестостерон синтезируется из холестерина в большем количестве в мужских семенниках клетками Лейдига, в меньшем количестве в яичниках у женщин и пучковой и сетчатой зонами коры надпочечников у мужчин и женщин. На синтез андрогенов влияют внешние факторы, такие как питание, свет, половое поведение. Нейроэндокринная регуляция контролируется осью гипоталамус-гипофиз-гонады. По принципу отрицательной обратной связи низкая концентрация тестостерона в крови повышает выработку ГнРГ, стимулирующего продукцию передней долей гипофиза ЛГ и ФСГ. ЛГ усиливает выработку тестостерона клетками Лейдига. ФСГ активирует продукцию клетками Сертоли ингибина и андрогенсвязывающего белка. Тестостерон стимулирует спермиогенез, половое возбуждение. Соответственно высокая концентрация тестостерона через механизм отрицательной обратной связи блокирует секрецию ГнРГ, ФСГ и Л.Г. Ингибин через механизмы обратной связи подавляет секрецию ФСГ.
Использование ААС мужчинами-атлетами повышает концентрацию андрогенов в сыворотке крови, что приводит к угнетению выработки собственного тестостерона, сперматогенеза и является причиной развития вторичного гипогонадизма.
Вторичный гипогонадизм
Гипогонадизм у мужчин – это клинический и биохимический синдром, связанный с низким содержанием тестостерона, также нечувствительностью рецепторного аппарата к андрогенам, который может оказывать негативное воздействие на множество органов и систем, ухудшая качество жизни и жизненный прогноз [7].
Распространенность гипогонадизма увеличилась в последние десятилетия. Среди североамериканцев в возрасте от 45 лет и старше гипогонадизм выявлен в 38,7% случаев [8]. Одной из причин гипогонадизма, вносящей существенный вклад в увеличение его распространенности, как уже отмечалось выше, является использование ААС. Увеличение распространенности использования ААС, наряду с увеличением возраста отцовства, приводит к тому, что клиницисты сталкиваются с большим количеством молодых мужчин и мужчин среднего возраста, которые обращаются за помощью в лечении бесплодия [9]. ААС оказывают на гипоталамо-гипофизарно-гонадную ось тестостероноподобное действие, характеризующееся снижением синтеза эндогенного тестостерона и нарушением сперматогенеза. Прекращение приема ААС может приводить к спонтанному восстановлению репродуктивной функции [10]. Но восстановление фертильности после использования ААС осложняется «допинговой полипрагмазией», когда применяют два и более препарата ААС в супрафизиологических дозировках в сочетании с нестероидными препаратами такими, как гормон роста, кленбутерол, эфедрин, инсулин, тироксин, ИФР-1, амфетамины, диуретические средства [11]. Поэтому по данным других источников, нарушение фертильности могут быть необратимыми [12].
Распространенность применения ААС
Установить точное количество пользователей ААС сложно. Опубликованы данные по количеству пользователей ААС в США почти 2 млн взрослых пользователей ААС [13], но этот показатель основан на рецептурных продажах ААС и без учета интернет продаж. Так же известно, что распространенность использования ААС отмечается в разных возрастных группах. Например, в Швеции, среди 16- и 17-летних спортсменов использование ААС составляет 3,6 и 2,8% соответственно [14]. По данным глобального метаанализа распространенность использования ААС в мире составляет 6,4% среди мужчин и 1,6% среди женщин [15]. Одной из причин роспуска Всемирной федерации бодибилдинга (World Bodybuilding Federation, WBF) в 1992 г. была популяризация стероидов. Благодаря контролю Всемирного антидопингового агентства (WADA) использование ААС среди профессиональных спортсменов в настоящее время встречается редко [16]. Однако число пользователей ААС среди непрофессиональных атлетов и лиц, занимающихся физической рекреационной активностью, остается значительным [14]. Точное количество пользователей ААС не поддается учету в связи с тем, что приобретение и самостоятельное использование стероидов вступает в конфликт со многими национальными законодательствами [17].
Оценка распространенности проблемы осложняется еще и тем, что более 50% пациентов с гипогонадизмом и злоупотреблением ААС в анамнезе скрывают факт использования от клиницистов [18]. Данные по распространенности использования ААС в РФ отсутствуют.
Классификация препаратов ААС
Изучение фармакологических свойств тестостерона показало, что структурные изменения молекулы тестостерона могут привести к усилению его анаболической активности с сохранением андрогенного эффекта. В связи с этим термин «андрогенные анаболические стероиды» (ААС) наиболее точно описывает эту группу препаратов. Используемые препараты ААС с анаболической целью оказывают на организм и андрогенный эффект, что может приводить к развитию осложнений, таких как рак предстательной железы и сердечно-сосудистые осложнения. Поэтому проводится постоянный поиск решений, связанных с устранением негативного влияния тестостерона на организм. Так, для уменьшения андрогенного эффекта, но с акцентом на анаболические свойства, разработана группа препаратов – селективные модуляторы андрогенных рецепторов, которые обладают выраженным анаболическим эффектом и при этом не влияют на предстательную железу и сердечно-сосудистые исходы [19, 20].
Накопленные данные о существующих и перспективных модификациях молекулы тестостерона и его производных ставят перед исследователями задачу их классификации. Guilherme Leme de Souza предлагает условно разделить препараты ААС по способу их применения [21]. Так, для использования тестостерона перорально были разработаны 17-α-алкилированные стероиды. Замена 17-го атома водорода в стероидном кольце на метильную или этильную группу позволяет предотвратить разрушение стероида при первичном прохождении через печень. Для поддержания соответствующей концентрации в крови препараты этой группы должны приниматься ежедневно. Необходимо помнить о гепатотоксичном их влиянии [21]. Представители этой группы: Метилтестостерон, Оксандролон, Станазолол.
Для парентерального использования молекула тестостерона (вернее его 17-β-гидроксиальная группа) подвергается этерификации кислотным фрагментом, которая предопределяет скорость высвобождения препарата в кровоток. Как оказалось, данные препараты имеют более длительный период полувыведения и обладают меньшей гепатотоксичностью, чем оральные препараты [21].
Другие авторы [22–24] предлагают классифицировать ААС по их активному компоненту: Тестостерон, 19-нортестостерон, Болденон и Тренболон.
Исходя из соотношения анаболического и андрогенного эффектов, ААС можно классифицировать следующим образом [21]:
1) препараты, обладающие тестостерон-подобным эффектом, – с соотношением анаболического эффекта к андрогенному 1:1 (данные препараты подвергаются действию ферментов ароматазы и 5-α-редуктазы);
2) препараты с дигидротестостерон-подобным эффектом, – обладают более выраженным андрогенным эффектом и менее выраженной анаболической активностью, по строению схожи с молекулой дигидротестостерона и поэтому не ароматизируются (к этой группе препаратов относятся Оксандролон, Станазолол и другие);
3) препараты, обладающие нандролон-подобным эффектом, – имеют наиболее выраженную анаболическую и низкую андрогенную активность, а также прогестиновую активность (в нее входят препараты Нандролона и Тренболон).
Давая характеристику всей группе ААС, следует отметить, что:
1) все ААС обладают свойствами увеличивать объем мышечной массы и уменьшать жировую массу [25];
2) играют роль агонистов минералокортикоидных рецепторов, что приводит к задержке жидкости и натрия [26];
3) обладают антагонистическим действием на глюкокортикоидные рецепторы [27];
4) повреждают допаминергическую-мезолимбическую цепь, гипоталамическую опиоидную и адренергическую систему [28].
Оценка воздействия на организм человека
Влияние тестостерона на мышечную и жировую ткань
Тестостерон-индуцированное увеличение мышечной массы связано с гипертрофией мышечных волокон как I, так и II типов, увеличением ядер мышечных клеток и сателлитных клеток [29]. Тестостерон способствует дифференцировке мезенхимальных, мультипотентных клеток в миогенную линию и ингибирует их дифференцировку в адипогенную линию [30]. Андрогены регулируют дифференцировку мезенхимальной мультипотентной клетки путем связывания с андрогеновым рецептором (АР) и способствуют связи АР с В-катенином, транслокации комплекса AР-В-катенин в ядро, что приводит к активации Т-клеточного специфического транскрипционного фактора 4 (TCF-4) [30]. Активация TCF-4 модулирует ряд WNT-регулируемых генов, которые способствуют миогенной дифференциации и ингибируют адипогенную дифференцировку. Тестостерон, вероятнее всего, имеет альтернативный, не геномный механизм действия на мышечную ткань, он усиливает синтез белков в мышцах, и увеличивает реутилизацию (повторное использование) аминокислот мышцами [30].
Метаболизм тестостерона определяется взаимодействиями с ферментами 5-α-редуктазой и ароматазой, эффект которых заключается в конверсии тестостерона в дигидротестостерон и эстрадиол соответственно. Пока не получены данные о том, что конверсия в дигидротестостерон необходима для реализации андрогенных эффектов в мышцах, так как 5-α-редуктаза II типа, которая конвертирует тестостерон в дигидротестостерон, в мышцах экспрессируется в небольших концентрациях [24, 25].
Влияние на углеводный обмен
Имеются противоречивые данные о воздействии ААС на углеводный обмен [31]. Высокая концентрация тестостерона у женщин ассоциирована с развитием гиперинсулинемии и увеличением висцерального жира [32]. У мужчин снижение концентрации тестостерона является риском развития сахарного диабета 2-го типа [33]. Исследований, предоставляющих исчерпывающие данные о влиянии супрафизиологических доз ААС на углеводный обмен, недостаточно [34]. Проведенное нами исследование по изучению влияния ААС на углеводный обмен показало, что после отмены ААС при сохранении прежних нагрузок и пищевого режима через 3 мес ИМТ увеличился (средняя разница = 4,7 кг; p=0,012), метаболизм глюкозы изменился в сторону увеличения всех рассматриваемых показателей: глюкоза натощак (средняя разница = 1,02 ммоль/л; p=0,047), иммунореактивный инсулин (средняя разница = 9,83 мкЕД/мл; p=0,023), индекс HOMA-IR (средняя разница = 7,31; p= 0,015) и HbA1c (средняя разница = 0,25%; p=0,031). Однако нарушений метаболизма глюкозы не было выявлено ни в одном случае [35].
Влияние на сердечно-сосудистую систему
Установлено, что ААС могут влиять на реактивность сосудов и систему оксида азота, что может приводить к окклюзии коронарных артерий и развитию инфаркта миокарда [36]. Описаны несколько случаев ассоциации тромбозов и приема ААС [37]. Исследователи R. Melchert и A. Welder [37] предложили рассматривать три основные гипотетические модели стероид-индуцированных сердечно-сосудистых осложнений. Первая – атерогенная модель, связанная с развитием дислипидемии и тромбозов. Вторая – модель вазоспазма коронарных артерий, объясняющая развитие инфаркта миокарда без атеросклероза и тромбозов, так как ААС снижают сосудистую реактивность на воздействие оксида азота. Третья – модель прямого повреждения, когда происходит нарушение нормальной морфологии митохондрий. Это приводит к снижению аэробной продукции энергии и повреждению клеток миокарда, развитию волокнистой соединительной ткани и возможному развитию фатальных желудочковых аритмий.
Риск развития онкологических заболеваний
Злоупотребление ААС напрямую связывают с развитием гепатоцеллюлярной карциномы, а также развитием саркомы мягких тканей [38]. Описан ряд случаев развития почечно-клеточной аденокарциномы почек у спортсменов на фоне использования ААС [39]. Значительно реже развиваются гепатоцеллюлярная карцинома и нефробластома Вильмса. Развитие лейомиосаркомы яичка было описано у молодого спортсмена через 9 лет после отмены приема ААС. Этому предшествовал прием на протяжении 5 лет препарата 4-хлородегидрометилтестостерона (Туринабол) в высокой дозировке 100 мг в сут (20 таблеток в день), совместно с инъекционным препаратом тестостерона. В этом случае прослеживается наличие причинно-следственной связи между развитием новообразования и использованием ААС [40].
Влияние ААС на репродуктивную систему мужчин
Подавление репродуктивной системы методом отрицательной обратной связи является одним из наиболее значимых побочных эффектов ААС. Точное время, необходимое для восстановления гипоталамо-гипофизарной-гонадной оси после использования ААС в супрафизиологических дозировках, неизвестно. Имеющиеся данные по восстановлению фертильности основываются на исследованиях по мужской контрацепции. Установлено, что после использования препаратов тестостерона 67% мужчин восстановили сперматогенез и достигли концентрации сперматозоидов более 20 млн/мл за 6 мес, у 90% восстановление заняло 12 мес, 96% восстановились за 16 мес и 100% – за 24 мес [41]. Имеются данные, которые говорят о спонтанном восстановлении оси гипофиз-гонады в период от 4 до 12 мес [42], однако, с другой стороны, описаны случаи стойкого нарушения фертильности до 3–6 лет [12, 42, 43].
Ряд исследований продемонстрировали, что на фоне приема ААС могут быть нормальные показатели спермограммы, полиспермия, а также тяжелая олигоспермия и азооспермия. Изменения количественных показателей сопровождаются нарушением изменения подвижности и морфологии сперматозоидов [42, 43].
Введение ААС экспериментальным животным выявило повреждение клеток Лейдига, развитие клеточных аномалий и при сочетании с физическими нагрузками увеличение скорости апоптоза сперматогенных клеток [44].
Воздействие на генетический материал клетки
Наличие глубоких повреждений сперматогенеза устанавливалось с помощью использования метода гибридной флуоресценции in situ (FISH). Были выявлены дисфункции ХY хромосом, а также 1 и 9 хромосомы, что может указывать на аномалии в мейотическом процессе и генетическом повреждении у людей, злоупотребляющих ААС [45]. Также зафиксированы генетическая нестабильность (увеличение пикноза, кариолизиса, кариорексиса) и цитотоксичность в клетках слизистой оболочки полости рта у пользователей ААС (Дека-дураболин, Винстрол) спустя 2 мес после отмены препаратов [46].
Побочные эффекты
Особое значение имеет возраст начала применения допинга. Использование ААС в подростковом возрасте может привести к преждевременному половому созреванию, закрытию зон роста. Использование ААС взрослыми мужчинами может иметь ряд последствий, которые включают нарушение мочеиспускания за счет увеличения предстательной железы, задержку жидкости и повышение артериального давления, андрогенную алопецию, акне, развитие гинекомастии на фоне повышения концентрации эстрадиола, тестикулярную атрофию, нарушение сперматогенеза и бесплодие [12, 19, 21]. Установлено также, что применение ААС в высоких дозах может привести к изменению психического статуса: повышается уровень агрессии, склонность к физическому и сексуальному насилию. Отмена препаратов, прекращение приема ААС приводит к выраженному синдрому отмены [5].
Тяжесть побочных эффектов от приема ААС зависит от ряда факторов: тип и комбинация ААС, доза и длительность использования. Случаев острой передозировки ААС зафиксировано не было. Следует отметить, что дозировка тестостерона в рамках заместительной гормональной терапии (ЗГТ), которая вызывает гипогонадизм, составляет 75–100 мг в неделю, дозы в 200–250 мг тестостерона вызывают олигоспермию. Поэтому дозы препаратов, которые используются в качестве допинга, 1000 мг в неделю и больше, гарантированно угнетают ось гипоталамус-гипофиз-гонады и являются причиной снижения фертильности [47].
Стероиды принимают так называемыми «курсами», от 6 до 12 нед и дольше, часто совмещают 2 и более препарата одновременно. В начале курса применяют небольшие дозировки препаратов, далее доза увеличивается до более высоких, затем дозировка снова снижается. При достижении максимальной эффективной дозировки препарата возникает «тренировочное плато», когда прекращается рост тех или иных физических параметров (силы, мышечной массы, выносливости и так далее) вследствие мышечной адаптации к стереотипным нагрузкам, для преодоления которого проводится замена используемых препаратов [36].
Повреждение сердечно-сосудистой системы приводит к развитию стероид-индуцированной гипертрофии миокарда, данный эффект является дозозависимым [36]. В некоторых исследованиях эти изменения оказались необратимыми и оставались после отмены ААС [36, 37]. Также использование ААС может приводить к увеличению дисперсии интервала QT, что на фоне гипертрофии миокарда может приводить к повышению риска фатальных аритмий [48].
Негативное влияние на сердечно-сосудистую систему усиливается развитием дислипидемии. ААС повышают содержание ЛПНП и снижают содержание ЛПВП, и, хотя эти изменения обратимы, у людей, использующих ААС, увеличивается риск развития кардиальной патологии в 3 раза [36]. Механизм развития дислипидемии до конца не ясен. Предполагается, что главная роль в патогенезе принадлежит печеночной триглицеридной липазе. Следует отметить, что ААС также влияют на тромбообразование – стимулируют тромбоциты к агрегации. Однако на сегодняшний день нет прямых доказательств, подтверждающих, что ААС приводят к развитию атеросклероза, хотя описаны несколько случаев развития инфаркта миокарда у молодых спортсменов и использования ААС [36, 37].
Особенности диагностики стероид-индуцированного гипогонадизма
Особенностью диагностики стероид-индуцированного гипогонадизма является качество собранного анамнеза. В одном из исследований информацию про использование ААС скрывали от клиницистов 56% пациентов с гипогонадизмом, употреблявшие ранее стероиды [18]. Помимо целенаправленного выяснения самого факта применения ААС, необходимо также выяснить, использовались ли препараты хорионического гонадотропина человека, селективные модуляторы эстрогеновых рецепторов, блокаторы ароматазы, различные биологически активные добавки в попытках восстановить систему гипофиз-гонады в периоды применения ААС либо после в так называемой ПКТ (применяемый в бодибилдинге набор медикаментов для минимизации побочных эффектов использования стероидов, «Послекурсовая терапия», «Post-cycle therapy») [19, 21].
Эффективность различных препаратов в репродуктивной реабилитации после отмены ААС
Большинство сведений по лечению стероид-индуцированного гипогонадизма основываются на опыте лечения конкретных клинических пациентов. Не существует единого протокола лечения вторичного гипогонадизма для пользователей ААС. Но в каждом случае прежде всего необходимо выяснить, какую конечную цель ставит перед нами пациент. Возможно, это облегчение симптомов гипогонадизма, но может быть и репродуктивная реабилитация.
Тестостерон
Механизм нарушения фертильности при вторичном гипогонадотропном гипогонадизме, развившегося после тестостеронзаместительной терапии возрастных, физиологических изменений и после применения ААС в целях коррекции фигуры и повышения спортивных показателей одинаков. Назначаемый экзогенный тестостерон уменьшает производство гонадотропинов, что приводит к подавлению выработки собственного тестостерона и снижению сперматогенеза вплоть до азооспермии (выявлена у 40% мужчин на тестостеронзаместительной терапии) [21]. Проведенное в США исследование причин и частоты выписки рецептурного тестостерона по данным страховых компаний выявило существенное увеличение использования тестостерон-заместительной терапии более чем в 3 раза, с 0,81% в 2001 г. до 2,91% в 2011 г. Наиболее распространенной причиной начала заместительной гормональной терапии был «гипогонадизм» (50,58%), далее следовали: «усталость» (34,49%), «эректильная дисфункция» (31,88%) и «психосексуальная дисфункция» (11,75%) [49]. Среди показаний к назначению тестостеронзаместительной терапии в качестве причины ни в одном случае не указан предшествующий прием ААС. Возможно, за диагнозами «усталость» и «психосексуальная дисфункция» скрывается именно предшествующее применение стероидов. Здесь уместно сделать акцент на особенности сбора анамнеза у пациентов с симптомами гипогонадизма: рекомендовано задать вопросы относительно фармакологической терапии кортикостероидами, анаболическими стероидами [7, 48].
Гонадотропин-рилизинг-гормон
Лечение последствий высоких доз ААС, а именно олигозооспермии или азооспермии может проводиться по аналогии с лечением классического гипогонадизма на фоне синдрома Каллмана, синдрома Прадера-Вилли, пангипопитуитаризма при пролактиноме, различных опухолях головного мозга, последствий инфекционного повреждения или радиоактивного излучения, а также идиопатических случаях [43]. Пульсаторный прием препаратов ГнРГ, который достигается применением помпы, является наиболее физиологичным в данной ситуации, и приводит к наступлению беременности более чем в 80% случаев [50]. Однако условиями успешного лечения этим методом являются наличие неповрежденного гипофиза и достаточное финансирование.
Гонадотропин
По данным метаанализа G. Rastrelli [51], терапия препаратами гонадотропинов продемонстрировала эквивалентную эффективность по сравнению с терапией ГнРГ для нормализации сперматогенеза.
Хорионический гонадотропин
Комбинация препаратов хорионического гонадотропина (ХГЧ) и ФСГ приводит к более быстрому восстановлению сперматогенеза. Эффективность использования препаратов гонадотропинов с этой целью доказана рядом исследований [51, 52]. Предполагаемая эффективность данной терапии у пациентов после использования ААС и ЗГТ выше, так как они имели нормальное развитие в пубертатном периоде [1]. Исходя из исследования M. Depenbusch и соавт. [52] следует, что поддержание качественных характеристик сперматогенеза, после его индукции препаратами ГнРГ или ХГЧ и МГЧ, возможно при использовании препарата ХГЧ в качестве монотерапии. Комбинация препаратов ХГЧ с препаратами ФСГ, селективными модуляторами эстрогеновых рецепторов и блокаторов ароматазы приводит к нормализации сперматогенеза у мужчин, которые получали заместительную гормональную терапию различными препаратами тестостерона [53]. Также имеются данные о том, что использование препаратов ХГЧ на фоне заместительной гормональной терапии рекомендуется для поддержания нормального сперматогенеза [54].
Ингибиторы ароматазы
Фермент цитохрома Р450 ароматаза необратимо превращает андрогены в эстрогены [55]. Ингибиторы ароматазы (ИА) в лечении мужского бесплодия применяют с целью изменения соотношения тестостерона к эстрогену. Нормальным считается отношение тестостерона (нг/дл): эстрадиол (нг/л), равным выше 10 [56]. Известно, что эстроген оказывает отрицательное влияние на сперматогенез [55]. Применяя И.А., можно снижать концентрацию эстрогена, улучшая параметры спермы у пациентов. Проведенные исследования влияния ингибитора ароматазы на сперматогенез указали на значимое увеличение концентрации тестостерона, однако не всегда наблюдалось улучшение в показателях спермограммы [57]. Таким образом, способность этой группы препаратов улучшать показатели спермограммы вызывает дискуссию. Однако недавно исследователи продемонстрировали эффективность их использования у не мозаичного пациента с синдромом Кляйнфельтера [58].
Селективные модуляторы эстрогеновых рецепторов
В 1966 г. впервые были использованы препараты селективных модуляторов эстрогеновых рецепторов у мужчин с целью улучшения фертильности (Тамоксифен, Ралоксифен, Кломифен, Фульвестран). Схемы использования препарата довольно различны и отличаются дозировкой, длительностью приема и цикличностью. Терапевтический диапазон дозировки препарата и схемы приема варьируют от 25 до 50 мг в сут либо с определенной цикличностью использования [59].
Ряд исследований отмечают благоприятное воздействие препарата Кломифена цитрат на концентрацию тестостерона, влияние на гипоталамо-гипофизарную ось, уменьшение клинических проявлений гипогонадизма и улучшение тестостерон/эстрадиолового соотношения [59]. С другой стороны, несмотря на благоприятные изменения в гормональном профиле и качестве сперматогенеза у пациентов с идиопатической олигоспермией или азооспермией с гипогонадизмом или без него, данные по достижению второй конечной точки в виде наступления беременности – противоречивы. Рандомизированных контролируемых исследований по использованию Кломифена цитрата для лечения гипогонадизма нет. Актуальность таких исследований подчеркивает клинический случай, который продемонстрировал развитие обратимой азооспермии у мужчин с изначальной олигоспермией на фоне терапии препаратом Кломифена цитрата [60].
Эффективность Кломифена цитрата для восстановления фертильности у мужчин после ЗГТ или использования ААС недостаточно изучена. Ряд клинических наблюдений указывают на восстановление системы гипофиз-гонады после приема Кломифена цитрата 100 мг в сут, однако сперматогенез при этом не оценивался [61]. В относительно небольшом исследовании с гетерогенной группой пациентов было отмечено восстановление системы гипофиз-гонады при использовании Кломифена цитрата в дозировке 50 мг 3 раза в сут [62]. Также был получен эффект при использовании Кломифена цитрата в дозировке 25 мг в сут для восстановления системы гипофиз-гонады при стероид-индуцированном гипогонадизме [24].
В этих исследованиях не были учтены типы препаратов, дозы ААС, не проанализированы данные о применении препаратов из других фармакологических групп.
Заключение
Использование с целью улучшения мышечной массы и силы ААС мужчинами, прошедшими нормальный пубертат, может быть причиной повреждения оси гипоталамус-гипофиз-гонады, приводящее к снижению выработки собственного тестостерона и угнетению сперматогенеза. Но если симптомы развившегося вторичного гипогонадизма можно медикаментозно купировать, восстанавливая содержание сывороточного тестостерона до нормальных физиологических значений, то надежных методов восстановления сперматогенеза не существует. Особенностью применения стероидов у этой категории мужчин является комбинация нескольких препаратов ААС, высокие дозы и длительные сроки употребления. При этом, в дополнение к ААС, часто и в течение длительного времени применяются препараты из других фармакологических групп, в том числе и из групп, используемых в репродуктивной реабилитации пациентов для восстановления сперматогенеза (гонадотропин, гонадорелин, антиэстрогены). Терапевтические и неблагоприятные эффекты длительного их применения не изучены, поэтому они не рекомендованы для пожизненного применения. В этой связи при разработке плана медикаментозного лечения вторичного гипогонадизма у пациентов, имевших период длительного применения ААС, при сборе анамнеза следует выяснить не только сам факт применения ААС, но и возможного дополнительного применения препаратов других фармакологических групп. Таким образом, не вызывает сомнения тот факт, что бесконтрольный прием анаболиков может нанести существенный