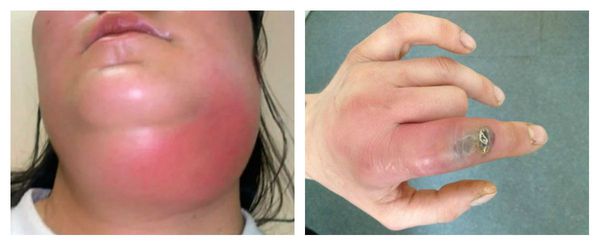
Вторичная иммунная недостаточность что это
Вторичные иммунодефициты
Вторичные иммунодефициты – это болезни иммунной системы, возникающие у детей и взрослых, не связанные с генетическими дефектами и характеризующиеся развитием повторных, затяжных инфекционно-воспалительных патологических процессов, плохо поддающихся этиотропному лечению. Выделяют приобретенную, индуцированную и спонтанную форму вторичных иммунодефицитов. Симптоматика обусловлена снижением иммунитета и отражает конкретное поражение того или иного органа (системы). Диагностика основана на анализе клинической картины и данных иммунологических исследований. В лечении используется вакцинация, заместительная терапия, иммуномодуляторы.
Общие сведения
Вторичные иммунодефициты – нарушения иммунитета, которые развиваются в поздний постнатальный период и не связаны с генетическими дефектами, возникают на фоне исходно нормальной реактивности организма и обусловлены конкретным причинным фактором, вызвавшим развитие дефекта иммунной системы.
Течение заболевания может быть скрытым (жалобы и клиническая симптоматика отсутствует, наличие иммунодефицита выявляется только при лабораторном исследовании) или активным с наличием признаков воспалительного процесса на коже и в подкожной клетчатке, верхних дыхательных путях, легких, мочеполовой системе, пищеварительном тракте и в других органах. В отличие от преходящих сдвигов в иммунитете, при вторичном иммунодефиците патологические изменения сохраняются и после ликвидации возбудителя заболевания и купирования воспаления.
Причины
Привести к выраженному и стойкому снижению иммунной защиты организма могут самые разнообразные этиологические факторы – как внешние, так и внутренние. Вторичный иммунодефицит нередко развивается при общем истощении организма. Длительное недоедание с дефицитом в рационе белка, жирных кислот, витаминов и микроэлементов, нарушения всасывания и расщепления питательных веществ в пищеварительном тракте приводят к нарушению процессов созревания лимфоцитов и снижают сопротивляемость организма.
Тяжелые травматические повреждения опорно-двигательного аппарата и внутренних органов, обширные ожоги, серьезные оперативные вмешательства, как правило, сопровождаются кровопотерей (наряду с плазмой теряются белки системы комплемента, иммуноглобулины, нейтрофилы и лимфоциты), а выброс кортикостероидных гормонов, предназначенных для поддержания жизненно-важных функций (кровообращения, дыхания и др.) еще больше угнетает работу иммунитета.
Ведущую роль в развитии вторичных иммунодефицитов играют хронические вирусные инфекционные заболевания (ВИЧ, цитомегаловирусная инфекция, вирусы Эпштейна-Барр и другие герпес-вирусы, реже корь, краснуха, вирусные гепатиты и т. д.), вызывая подавление клеточного и гуморального иммунитета. Неблагоприятное влияние на иммунный статус оказывает бактериальная и грибковая инфекция, паразитарные заболевания.
Выраженное нарушение обменных процессов в организме при соматических заболеваниях (хронические гломерулонефриты, почечная недостаточность) и эндокринных расстройствах (диабете, гипо- и гипертиреозе) приводит к угнетению хемотаксиса и фагоцитирующей активности нейтрофилов и, как следствие, к вторичному иммунодефициту с возникновением воспалительных очагов различной локализации (чаще это пиодермии, абсцессы и флегмоны).
Снижается иммунитет при длительном приеме некоторых лекарственных препаратов, обладающих подавляющим действием на костный мозг и кроветворение, нарушающих формирование и функциональную активность лимфоцитов (цитостатики, глюкокортикоиды и пр.). Схожий эффект оказывает и лучевое воздействие.
При злокачественных новообразованиях происходит продукция опухолью иммуномодулирующих факторов и цитокинов, в результате чего снижается количество T-лимфоцитов, увеличивается активность клеток-супрессоров, угнетается фагоцитоз. Ситуация усугубляется при генерализации опухолевого процесса и метастазировании в костный мозг. Вторичные иммунодефициты нередко развиваются при аутоиммунных заболеваниях, острых и хронических отравлениях, у людей старческого возраста, при длительных физических и психоэмоциональных перегрузках.
Симптомы вторичных иммунодефицитов
Клинические проявления характеризуются наличием в организме затяжного, устойчивого к этиотропной терапии хронического инфекционного гнойно-воспалительного заболевания на фоне снижения иммунной защиты. При этом изменения могут быть преходящими, временными или имеют необратимый характер. Выделяют индуцированную, спонтанную и приобретенную формы вторичных иммунодефицитов.
К индуцированной форме относят нарушения, возникающие вследствие конкретных причинных факторов (рентгеновское излучение, длительный прием цитостатиков, кортикостероидных гормонов, тяжелые травмы и обширные хирургические операции с интоксикацией, кровопотерей), а также при тяжелой соматической патологии (сахарный диабет, гепатиты, циррозы, хроническая почечная недостаточность) и злокачественных опухолях.
При спонтанной форме видимый этиологический фактор, вызвавший нарушение иммунной защиты, не определяется. Клинически при этой форме отмечается наличие хронических, трудно поддающихся лечению и часто обостряющихся заболеваний верхних дыхательных путей и легких (синуситы, бронхоэктазы, пневмонии, абсцессы легких), пищеварительного тракта и мочевыводящих путей, кожи и подкожной клетчатки (фурункулы, карбункулы, абсцессы и флегмоны), которые вызваны условно-патогенными микроорганизмами. В отдельную – приобретенную форму выделен синдром приобретенного иммунодефицита (СПИД), вызванный ВИЧ-инфекцией.
О наличии вторичного иммунодефицита при всех стадиях можно судить по общим клиническим проявлениям инфекционно-воспалительного процесса. Это может быть длительный субфебрилитет или лихорадка, увеличение лимфатических узлов и их воспаление, боли в мышцах и суставах, общая слабость и утомляемость, снижение работоспособности, частые простудные заболевания, повторные ангины, часто рецидивирующие хронические гаймориты, бронхиты, повторные пневмонии, септические состояния и т. п. При этом эффективность стандартной антибактериальной и противовоспалительной терапии невысока.
Диагностика
Выявление вторичных иммунодефицитов требует комплексного подхода и участия в процессе диагностики различных врачей-специалистов – аллерголога-иммунолога, гематолога, онколога, инфекциониста, оториноларинголога, уролога, гинеколога и др. При этом учитывается клиническая картина заболевания, свидетельствующая о наличии хронической инфекции, трудно поддающейся лечению, а также выявление оппортунистических инфекций, вызванных условно-патогенными микроорганизмами.
Необходимо изучение иммунного статуса организма с использованием всех доступных методик, применяемых в аллергологии и иммунологии. Диагностика основана на исследовании всех звеньев иммунитета, участвующих в защите организма от инфекционных агентов. При этом изучается фагоцитарная система, система комплемента, субпопуляции T- и B-лимфоцитов. Исследования выполняются путем проведения тестов первого (ориентировочного) уровня, позволяющего выявить грубые общие нарушения иммунитета и второго (дополнительного) уровня с идентификацией конкретного дефекта.
При проведении скрининговых исследований (тесты 1 уровня, которые можно выполнить в любой клинико-диагностической лаборатории) можно получить информацию об абсолютном количестве лейкоцитов, нейтрофилов, лимфоцитов и тромбоцитов (встречается как лейкопения, так и лейкоцитоз, относительный лимфоцитоз, повышенная СОЭ), уровне белка и сывороточных иммуноглобулинов G, A, M и E, гемолитической активности комплемента. Кроме того, можно выполнить необходимые кожные пробы для выявления гиперчувствительности замедленного типа.
При углубленном анализе вторичного иммунодефицита (тесты 2 уровня) определяется интенсивность хемотаксиса фагоцитов, завершенность фагоцитоза, субклассы иммуноглобулинов и специфические антитела к конкретным антигенам, продукция цитокинов, индукторов T-клеток и другие показатели. Анализ полученных данных должен проводиться только с учетом конкретного состояния данного пациента, сопутствующих заболеваний, возраста, наличия аллергических реакций, аутоиммунных расстройств и других факторов.
В процессе обследования проводится дифференциальная диагностика с первичными иммунодефицитами, затяжными инфекционными заболеваниями вирусной, бактериальной, грибковой и паразитарной природы, соматическими заболеваниями, эндокринными расстройствами, новообразованиями.
Лечение вторичных иммунодефицитов
Эффективность лечения вторичных иммунодефицитов зависит от правильности и своевременности выявления этиологического фактора, вызвавшего появление дефекта иммунной системы и возможности его устранения. Если нарушение иммунитета возникло на фоне хронической инфекции, применяются меры по ликвидации очагов воспаления с использованием антибактериальных препаратов с учетом чувствительности к ним возбудителя, проведением адекватной противовирусной терапии, использованием интерферонов и т. п. Если причинный фактор – недостаточное питание и авитаминоз, проводятся мероприятия по разработке правильного рациона питания со сбалансированным сочетанием белков, жиров, углеводов, микроэлементов и необходимой калорийности. Также устраняются имеющиеся нарушения обмена веществ, восстанавливается нормальный гормональный статус, проводится консервативное и оперативное лечение основного заболевания (эндокринная, соматическая патология, новообразования).
Важный компонент лечения больных вторичным иммунодефицитом – иммунотропная терапия с использованием активной иммунизации (вакцинации), заместительного лечения препаратами крови (внутривенное введение плазмы, лейкоцитарной массы, человеческого иммуноглобулина), а также использованием препаратов иммунотропного действия (иммуностимуляторов). Целесообразность назначения того или иного лечебного средства и подбор дозировки осуществляется врачом аллергологом-иммунологом с учетом конкретной ситуации. При преходящем характере иммунных нарушений, своевременном выявлении вторичного иммунодефицита и подборе правильного лечения, прогноз заболевания может быть благоприятным.
Что такое вторичный иммунодефицит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Бычковой Е.Ю., остеопата со стажем в 22 года.
Определение болезни. Причины заболевания
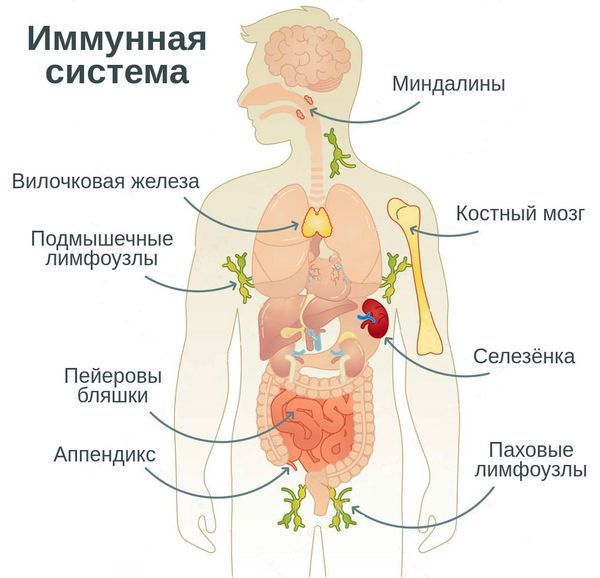
Вторичный иммунодефицит формируется у людей старше 6 лет с исходно нормальным иммунитетом. До этого возраста происходит созревание иммунной системы, особенно полноценных механизмов противоинфекционной защиты, поэтому частое развитие инфекционных заболеваний у детей младше 6 лет не является признаком патологии.
Появление вторичного иммунодефицита обычно связано с воздействием окружающей среды или каких-либо других факторов, но у многих из пациентов можно выявить генетическую предрасположенность к нарушению иммунитета.
Иммунологически здоровый организм способен контролировать и предотвращать развитие инфекций и опухолевых процессов, то есть осуществлять иммунологический контроль внутренней среды.
Когда можно заподозрить вторичный иммунодефицит
Причины развития вторичных иммунодефицитных состояний:
Иммунодефицитные состояния у детей
Развитию иммунодефицита у детей, как и у взрослых, способствуют:
Дисбактериоз у матери является причиной дисбактериоза у ребёнка с последующим замедлением и неполноценным созреванием иммунной системы. Каждый курс антибиотикотерапии может усугубить это состояние.
Проявления иммунодефицита зависят от степени его выраженности, они сопровождаются частыми ОРВИ с инфекционными осложнениями, эпизодами лихорадки, болезненностью, увеличением лимфоузлов, болью в животе, рвотой и нарушением стула.
Симптомы вторичного иммунодефицита
Как проявляется вторичный иммунодефицит
Клинические проявления вторичного иммунодефицита разнообразны. Очень часто на первый план выходят симптомы основного заболевания, которое привело к развитию иммунодефицита. Но основные проявления проблем с иммунитетом, которые указывают на необходимость иммунологического обследования, всё же присутствуют. К ним относятся:
Все хронические инфекции и воспаления протекают на фоне ослабленной иммунной защиты. Поэтому любая хронизация инфекции будет указывать на несостоятельность иммунитета, который не может справиться с болезнью в ходе острого воспалительного процесса.
Патогенез вторичного иммунодефицита
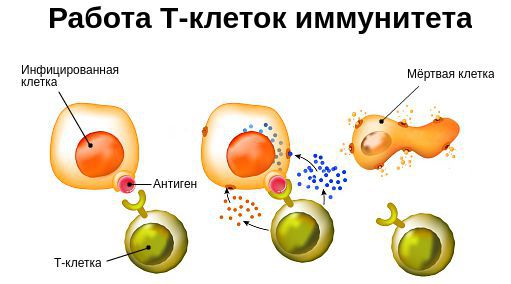
В течение жизни организм подвергается воздействию различных повреждающих факторов, вызывающих вторичный иммунодефицит. Они приводят к угнетению реакций клеточного иммунитета, снижению лейкоцитов и интерферонов — белков иммунной системы, которые вырабатываются лейкоцитами и иммунными клетками и блокируют распространение вируса. Вследствие этого появляются хронические инфекционно-воспалительные процессы, часто рецидивирующие.
Опухоли, возникающие в организме с ослабленной иммунной защитой, истощают иммунитет по мере своего роста, а проводимое лечение (операция, лучевая и химиотерапия) усугубляют возникший иммунодефицит. В этом случае страдает клеточное звено иммунитета:
Классификация и стадии развития вторичного иммунодефицита
По причине возникновения выделяют:
По форме вторичный иммунодефицит может быть:
По продолжительности выделяют два типа вторичного иммунодефицита:
По локализации основного дефекта различают:
Установить локализацию повреждения иммунной системы, основываясь только на симптомах, без лабораторного исследования иммунного статуса, практически невозможно: сходная клиническая картина может наблюдаться при разных типах вторичного дефицита. Например, склонность к вирусным инфекциям может встречаться как при Т-клеточном дефиците, так и при дефиците системы интерферонов.
Осложнения вторичного иммунодефицита
Вторичный иммунодефицит, развивающийся на фоне инфекции и/или воспаления, становится причиной тяжёлых жизнеугрожающих состояний. Без своевременной коррекции иммунитета патологический круг замыкается: течение основной болезни ухудшается.
Наиболее частыми осложнениями вторичного иммунодефицита являются тяжёлые инфекционные заболевания: пневмония, сепсис, абсцесс и флегмона. Их основные проявления: высокая температура и признаки воспаления. При пневмонии наблюдается одышка, кашель и боль в грудной клетке. Сепсис является жизнеугрожающим состоянием, он развивается при попадании в кровь инфекции, сопровождается системной воспалительной реакцией и полиорганной недостаточностью. При абсцессах и флегмоне в организме присутствует очаг гнойного воспаления с выраженной болью, отёком и гиперемией (покраснением).
Диагностика вторичного иммунодефицита
Диагноз «вторичный иммунодефицит» ставится на основании истории болезни, физикального обследования и оценки статуса иммунной системы.
Чтобы назначить эффективных мер по коррекции иммунитета, важно выявить факторы, которые поспособствовали развитию иммунодефицита. Поэтому на консультацию к врачу-иммунологу стоит принести все имеющиеся обследования, а врач будет очень подробно расспрашивать о перенесённых заболеваниях, проведённом лечении, операциях и образе жизни пациента.
Как распознать вторичный иммунодефицит
При подозрении на вторичный иммунодефицит врач назначает анализ крови и иммунограмму — иммунологические тесты, которые оценивают компоненты иммунной системы с точки зрения количества и качества.
Схема обследования различных звеньев иммунной системы (иммунограмма):
На вторичный иммунодефицит могут указывать как пониженные, так и повышенные показатели иммунограммы.
При подозрении на дисбаланс ключевых нутриентов (витаминов, микроэлементов и т. д.) врач-иммунолог может назначить исследования:
В своём заключении врач-иммунолог может указать «вторичный иммунодефицит» как основной или сопутствующий диагноз. Всё зависит от клинической картины.
Лечение вторичного иммунодефицита
Лечение пациента с вторичным иммунодефицитом проводится совместно с врачом, который курирует пациента по поводу основного заболевания. Задача врача-иммунолога заключается в подборе иммунокорригирующей терапии.
«Коррекция иммунитета» в данном случае подразумевает восстановление ослабленной иммунной защиты, исправление дисбаланса её компонентов и иммунных реакций, ослабление патологических иммунных процессов и подавление аутоиммунных реакций.
Лечение вторичного иммунодефицита начинают с определения и устранения его причины. Например, при нарушении иммунитета, вызванном инфекционно-воспалительным процессом, устраняются очаги хронического воспаления.
Если вторичный иммунодефицит возник в результате витаминно-минеральной недостаточности, то назначаются комплексы, содержащие дефицитные компоненты. Например, при истощении лимфоузлов и старении вилочковой железы назначают витамины В6. При обострении или начале аутоиммунных и лимфопролиферативных заболеваний показаны витамины Е.
Важными минералами для иммунной системы являются цинк, йод, литий, медь, кобальт, хром, молибден, селен, марганец и железо. Эти микроэлементы помогают активировать ферменты, которые участвуют в иммунных реакциях. К примеру, цинк предотвращает гибель клеток иммунной системы.
Заместительное лечение вторичного иммунодефицита
Заместительная терапия помогает предотвратить инфекции. Для этого применяют:
Иммунотропное лечение вторичного иммунодефицита
При остром инфекционном воспалении иммуностимуляторы позволяют:
При хроническом инфекционном воспалении иммуномодуляторы:
На степень эффективности иммунокоррекции влияет кратность приёма и стадия заболевания. Срок действия иммуномодуляторов зависит от характера препарата, показателей иммунного статуса и вида заболевания, вызвавшего вторичный иммунодефицит.
Устранение дефицита одного звена иммунитета может привести к компенсации другого звена, так как иммунная система работает по принципу взаимосвязанных модулей.
Может быть назначен как один иммуномодулятор, так и несколько, то есть их комбинация. При комбинированной иммунокоррекцией последовательно или одновременно принимают несколько модуляторов, обладающих разными механизмами действия. Таких иммуномодулирующих препаратов сейчас довольно много.
Показаниями для комбинированной иммунотерапии являются:
ВАЖНО: Самостоятельно назначать себе иммунокорректоры нельзя, так как их бесконтрольное применение может спровоцировать развитие вторичного иммунодефицита.
Прогноз. Профилактика
При вторичном иммунодефиците работа иммунной системы нарушена слабее, чем при первичном. В большинстве случаев выявляется несколько факторов, подавляющих иммунный ответ.
Прогноз определяется тяжестью основного заболевания. Например, если иммунодефицит возник из-за нехватки витаминов или нарушения режима труда и отдыха, он намного легче компенсируется, чем иммунодефицит, спровоцированный опухолевым процессом, сахарным диабетом или ВИЧ-инфекцией.
У детского организма отдельные звенья иммунной системы ещё незрелы: Т-лимфоциты только начинают «знакомиться» с различными инфекциями, поэтому ребёнок часто болеет ОРВИ. Со временем нарабатываются «клетки памяти». По мере взросления формируется широкий «репертуар» Т-лимфоцитов, способных распознавать и быстро запустить иммунный ответ, в связи с чем заболеваемость снижается.
С возрастом иммунная система стареет: в ответ на новые антигены участвует меньше Т-клеток, ухудшается кооперация между клетками иммунной системы, фагоциты хуже поглощают вирусы и мёртвые клетки. Поэтому многие инфекционно-воспалительные заболевания у пожилых людей протекают значительно тяжелее и чаще дают осложнения.
Первичная профилактика вторичного иммунодефицита заключается в ведении здорового образа жизни, сбалансированном питании, отказе от курения. Всё это позволяет предупредить развитие различных заболеваний.
Вторичная профилактика направлена на своевременное лечение инфекционных и общесоматических заболеваний.
Людям с вторичным иммунодефицитом нужны «особые условия», которые не позволят усугубить нарушение иммунитета. Пациентам следует:
Вакцинотерапия
Вакцинация проводится в соответствии с национальным календарем прививок. Перед введением вакцины нужно скомпенсировать иммунодефицит: пропить курс витаминов, минералов и иммуномодуляторов по назначению врача. Это позволит сформировать иммунный ответ на прививку и снизить риск осложнений.
Публикации в СМИ
Иммунодефициты вторичные
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ ПРИ НАРУШЕНИЯХ БИОХИМИЧЕСКОГО ГОМЕОСТАЗА
Состояния, приводящие к хроническому дисбалансу гормонов, питательных веществ и токсичных продуктов метаболизма, могут оказывать выраженные эффекты на один или несколько компонентов иммунной системы. В настоящей статье рассмотрены некоторые заболевания и состояния, при которых часто возникает клинически значимая дисфункция иммунной системы.
Сахарный диабет • Дисфункция нейтрофилов у больных СД предрасполагает к грибковым инфекциям • Существует прямая зависимость между степенью гипергликемии и подавлением функций нейтрофилов • Недостаточность микроциркуляции приводит к изъязвлению кожных покровов и ограничению хемотаксиса нейтрофилов к месту внедрения микроорганизмов • Типичные инфекционные осложнения СД — диссеминированный кандидоз, зигомикозы (Absidia, Mortierella, Mucor, Rhizopus) носовой полости и лёгких, а также отит, вызванный Pseudomonas aeruginosa.
Диализ/почечная недостаточность • Пациенты, находящиеся на хроническом гемодиализе, характеризуются подавлением функций Т-лимфоцитов in vitro и in vivo (кожная анергия), угнетением синтеза АТ и активности нейтрофилов, снижением экспрессии и/или функции рецепторов к Fc-фрагменту IgG • Механизм иммунодепрессии при гемодиализе полностью не изучен. Некоторые из иммунных дефектов частично объясняют высоким уровнем эндогенных ГК и применением бионесовместимых диализных мембран, повреждающих клеточную адгезию и ослабляющих фагоцитарный ответ • У больных, длительно находящихся на перитонеальном диализе, в результате потери с диализатом опсонинов (иммуноглобулинов и компонентов комплемента) и прямого супрессивного действия диализата возникает недостаточность функций нейтрофилов брюшины. В совокупности указанные факторы объясняют повышенную частоту бактериальных перитонитов в этой группе больных.
Нефротический синдром. Снижение концентрации многих сывороточных факторов приводит к депрессии иммунной системы у больных с нефротическим синдромом.
• Потеря иммуноглобулинов и белков комплемента увеличивает частоту бактериальных инфекций. Потеря витамина D и сывороточных факторов роста и дифференцировки может вызывать депрессию клеточного иммунитета.
• Иммунодепрессанты, назначаемые по поводу основного заболевания, усугубляют дефицит антиинфекционной резистентности.
• Нарушение питания повышает заболеваемость и смертность от инфекций, вызываемых превалирующими для данного региона возбудителями. Например, смертность от пневмонии и гастроэнтерита увеличивается в 10 и 30 раз, соответственно. В Латинской Америке алиментарная недостаточность выступает в качестве кофактора для 60% летальных исходов вследствие инфекционных заболеваний.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ ПРИ АУТОИММУННЫХ ЗАБОЛЕВАНИЯХ
Аутоиммунное заболевание и иммунодефицит часто сопутствуют друг другу. Как и при микробных инфекциях, умеренные изменения функции иммунной системы обнаруживают практически при всех аутоиммунных заболеваниях. Однако связь между ними и снижением иммунной защиты не так очевидна. Тем не менее при СКВ значение вторичных инфекций, связанных с иммунной дисфункцией, весьма существенно.
СКВ. Инфекции — основной фактор заболеваемости и смертности, а также главная причина летальных исходов 33% больных СКВ. Часто встречающиеся возбудители включают Staphylococcus aureus, E. coli, P. aeruginosa, Salmonella enteritidis, Streptococcus pneumoniae, Neisseria meningitidis, Listeria monocytogenes, Mycobacterium tuberculosis, Herpes zoster, Candida albicans, Cryptococcus neoformans, Pneumocystis carinii, Toxoplasma gondii. Регистрируемые иммунные дефекты зависят не только от применяемых иммунодепрессантов и отличаются межиндивидуальной гетерогенностью. При СКВ обнаружены дефекты практически в каждом звене иммунной системы.
• Т-клеточная (особенно CD4 + ) лимфопения.
• Подавление реакций ГЗТ, снижение ответа Т-лимфоцитов на Аг и митогены in vitro.
• Характерно увеличение количества периферических Т-лимфоцитов с фенотипом TCR a / b + CD4 – CD8 – (TCR — рецептор T-лимфоцитов, от англ. T cell receptor).
• Поликлональная активация В-лимфоцитов и гипергаммаглобулинемия (наблюдают также гипогаммаглобулинемию и дефицит субклассов IgA и/или IgG).
• Снижение содержания и активности NK-клеток.
• Подавление клеточно-опосредованного иммунного ответа in vitro и in vivo. Интенсивность гуморального ответа варьирует и зависит от Аг.
• Дисфункция макрофагов (снижение иммунного клиренса, Аг-представляющей функции, продукции цитокинов), возможно, вследствие образования аутоантител против рецепторов к Fc-фрагменту IgG.
• Нейтропения и подавление фагоцитарной активности нейтрофилов обусловлены, вероятно, аутоантителами к молекулам адгезии (увеличение клиренса клеток, хроническая аберрантная активация клеток с последующим сниженным ответом на физиологические стимулы).
• При СКВ аутоантитела класса IgM, реагирующие против Т-лимфоцитов, в значительной степени ответственны за депрессию Т-клеточной функции. Имеются сообщения о функциональной асплении в сочетании с сепсисом у больных СКВ.
Ревматоидный артрит. Стойкие изменения функций периферических Т-лимфоцитов при ревматоидном артрите отсутствуют. Имеются отдельные сообщения о незначительных дефектах иммунной защиты, например уменьшении количества цитотоксических Т-лимфоцитов, специфичных к вирусу Эпстайна–Барр, однако системного дефекта цитотоксической функции нет. Гуморальный ответ (на противогриппозную вакцину) и реакция ГЗТ при ревматоидном артрите не изменены.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ, ОБУСЛОВЛЕННЫЕ СРЕДОВЫМИ ВОЗДЕЙСТВИЯМИ
Ультрафиолетовое облучение. УФ-лучи В спектра (УФ-В) — главный фактор риска рака кожи. Существует мнение, что рак кожи развивается не только вследствие прямого мутагенного действия УФ-лучей, но и в результате УФ-опосредованной супрессии иммунных функций кожи. При базально-клеточной карциноме или меланоме УФ-В подавляют индукцию контактной ГЗТ. Лабораторные животные после УФ-облучения характеризуются повышенной чувствительностью к инфекциям.
Токсические химические соединения. Появление новой дисциплины — иммунотоксикологии — свидетельствует об актуальности проблемы иммуноповреждающих эффектов ксенобиотиков. Некоторые из ксенобиотиков с доказанным или вероятным иммунотоксичным действием в отношении людей и животных перечислены ниже. Многие из этих соединений в той или иной степени угнетают костный мозг, подавляют функции Т-лимфоцитов in vivo (атрофия вилочковой железы, ГЗТ) и in vitro (ответ на митогены, Аг, смешанная культура лимфоцитов), вызывают поликлональную активацию В-лимфоцитов (проаутоиммунный эффект), увеличивают частоту инфекций (преимущественно респираторных), повышают риск злокачественных заболеваний (прямое мутагенное действие и/или угнетение функции иммунного надзора).
Химические соединения, приводящие к дисфункциям иммунной системы (По Faist E et al., World J Surg 1966, 20:454)
• Полициклические ароматические углеводороды •• Бензпирены: уменьшают образование АТ •• Бензантрацены: уменьшают активность цитотоксических T-лимфоцитов; канцерогены •• Бензол: вызывает лимфопению; канцероген.
• Полигалогенированные ароматические углеводороды •• Полихлорированные бифенилы: уменьшают активность T-лимфоцитов •• Полибромированные бифенилы: способствуют инфекциям дыхательных путей и лёгких •• полихлорированные дибензофураны, полихлорированные бензодиоксины: подавляют клеточный иммунитет.
• Ароматические амины •• Бензидин: подавляет клеточный иммунитет, канцероген (рак мочевого пузыря).
• Ксенобиотики с эффектами эстрогенов •• ДДТ (дихлордифенилтрихлорэтан): вызывает атрофию вилочковой железы •• Зеараленол: миелотоксикант •• Тетрагидроканнабинол: подавляет клеточный иммунитет •• Диэтилстильбэстрол: подавляет активность NK-клеток и образование АТ.
• Пестициды •• Хлорорганические соединения (в т.ч. ДДТ): вызывают лимфопению •• Фосфорорганические соединения: вызывают атрофию вилочковой железы, уменьшают активность T-лимфоцитов, подавляют образование АТ •• Метил изоцианат: увеличивает количество T-лимфоцитов, но подавляет их активность.
• Содержащие металлы органические соединения •• Органотины: вызывают атрофию вилочковой железы, уменьшают пролиферацию цитотоксических T-лимфоцитов •• Метилированная ртуть: угнетает систему комплемента •• диметилнитрозамин: подавляет образование АТ; канцероген.
• Тяжёлые металлы •• Мышьяк, кадмий, медь, золото, железо, свинец, цинк: подавляют костномозговые ростки, вызывают лимфопению; канцерогены •• Асбест: подавляет все виды иммунитета.
• Поллютанты воздуха •• Озон, диоксид серы: уменьшают сопротивляемость к респираторным инфекциям •• Диоксид азота: подавляет активность альвеолярных макрофагов.
• Токсины грибов •• Охратоксин: подавляет образование АТ •• Трихотецены: подавляют клеточный и гуморальный иммунитет.
• Разные •• Этанол: подавляет все виды и реакции иммунитета.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ, СВЯЗАННЫЕ С ДРУГИМИ СОСТОЯНИЯМИ И ЗАБОЛЕВАНИЯМИ
Кишечная лимфангиэктазия — патологическое расширение лимфатических сосудов слизистой оболочки кишечника, приводящее к потере лимфы, иммуноглобулинов и лимфоцитов через просвет кишечника. Это врождённое заболевание или вторичное состояние, возникающее при обструкции дренирующих лимфатических протоков или повышении ЦВД.
• У больных с рецидивирующими инфекциями и низким содержанием в сыворотке крови IgG могут быть эффективны иммуноглобулины для внутривенного введения. Необходимы высокие дозы ввиду постоянных потерь иммуноглобулинов через кишечник.
Аспления/гипоспленизм. В селезёнке сосредоточено приблизительно 25% фагоцитарного потенциала организма. Она осуществляет иммунный клиренс слабо опсонизированных Аг (т.е. связавших недостаточные количества АТ или комплемента). Поэтому селезёнка приобретает важное значение при первичном и ранних этапах вторичного иммунного ответа на инфекционные Аг, когда высокоаффинные АТ в больших количествах ещё отсутствуют. В селезёнке происходит взаимодействие Т-лимфоцитов, Аг-представляющих клеток и В-лимфоцитов. Селезёнка — главное место активации В-лимфоцитов и важный источник сывороточного IgM.
• Аспления или гипоспленизм увеличивают риск генерализованных инфекций, возбудители которых имеют полисахаридную капсулу: S. pneumoniae, H. influenzae, N. meningitidis. Эти микроорганизмы резистентны к фагоцитозу, если не связаны с достаточным количеством IgG и комплемента.
• При асплении гуморальный ответ к этим и другим возбудителям снижен. Содержание в сыворотке крови IgM ниже нормы, уровень IgG варьирует, содержание IgA может быть повышено. Абсолютное содержание периферических В-лимфоцитов увеличено, в основном вследствие нарушения рециркуляции (кровоток–ткани) и хоминга. Аспления не повреждает клеточный иммунитет.
• При спленэктомии риск инфекции максимален в раннем послеоперационном периоде. Частота сепсиса у взрослых и детей (до 16 лет) без селезёнки составляет 0,9% и 4,2%, соответственно •• Пациентам старше 2 лет за 2 нед до спленэктомии назначают пневмококковую и менингококковую вакцины. Ревакцинацию пневмококковой вакциной проводят через 3–6 лет •• Всем больным показана антибиотикопрофилактика в течение как минимум 3 лет: феноксиметилпенициллин или амоксициллин по 125 мг 2 р/сут для детей младше 5 лет или по 250 мг 2 р/сут для лиц старше 5 лет. Альтернативный режим химиопрофилактики — ко-тримоксазол в суточной дозе 4–5 мг/кг однократно •• Для эмпирической терапии лихорадочных состояний применяют комбинированный препарат амоксициллин + клавулановая кислота.
Аллогенное переливание крови
• Трансфузия крови от донора, несовместимого по Аг главного комплекса гистосовместимости, увеличивает частоту послеоперационных инфекций на 30% и более. Объём перелитой аллогенной крови достоверно коррелирует с риском послеоперационной инфекции.
• При трансфузии лейкоредуцированной крови (истощение лейкоцитов) лабораторным животным проинфекционный эффект отсутствует. В экспериментальных моделях переливание крови вызывает ускорение опухолевого роста и увеличивает смертность.
• Всё большое распространение получает мнение о необходимости трансфузий лейкоредуцированной крови хирургическим и онкологическим пациентам, т.к. аллогенные лейкоциты сенсибилизируют реципиента (фебрильные негемолитические посттрансфузионные реакции), вызывают реакции «трансплантат против хозяина», иммунодепрессию и реактивацию вирусных инфекций.
Беременность. У беременных повышена частота инфекционных заболеваний, контролируемых клеточным иммунным ответом: гепатиты А, В, грипп, герпес, хламидиоз, кампилобактериоз, туберкулёз, грибковые, протозойные инфекции и гельминтозы. Депрессия клеточного иммунитета у беременных, очевидно, имеет физиологический смысл, т.к. позволяет уменьшить вероятность отторжения плода, экспрессирующего отцовские Аг. Имеют значение следующие этиологические факторы:
• Прогестерон подавляет пролиферацию лимфоцитов in vitro, может быть основным иммунодепрессором при беременности.
• Уромодулин — сывороточный фактор, специфичный для беременных, — ингибирует активность В-лимфоцитов, хотя гуморальный ответ при беременности в целом сохранён.
• Сниженный ответ Т-лимфоцитов на митогены наблюдают только в присутствии аутологичной сыворотки, что указывает на значение циркулирующих факторов супрессии.
• При неосложнённой беременности антибиотикопрофилактика банальных инфекций не рекомендована.
Старение. Иммунодефицит в старческом возрасте выражен умеренно, и тяжёлые оппортунистические инфекции (пневмоцистная пневмония, генерализованные грибковые инфекции) нетипичны. С наибольшей частотой возникают реактивация туберкулёза и инфекции, обусловленные вирусом varicella-zoster.
• Снижение секреторной активности слизистых оболочек, потеря эластичности тканей, вегетативная дисфункция способствуют увеличению частоты инфекций дыхательной и мочеполовой систем.
• Фагоцитарная активность (хемотаксис, фагоцитоз, внутриклеточный киллинг) может быть подавлена. Это объясняет меньшее повышение содержания в крови лейкоцитов при инфекциях у пожилых и приводит к незавершённому фагоцитозу.
• Снижение продукции провоспалительных цитокинов ограничивает температурную реакцию у пожилых.
• С возрастом увеличивается количество циркулирующих незрелых Т-лимфоцитов, что отражает нарушение тимус-зависимой дифференцировки вследствие инволюции вилочковой железы. У пожилых также снижен Т-клеточный ответ на митогены, аллоантигены и специфические Аг. Кожная реакция ГЗТ обычно подавлена или отсутствует. При инфицировании M. tuberculosis в возрасте до 55 лет анергию наблюдают в 10% случаев, в возрасте старше 55 лет — в 30%. Содержание Аг-представляющих клеток Лангерханса в коже пожилых снижено вдвое.
• По мере старения нарастает титр аутоантител, снижается титр специфических АТ; количество В-лимфоцитов существенно не меняется. По-видимому, снижение ответа на чужеродные Аг — результат недостаточной активности Т-хелперов, потому что ответ В-лимфоцитов на поликлональные активаторы (митогены, анти-Ig АТ) сохранён в достаточной степени. Вакцинация пожилых менее эффективна по сравнению с молодыми. Нет убедительных доказательств того, что аутореактивные элементы ответственны за развитие широкого круга патологических состояний у пожилых.
• Увеличение частоты злокачественных заболеваний при старении приписывают, по крайней мере отчасти, снижению иммунного надзора. Однако отчётливые доказательства этой связи отсутствуют.
Сокращение. TCR — рецептор T-лимфоцитов (от англ. T cell receptor).
МКБ-10 • D80 Иммунодефициты с преимущественной недостаточностью АТ • D81 Комбинированные иммунодефициты • D83 Обычный вариабельный иммунодефицит • D84 Другие иммунодефициты
Код вставки на сайт
Иммунодефициты вторичные
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ ПРИ НАРУШЕНИЯХ БИОХИМИЧЕСКОГО ГОМЕОСТАЗА
Состояния, приводящие к хроническому дисбалансу гормонов, питательных веществ и токсичных продуктов метаболизма, могут оказывать выраженные эффекты на один или несколько компонентов иммунной системы. В настоящей статье рассмотрены некоторые заболевания и состояния, при которых часто возникает клинически значимая дисфункция иммунной системы.
Сахарный диабет • Дисфункция нейтрофилов у больных СД предрасполагает к грибковым инфекциям • Существует прямая зависимость между степенью гипергликемии и подавлением функций нейтрофилов • Недостаточность микроциркуляции приводит к изъязвлению кожных покровов и ограничению хемотаксиса нейтрофилов к месту внедрения микроорганизмов • Типичные инфекционные осложнения СД — диссеминированный кандидоз, зигомикозы (Absidia, Mortierella, Mucor, Rhizopus) носовой полости и лёгких, а также отит, вызванный Pseudomonas aeruginosa.
Диализ/почечная недостаточность • Пациенты, находящиеся на хроническом гемодиализе, характеризуются подавлением функций Т-лимфоцитов in vitro и in vivo (кожная анергия), угнетением синтеза АТ и активности нейтрофилов, снижением экспрессии и/или функции рецепторов к Fc-фрагменту IgG • Механизм иммунодепрессии при гемодиализе полностью не изучен. Некоторые из иммунных дефектов частично объясняют высоким уровнем эндогенных ГК и применением бионесовместимых диализных мембран, повреждающих клеточную адгезию и ослабляющих фагоцитарный ответ • У больных, длительно находящихся на перитонеальном диализе, в результате потери с диализатом опсонинов (иммуноглобулинов и компонентов комплемента) и прямого супрессивного действия диализата возникает недостаточность функций нейтрофилов брюшины. В совокупности указанные факторы объясняют повышенную частоту бактериальных перитонитов в этой группе больных.
Нефротический синдром. Снижение концентрации многих сывороточных факторов приводит к депрессии иммунной системы у больных с нефротическим синдромом.
• Потеря иммуноглобулинов и белков комплемента увеличивает частоту бактериальных инфекций. Потеря витамина D и сывороточных факторов роста и дифференцировки может вызывать депрессию клеточного иммунитета.
• Иммунодепрессанты, назначаемые по поводу основного заболевания, усугубляют дефицит антиинфекционной резистентности.
• Нарушение питания повышает заболеваемость и смертность от инфекций, вызываемых превалирующими для данного региона возбудителями. Например, смертность от пневмонии и гастроэнтерита увеличивается в 10 и 30 раз, соответственно. В Латинской Америке алиментарная недостаточность выступает в качестве кофактора для 60% летальных исходов вследствие инфекционных заболеваний.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ ПРИ АУТОИММУННЫХ ЗАБОЛЕВАНИЯХ
Аутоиммунное заболевание и иммунодефицит часто сопутствуют друг другу. Как и при микробных инфекциях, умеренные изменения функции иммунной системы обнаруживают практически при всех аутоиммунных заболеваниях. Однако связь между ними и снижением иммунной защиты не так очевидна. Тем не менее при СКВ значение вторичных инфекций, связанных с иммунной дисфункцией, весьма существенно.
СКВ. Инфекции — основной фактор заболеваемости и смертности, а также главная причина летальных исходов 33% больных СКВ. Часто встречающиеся возбудители включают Staphylococcus aureus, E. coli, P. aeruginosa, Salmonella enteritidis, Streptococcus pneumoniae, Neisseria meningitidis, Listeria monocytogenes, Mycobacterium tuberculosis, Herpes zoster, Candida albicans, Cryptococcus neoformans, Pneumocystis carinii, Toxoplasma gondii. Регистрируемые иммунные дефекты зависят не только от применяемых иммунодепрессантов и отличаются межиндивидуальной гетерогенностью. При СКВ обнаружены дефекты практически в каждом звене иммунной системы.
• Т-клеточная (особенно CD4 + ) лимфопения.
• Подавление реакций ГЗТ, снижение ответа Т-лимфоцитов на Аг и митогены in vitro.
• Характерно увеличение количества периферических Т-лимфоцитов с фенотипом TCR a / b + CD4 – CD8 – (TCR — рецептор T-лимфоцитов, от англ. T cell receptor).
• Поликлональная активация В-лимфоцитов и гипергаммаглобулинемия (наблюдают также гипогаммаглобулинемию и дефицит субклассов IgA и/или IgG).
• Снижение содержания и активности NK-клеток.
• Подавление клеточно-опосредованного иммунного ответа in vitro и in vivo. Интенсивность гуморального ответа варьирует и зависит от Аг.
• Дисфункция макрофагов (снижение иммунного клиренса, Аг-представляющей функции, продукции цитокинов), возможно, вследствие образования аутоантител против рецепторов к Fc-фрагменту IgG.
• Нейтропения и подавление фагоцитарной активности нейтрофилов обусловлены, вероятно, аутоантителами к молекулам адгезии (увеличение клиренса клеток, хроническая аберрантная активация клеток с последующим сниженным ответом на физиологические стимулы).
• При СКВ аутоантитела класса IgM, реагирующие против Т-лимфоцитов, в значительной степени ответственны за депрессию Т-клеточной функции. Имеются сообщения о функциональной асплении в сочетании с сепсисом у больных СКВ.
Ревматоидный артрит. Стойкие изменения функций периферических Т-лимфоцитов при ревматоидном артрите отсутствуют. Имеются отдельные сообщения о незначительных дефектах иммунной защиты, например уменьшении количества цитотоксических Т-лимфоцитов, специфичных к вирусу Эпстайна–Барр, однако системного дефекта цитотоксической функции нет. Гуморальный ответ (на противогриппозную вакцину) и реакция ГЗТ при ревматоидном артрите не изменены.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ, ОБУСЛОВЛЕННЫЕ СРЕДОВЫМИ ВОЗДЕЙСТВИЯМИ
Ультрафиолетовое облучение. УФ-лучи В спектра (УФ-В) — главный фактор риска рака кожи. Существует мнение, что рак кожи развивается не только вследствие прямого мутагенного действия УФ-лучей, но и в результате УФ-опосредованной супрессии иммунных функций кожи. При базально-клеточной карциноме или меланоме УФ-В подавляют индукцию контактной ГЗТ. Лабораторные животные после УФ-облучения характеризуются повышенной чувствительностью к инфекциям.
Токсические химические соединения. Появление новой дисциплины — иммунотоксикологии — свидетельствует об актуальности проблемы иммуноповреждающих эффектов ксенобиотиков. Некоторые из ксенобиотиков с доказанным или вероятным иммунотоксичным действием в отношении людей и животных перечислены ниже. Многие из этих соединений в той или иной степени угнетают костный мозг, подавляют функции Т-лимфоцитов in vivo (атрофия вилочковой железы, ГЗТ) и in vitro (ответ на митогены, Аг, смешанная культура лимфоцитов), вызывают поликлональную активацию В-лимфоцитов (проаутоиммунный эффект), увеличивают частоту инфекций (преимущественно респираторных), повышают риск злокачественных заболеваний (прямое мутагенное действие и/или угнетение функции иммунного надзора).
Химические соединения, приводящие к дисфункциям иммунной системы (По Faist E et al., World J Surg 1966, 20:454)
• Полициклические ароматические углеводороды •• Бензпирены: уменьшают образование АТ •• Бензантрацены: уменьшают активность цитотоксических T-лимфоцитов; канцерогены •• Бензол: вызывает лимфопению; канцероген.
• Полигалогенированные ароматические углеводороды •• Полихлорированные бифенилы: уменьшают активность T-лимфоцитов •• Полибромированные бифенилы: способствуют инфекциям дыхательных путей и лёгких •• полихлорированные дибензофураны, полихлорированные бензодиоксины: подавляют клеточный иммунитет.
• Ароматические амины •• Бензидин: подавляет клеточный иммунитет, канцероген (рак мочевого пузыря).
• Ксенобиотики с эффектами эстрогенов •• ДДТ (дихлордифенилтрихлорэтан): вызывает атрофию вилочковой железы •• Зеараленол: миелотоксикант •• Тетрагидроканнабинол: подавляет клеточный иммунитет •• Диэтилстильбэстрол: подавляет активность NK-клеток и образование АТ.
• Пестициды •• Хлорорганические соединения (в т.ч. ДДТ): вызывают лимфопению •• Фосфорорганические соединения: вызывают атрофию вилочковой железы, уменьшают активность T-лимфоцитов, подавляют образование АТ •• Метил изоцианат: увеличивает количество T-лимфоцитов, но подавляет их активность.
• Содержащие металлы органические соединения •• Органотины: вызывают атрофию вилочковой железы, уменьшают пролиферацию цитотоксических T-лимфоцитов •• Метилированная ртуть: угнетает систему комплемента •• диметилнитрозамин: подавляет образование АТ; канцероген.
• Тяжёлые металлы •• Мышьяк, кадмий, медь, золото, железо, свинец, цинк: подавляют костномозговые ростки, вызывают лимфопению; канцерогены •• Асбест: подавляет все виды иммунитета.
• Поллютанты воздуха •• Озон, диоксид серы: уменьшают сопротивляемость к респираторным инфекциям •• Диоксид азота: подавляет активность альвеолярных макрофагов.
• Токсины грибов •• Охратоксин: подавляет образование АТ •• Трихотецены: подавляют клеточный и гуморальный иммунитет.
• Разные •• Этанол: подавляет все виды и реакции иммунитета.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ, СВЯЗАННЫЕ С ДРУГИМИ СОСТОЯНИЯМИ И ЗАБОЛЕВАНИЯМИ
Кишечная лимфангиэктазия — патологическое расширение лимфатических сосудов слизистой оболочки кишечника, приводящее к потере лимфы, иммуноглобулинов и лимфоцитов через просвет кишечника. Это врождённое заболевание или вторичное состояние, возникающее при обструкции дренирующих лимфатических протоков или повышении ЦВД.
• У больных с рецидивирующими инфекциями и низким содержанием в сыворотке крови IgG могут быть эффективны иммуноглобулины для внутривенного введения. Необходимы высокие дозы ввиду постоянных потерь иммуноглобулинов через кишечник.
Аспления/гипоспленизм. В селезёнке сосредоточено приблизительно 25% фагоцитарного потенциала организма. Она осуществляет иммунный клиренс слабо опсонизированных Аг (т.е. связавших недостаточные количества АТ или комплемента). Поэтому селезёнка приобретает важное значение при первичном и ранних этапах вторичного иммунного ответа на инфекционные Аг, когда высокоаффинные АТ в больших количествах ещё отсутствуют. В селезёнке происходит взаимодействие Т-лимфоцитов, Аг-представляющих клеток и В-лимфоцитов. Селезёнка — главное место активации В-лимфоцитов и важный источник сывороточного IgM.
• Аспления или гипоспленизм увеличивают риск генерализованных инфекций, возбудители которых имеют полисахаридную капсулу: S. pneumoniae, H. influenzae, N. meningitidis. Эти микроорганизмы резистентны к фагоцитозу, если не связаны с достаточным количеством IgG и комплемента.
• При асплении гуморальный ответ к этим и другим возбудителям снижен. Содержание в сыворотке крови IgM ниже нормы, уровень IgG варьирует, содержание IgA может быть повышено. Абсолютное содержание периферических В-лимфоцитов увеличено, в основном вследствие нарушения рециркуляции (кровоток–ткани) и хоминга. Аспления не повреждает клеточный иммунитет.
• При спленэктомии риск инфекции максимален в раннем послеоперационном периоде. Частота сепсиса у взрослых и детей (до 16 лет) без селезёнки составляет 0,9% и 4,2%, соответственно •• Пациентам старше 2 лет за 2 нед до спленэктомии назначают пневмококковую и менингококковую вакцины. Ревакцинацию пневмококковой вакциной проводят через 3–6 лет •• Всем больным показана антибиотикопрофилактика в течение как минимум 3 лет: феноксиметилпенициллин или амоксициллин по 125 мг 2 р/сут для детей младше 5 лет или по 250 мг 2 р/сут для лиц старше 5 лет. Альтернативный режим химиопрофилактики — ко-тримоксазол в суточной дозе 4–5 мг/кг однократно •• Для эмпирической терапии лихорадочных состояний применяют комбинированный препарат амоксициллин + клавулановая кислота.
Аллогенное переливание крови
• Трансфузия крови от донора, несовместимого по Аг главного комплекса гистосовместимости, увеличивает частоту послеоперационных инфекций на 30% и более. Объём перелитой аллогенной крови достоверно коррелирует с риском послеоперационной инфекции.
• При трансфузии лейкоредуцированной крови (истощение лейкоцитов) лабораторным животным проинфекционный эффект отсутствует. В экспериментальных моделях переливание крови вызывает ускорение опухолевого роста и увеличивает смертность.
• Всё большое распространение получает мнение о необходимости трансфузий лейкоредуцированной крови хирургическим и онкологическим пациентам, т.к. аллогенные лейкоциты сенсибилизируют реципиента (фебрильные негемолитические посттрансфузионные реакции), вызывают реакции «трансплантат против хозяина», иммунодепрессию и реактивацию вирусных инфекций.
Беременность. У беременных повышена частота инфекционных заболеваний, контролируемых клеточным иммунным ответом: гепатиты А, В, грипп, герпес, хламидиоз, кампилобактериоз, туберкулёз, грибковые, протозойные инфекции и гельминтозы. Депрессия клеточного иммунитета у беременных, очевидно, имеет физиологический смысл, т.к. позволяет уменьшить вероятность отторжения плода, экспрессирующего отцовские Аг. Имеют значение следующие этиологические факторы:
• Прогестерон подавляет пролиферацию лимфоцитов in vitro, может быть основным иммунодепрессором при беременности.
• Уромодулин — сывороточный фактор, специфичный для беременных, — ингибирует активность В-лимфоцитов, хотя гуморальный ответ при беременности в целом сохранён.
• Сниженный ответ Т-лимфоцитов на митогены наблюдают только в присутствии аутологичной сыворотки, что указывает на значение циркулирующих факторов супрессии.
• При неосложнённой беременности антибиотикопрофилактика банальных инфекций не рекомендована.
Старение. Иммунодефицит в старческом возрасте выражен умеренно, и тяжёлые оппортунистические инфекции (пневмоцистная пневмония, генерализованные грибковые инфекции) нетипичны. С наибольшей частотой возникают реактивация туберкулёза и инфекции, обусловленные вирусом varicella-zoster.
• Снижение секреторной активности слизистых оболочек, потеря эластичности тканей, вегетативная дисфункция способствуют увеличению частоты инфекций дыхательной и мочеполовой систем.
• Фагоцитарная активность (хемотаксис, фагоцитоз, внутриклеточный киллинг) может быть подавлена. Это объясняет меньшее повышение содержания в крови лейкоцитов при инфекциях у пожилых и приводит к незавершённому фагоцитозу.
• Снижение продукции провоспалительных цитокинов ограничивает температурную реакцию у пожилых.
• С возрастом увеличивается количество циркулирующих незрелых Т-лимфоцитов, что отражает нарушение тимус-зависимой дифференцировки вследствие инволюции вилочковой железы. У пожилых также снижен Т-клеточный ответ на митогены, аллоантигены и специфические Аг. Кожная реакция ГЗТ обычно подавлена или отсутствует. При инфицировании M. tuberculosis в возрасте до 55 лет анергию наблюдают в 10% случаев, в возрасте старше 55 лет — в 30%. Содержание Аг-представляющих клеток Лангерханса в коже пожилых снижено вдвое.
• По мере старения нарастает титр аутоантител, снижается титр специфических АТ; количество В-лимфоцитов существенно не меняется. По-видимому, снижение ответа на чужеродные Аг — результат недостаточной активности Т-хелперов, потому что ответ В-лимфоцитов на поликлональные активаторы (митогены, анти-Ig АТ) сохранён в достаточной степени. Вакцинация пожилых менее эффективна по сравнению с молодыми. Нет убедительных доказательств того, что аутореактивные элементы ответственны за развитие широкого круга патологических состояний у пожилых.
• Увеличение частоты злокачественных заболеваний при старении приписывают, по крайней мере отчасти, снижению иммунного надзора. Однако отчётливые доказательства этой связи отсутствуют.
Сокращение. TCR — рецептор T-лимфоцитов (от англ. T cell receptor).
МКБ-10 • D80 Иммунодефициты с преимущественной недостаточностью АТ • D81 Комбинированные иммунодефициты • D83 Обычный вариабельный иммунодефицит • D84 Другие иммунодефициты