Впс плода что такое
Врожденные пороки сердца
Врожденные пороки сердца – группа заболеваний, объединенных наличием анатомических дефектов сердца, его клапанного аппарата или сосудов, возникших во внутриутробном периоде, приводящих к изменению внутрисердечной и системной гемодинамики. Проявления врожденного порока сердца зависят от его вида; к наиболее характерным симптомам относятся бледность или синюшность кожных покровов, шумы в сердце, отставание в физическом развитии, признаки дыхательной и сердечной недостаточности. При подозрении на врожденный порок сердца выполняется ЭКГ, ФКГ, рентгенография, ЭхоКГ, катетеризация сердца и аортография, кардиография, МРТ сердца и т. д. Чаще всего при врожденных пороках сердца прибегают к кардиохирургической операции – оперативной коррекции выявленной аномалии.
Общие сведения
Многие виды врожденных пороков сердца встречаются не только изолированно, но и в различных сочетаниях друг с другом, что значительно утяжеляет структуру дефекта. Примерно в трети случаев аномалии сердца сочетаются с внесердечными врожденными пороками ЦНС, опорно-двигательного аппарата, ЖКТ, мочеполовой системы и пр.
К наиболее частым вариантам врожденных пороков сердца, встречающимся в кардиологии, относятся дефекты межжелудочковой перегородки (ДМЖП – 20%), дефекты межпредсердной перегородки (ДМПП), стеноз аорты, коарктация аорты, открытый артериальный проток (ОАП), транспозиция крупных магистральных сосудов (ТКС), стеноз легочной артерии (10-15% каждый).
Причины врожденных пороков сердца
Этиология врожденных пороков сердца может быть обусловлена хромосомными нарушениями (5%), генной мутацией (2-3%), влиянием факторов среды (1-2%), полигенно-мультифакториальной предрасположенностью (90%).
Различного рода хромосомные аберрации приводят к количественным и структурным изменениям хромосом. При хромосомных перестройках отмечаются множественные полисистемные аномалии развития, включая врожденные пороки сердца. В случае трисомии аутосом наиболее частыми пороками сердца оказываются дефекты межпредсердной или межжелудочковой перегородок, а также их сочетание; при аномалиях половых хромосом врожденные пороки сердца встречаются реже и представлены, главным образом, коарктацией аорты или дефектом межжелудочковой перегородки.
Врожденные пороки сердца, обусловленные мутациями единичных генов, также в большинстве случаев сочетаются с аномалиями других внутренних органов. В этих случаях сердечные пороки являются частью аутосомно-доминантных (синдромы Марфана, Холта-Орама, Крузона, Нунана и др.), аутосомно-рецессивных синдромов (синдром Картагенера, Карпентера, Робертса, Гурлер и др.) или синдромов, сцепленных с Х-хромосомой (синдромы Гольтца, Аазе, Гунтера и др.).
Среди повреждающих факторов внешней среды к развитию врожденных пороков сердца приводят вирусные заболевания беременной, ионизирующая радиация, некоторые лекарственные препараты, пагубные привычки матери, производственные вредности. Критическим периодом неблагоприятного воздействия на плод являются первые 3 месяца беременности, когда происходит фетальный органогенез.
В структуру эмбриофетального алкогольного синдрома обычно входят дефекты межжелудочковой и межпредсердной перегородки, открытый артериальный проток. Доказано, что тератогенное действие на сердечно-сосудистую систему плода оказывает прием амфетаминов, приводящий к транспозиции магистральных сосудов и ДМЖП; противосудорожных средств, обусловливающих развитие стеноза аорты и легочной артерии, коарктации аорты, открытого артериального протока, тетрады Фалло, гипоплазии левых отделов сердца; препаратов лития, приводящих к атрезии трехстворчатого клапана, аномалии Эбштейна, ДМПП; прогестагенов, вызывающих тетраду Фалло, другие сложные врожденные пороки сердца.
У женщин, страдающих преддиабетом или диабетом, дети с врожденными пороками сердца рождаются чаще, чем у здоровых матерей. В этом случае у плода обычно формируются ДМЖП или транспозиция крупных сосудов. Вероятность рождения ребенка с врожденным пороком сердца у женщины с ревматизмом составляет 25 %.
Кроме непосредственных причин, выделяют факторы риска формирования аномалий сердца у плода. К ним относят возраст беременной младше 15-17 лет и старше 40 лет, токсикозы I триместра, угрозу самопроизвольного прерывания беременности, эндокринные нарушения у матери, случаи мертворождения в анамнезе, наличие в семье других детей и близких родственников с врожденными пороками сердца.
Классификация врожденных пороков сердца
Существует несколько вариантов классификаций врожденных пороков сердца, в основу которых положен принцип изменения гемодинамики. С учетом влияния порока на легочный кровоток выделяют:
В практической кардиологии используется деление врожденных пороков сердца на 3 группы: пороки «синего» (цианотического) типа с веноартериальным шунтом (триада Фалло, тетрада Фалло, транспозиция магистральных сосудов, атрезия трехстворчатого клапана); пороки «бледного» типа с артериовенозным сбросом (септальные дефекты, открытый артериальный проток); пороки с препятствием на пути выброса крови из желудочков (стенозы аорты и легочной артерии, коарктация аорты).
Нарушения гемодинамики при врожденных пороках сердца
В результате выше названных причин у развивающего плода может нарушаться правильное формирование структур сердца, что выражается в неполном или несвоевременном закрытии перепонок между желудочками и предсердиями, неправильном образовании клапанов, недостаточном повороте первичной сердечной трубки и недоразвитии желудочков, аномальном расположении сосудов и т. д. После рождения у части детей остаются открытыми артериальный проток и овальное окно, которые во внутриутробном периоде функционируют в физиологическом порядке.
Ввиду особенностей антенатальной гемодинамики, кровообращение развивающегося плода при врожденных пороках сердца, как правило, не страдает. Врожденные пороки сердца проявляются у детей сразу после рождения или через какое-то время, что зависит от сроков закрытия сообщения между большим и малым кругами кровообращения, выраженности легочной гипертензии, давления в системе легочной артерии, направления и объема сброса крови, индивидуальных адаптационных и компенсаторных возможностей организма ребенка. Нередко к развитию грубых нарушений гемодинамики при врожденных пороках сердца приводит респираторная инфекция или какое-либо другое заболевание.
При врожденных пороках сердца бледного типа с артериовенозным сбросом вследствие гиперволемии развивается гипертензия малого круга кровообращения; при пороках синего типа с веноартериальным шунтом у больных имеет место гипоксемия.
Около 50% детей с большим сбросом крови в малый круг кровообращения погибают без кардиохирургической помощи на первом году жизни от явлений сердечной недостаточности. У детей, перешагнувших этот критический рубеж, сброс крови в малый круг уменьшается, самочувствие стабилизируется, однако постепенно прогрессируют склеротические процессы в сосудах легких, обусловливая легочную гипертензию.
При цианотических врожденных пороках сердца венозный сброс крови или ее смешение приводит к перегрузке большого и гиповолемии малого круга кровообращения, вызывая снижение насыщения крови кислородом (гипоксемию) и появление синюшности кожи и слизистых. Для улучшения вентиляции и перфузии органов развивается коллатеральная сеть кровообращения, поэтому, несмотря на выраженные нарушения гемодинамики, состояние больного может длительное время оставаться удовлетворительным. По мере истощения компенсаторных механизмов, вследствие длительной гиперфункции миокарда, развиваются тяжелые необратимые дистрофические изменения в сердечной мышце. При цианотических врожденных пороках сердца оперативное вмешательство показано уже в раннем детском возрасте.
Симптомы врожденных пороков сердца
Клинические проявления и течение врожденных пороков сердца определяется видом аномалии, характером нарушений гемодинамики и сроками развития декомпенсации кровообращения.
У новорожденных с цианотическими врожденными пороками сердца отмечается цианоз (синюшность) кожных покровов и слизистых оболочек. Синюшность усиливается при малейшем напряжении: сосании, плаче ребенка. Белые пороки сердца проявляются побледнением кожи, похолоданием конечностей.
Дети с врожденными пороками сердца обычно беспокойные, отказываются от груди, быстро устают в процессе кормления. У них появляется потливость, тахикардия, аритмии, одышка, набухание и пульсация сосудов шеи. При хроническом нарушении кровообращения дети отстают в прибавлении веса, росте и физическом развитии. При врожденных пороках сердца обычно сразу поле рождения выслушиваются сердечные шумы. В дальнейшем обнаруживаются признаки сердечной недостаточности (отеки, кардиомегалия, кардиогенная гипотрофия, гепатомегалия и др.).
Осложнениями врожденных пороков сердца могут стать бактериальный эндокардит, полицитемия, тромбозы периферических сосудов и тромбоэмболии сосудов головного мозга, застойные пневмонии, синкопальные состояния, одышечно-цианотические приступы, стенокардитический синдром или инфаркт миокарда.
Диагностика врожденных пороков сердца
ЭКГ позволяет выявить гипертрофию различных отделов сердца, патологическое отклонение ЭОС, наличие аритмий и нарушений проводимости, что в совокупности с данными других методов клинического обследования позволяет судить о тяжести врожденного порока сердца. С помощью суточного холтеровского ЭКГ-мониторирования обнаруживаются скрытые нарушения ритма и проводимости. Посредством ФКГ более тщательно и детально оценивается характер, длительность и локализация сердечных тонов и шумов. Данные рентгенографии органов грудной клетки дополняют предыдущие методы за счет оценки состояния малого круга кровообращения, расположения, формы и размеров сердца, изменений со стороны других органов (легких, плевры, позвоночника). При проведении ЭхоКГ визуализируются анатомические дефекты перегородок и клапанов сердца, расположение магистральных сосудов, оценивается сократительная способность миокарда.
При сложных врожденных пороках сердца, а также сопутствующей легочной гипертензии, с целью точной анатомической и гемодинамической диагностики, возникает необходимость в выполнении зондирования полостей сердца и ангиокардиографии.
Лечение врожденных пороков сердца
Наиболее сложной проблемой в детской кардиологии является хирургическое лечение врожденных пороков сердца у детей первого года жизни. Большинство операций в раннем детском возрасте выполняется по поводу цианотических врожденных пороков сердца. При отсутствии у новорожденного признаков сердечной недостаточности, умеренной выраженности цианоза операция может быть отложена. Наблюдение за детьми с врожденными пороками сердца осуществляют кардиолог и кардиохирург.
Специфическое лечение в каждом конкретном случае зависит от разновидности и степени тяжести врожденного порока сердца. Операции при врожденных дефектах перегородок сердца (ДМЖП, ДМПП) могут включать пластику или ушивание перегородки, рентгенэндоваскулярную окклюзию дефекта. При наличии выраженной гипоксемии детям с врожденными пороками сердца первым этапом выполняется паллиативное вмешательство, предполагающее наложение различного рода межсистемных анастомозов. Подобная тактика улучшает оксигенацию крови, уменьшает риск осложнений, позволяет провести радикальную коррекцию в более благоприятных условиях. При аортальных пороках выполняется резекция или баллонная дилатация коарктации аорты, пластика аортального стеноза и др. При ОАП производится его перевязка. Лечение стеноза легочной артерии заключается в проведении открытой или эндоваскулярной вальвулопластики и т. д.
Анатомически сложные врожденные пороки сердца, при которых радикальная операция не представляется возможной, требуют выполнения гемодинамической коррекции, т. е. разделения артериального и венозного потоков крови без устранения анатомического дефекта. В этих случаях могут проводиться операции Фонтена, Сеннинга, Мастарда и др. Серьезные пороки, не поддающиеся оперативному лечению, требуют проведения пересадки сердца.
Консервативное лечение врожденных пороков сердца может включать в себя симптоматическую терапию одышечно-цианотических приступов, острой левожелудочковой недостаточности (сердечной астмы, отека легких), хронической сердечной недостаточности, ишемии миокарда, аритмий.
Прогноз и профилактика врожденных пороков сердца
В структуре смертности новорожденных врожденные пороки сердца занимают первое место. Без оказания квалифицированной кардиохирургической помощи в течение первого года жизни погибает 50-75% детей. В периоде компенсации (2-3 года) смертность снижается до 5%. Ранее выявление и коррекция врожденного порока сердца позволяет существенно улучшить прогноз.
Профилактика врожденных пороков сердца требует тщательного планирования беременности, исключения воздействия неблагоприятных факторов на плод, проведения медико-генетического консультирования и разъяснительной работы среди женщин групп риска по рождению детей с сердечной патологией, решения вопроса о пренатальной диагностике порока (УЗИ, биопсия хориона, амниоцентез) и показаниях к прерыванию беременности. Ведение беременности у женщин с врожденными пороками сердца требует повышенного внимания со стороны акушера-гинеколога и кардиолога.
Впс плода что такое
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ СЕРДЦА, ТЕЧЕНИЕ БЕРЕМЕННОСТИ, КЛИНИЧЕСКИЕ СЛУЧАИ СОЧЕТАНИЯ КАРДИАЛЬНОЙ ПАТОЛОГИИ ПЛОДА С АНОМАЛИЯМИ ДРУГИХ ОРГАНОВ
Сердечная патология является одной из основных причин детской смертности и находится на втором месте среди причин младенческой смертности. Частота составляет 8 случаев на 1000 новорожденных [1, 2].
Неблагоприятный прогноз для жизни представляют сложные врожденные пороки сердца (ВПС). Под термином «сложный» понимают такие сердечные аномалии, как гипоплазированные камеры сердца, атрезии клапанов, аномальное отхождение магистральных сосудов, единственный желудочек, то есть изменения в сердце, при которых невозможно выполнить полную хирургическую коррекцию [3].
Критические пороки сердца, требующие хирургического вмешательства в ранний неонатальный период, составляют 25 % от всех врожденных сердечных аномалий. В первую неделю умирает 29 % новорожденных, к концу первого года жизни – 87 % [4].
Первое ультразвуковое скрининговое обследование (11–13 недель) является важным осмотром. В случае обнаружения увеличения толщины воротникового пространства, отклонения сердечной оси, рекомендуется расширенное обследование сердца (фетальная эхокардиография). При рутинном ультразвуковом исследовании лишь в 40 % выявляются пороки сердца у плодов, при том что детальный осмотр позволяет выявлять до 90 % сердечных пороков внутриутробно. Для своевременного выявления врожденных пороков сердца необходимо детально обследовать сердце плода ультразвуковым методом при втором скрининговом обследовании (18–22 недели) [5, 6].
Применяя фетальную эхокардиографию, возможно определить структуру порока и спрогнозировать исход для плода [7]. Особенно это касается сложных пороков сердца, так как имеет место позднее выявление патологии, при осмотре неонатологом в родильном доме или после выписки домой [8].
Данная тема является актуальной. Врачи пренатальной диагностики встречаются с трудностями точного определения структуры сердечных пороков, что связано с большой вариабельностью кардиальной аномалии у плодов.
Задачей врачей-гинекологов является правильная тактика ведения беременной после установки диагноза, так как своевременная хирургическая помощь спасает жизни детей и влияет на качество дальнейшей жизни.
Цель исследования: проанализировать течение беременности при выявлении кардиальной патологии у плодов, определить точность внутриутробной диагностики, описать случаи сочетания сердечных пороков с патологией развития других органов плода.
Материалы и методы исследования
В центре диагностики матери и плода «Family» г. Бишкек с января 2019 г. по ноябрь 2020 г. было осмотрено 48 беременных женщин с пороками сердца плода, требующими хирургической коррекции после рождения. Всем новорожденным было проведено эхокардиографическое обследование после родов врачами-кардиологами для уточнения структуры пороков. В случаях прерывания беременности, для подтверждения диагноза проводилось патологоанатомическое вскрытие.
Осмотр беременных выполнялся на ультразвуковых аппаратах General Electric (GE) Voluson E8 и E10, c использованием программы fetal heart. Также использовалась программа STIC (постобработка снимков, полученных в режиме объемного сканирования), основным являлся двумерный режим с цветовым и импульсным доплеровским картированием. У всех пациентов было получено информированное согласие на участие в нашем исследовании. Результаты были обработаны путем вычисления относительных величин (в %).
Результаты исследования и их обсуждение
Среди 48 плодов с ВПС сложные пороки сердца были в 40 случаях (83,3 %). Из общего количества умерли после родов 23 ребенка (47,9 %). Прервали беременность 3 женщины (6,2 %), в двух случаях проводилось патологоанатомическое вскрытие плодов. Третья беременная после заключения медицинской комиссии прервала беременность в сроке 31 неделя, в связи с плохим прогнозом для жизни ребенка. Диагноз был подтвержден методом эхокардиографии.
Из факторов риска, по анализам обменных карт, острые респираторные вирусные инфекции (ОРВИ) до 12 недели перенесли 14 женщин (29,1 %), ОРВИ во втором триместре перенесли 4 женщины (8,3 %). Анемия легкой степени имела место в 12 случаях (25,0 %), хроническая ревматическая болезнь сердца у матери – один случай (2,0 %). Многоплодные беременности как фактор риска в нашем случае встречались в двух случаях (4,1 %), обе дихориальные, диамниотические двойни.
Количество плодов мужского пола составило – 31 (64,5 %), женского 17 (35,4 %). Маловесными (вес менее 2600 г.) родились 9 детей (18,7 %), из них 8 имели сочетание порока сердца с ненормальным развитием других органов, в одном случае порок сердца был изолированным.
При ультразвуковом исследовании фетоплацентарное нарушение кровотока 1 степени выявлено у одной беременной (2,0 %), задержка внутриутробного развития у 4 (8,3 %), маловодие у 2 (4,1 %), многоводие у 5 (10,4 %), причем избыточное количество вод во всех случаях сочеталось с множественными пороками развития.
Сложности при ультразвуковом осмотре вызывали неправильное положение плода, большой срок гестации (после 35 недель), многоводие, маловодие. Необходимо отметить, что технология STIC информативна при осмотрах четырехкамерной проекции сердца (пороки атривентрикулярных клапанов, гипоплазии желудочков, дефекты межжелудочковой перегородки). Для осмотра выходных трактов желудочков, особенно при повороте оси сердца, осмотр в двумерном режиме является предпочтительным. Также для осмотра органов других систем маловодие и неудобное положение плода являются помехами для трехмерного ультразвука.
Структура выявленных пороков оказалась многообразна. Нами были диагностированы: у 5 плодов (10,4 %) двойное отхождение сосудов от правого желудочка, аномалия Эбштейна – 1 (2,0 %), транспозиция магистральных сосудов – 3 (6,2 %), стеноз легочной артерии – 7 (14,5 %), изолированный перимембранозный дефект межжелудочковой перегородки – 3 (6,2 %), декстрапозиция аорты с дефектом межжелудочковой перегородки – 5 (10,4 %), атрезия легочной артерии – 4 (8,3 %), атриовентрикулярный канал –5 (10,4 %), тетрада Фалло – 6 (12,5 %), перерыв дуги аорты – 1 (2,0 %), атрезия трикуспидального клапана – 1 (2,0 %), атрезия митрального клапана – 4 (8,3 %), из них в двух случаях аортальный клапан был атрезирован, также в двух случаях имелось двойное отхождение сосудов от правого желудочка. Коарктация аорты составила один случай (2,0 %), единственный желудочек – 2 (4,1 %).
После рождения вскрытие проводилось в одном случае – ребенку с аномалией Эбштейна, который умер в родильном доме на вторые сутки. Согласно заключению патологоанатома, причиной смерти стала острая сердечная недостаточность, дилатация полостей сердца, острый венозный застой внутренних органов.
В двух случаях единственного желудочка диагностика оказалась затруднительной как внутриутробно, так и после родов. В первом случае трикуспидальный клапан был атрезирован и полость правого желудочка практически отсутствовала, также имелся единый сосуд, исходящий из функционально единого желудочка. После родов рекомендовалась компьютерная томография для уточнения диагноза. При телефонном разговоре с матерью мы узнали, что в возрасте 10 месяцев ребенок еще не прошел полного обследования, но в развитии значительно отставал, не мог переворачиваться и самостоятельно не сидел.
Во втором случае мы диагностировали правосформированное, праворасположенное сердце в сочетании с единым атриовентрикулярным клапаном, двойным отхождением сосудов от правого желудочка, ребенок умер в первый месяц жизни.
Среди плодов с кардиальной патологией в 6 случаях (12,5 %) было сочетание с хромосомными аберрациями и генетическим заболеванием: синдромом Дауна – 4 случая, синдромом Ди Джорджи – один случай; также наблюдался один случай редкой генетической патологии (синдром Холта – Орама, наследственное заболевание, сочетание порока сердца с отсутствием первого пальца на кистях обеих рук до аплазии лучевой кости).
После родов успешно прооперированы были двое детей с тетрадой Фалло, также двое детей со стенозом клапана легочной артерии. Один ребенок с диагнозом двойного отхождения сосудов от правого желудочка благополучно оперирован в Турции. К сожалению, в случаях транспозиции магистральных сосудов и единственного желудочка детям было отказано в проведении оперативного лечения как местными, так и зарубежными хирургами в связи с высоким риском смерти сразу после операции.
Приводим наблюдение о несовпадении нашего диагноза с эхокардиографическим заключением после родов. В нашем центре при плановом обследовании на 30 неделе беременности был установлен диагноз коарктации аорты с дефектом межжелудочковой перегородки. В родильном доме при проведении эхокардиографии был выявлен только дефект мышечной перегородки, коарктация была исключена. Ребенок умер через 2 недели после родов, от вскрытия родители отказались. Мы пришли к выводу, что портативные ультразвуковые аппараты, на которых обследуют детей в родильных домах, могут вызывать сложности визуализации и неполную диагностику, что связано с менее четким изображением, чем на стационарном оборудовании.
По данным литературы, внутриутробная диагностика пороков сердца возможна с 13 недели беременности, в частности таких сложных для выявления ВПС, как атрезия легочной артерии [9]. В нашем центре плод с атрезией легочной артерии и дефектом межжелудочковой перегородки был выявлен в 18 недель беременности. Данная беременность была прервана в связи с неблагоприятным прогнозом для жизни. Патологоанатомическое вскрытие подтвердило диагноз. По нашему мнению, 18 неделя беременности (второе скрининговое обследование) является наиболее ранним сроком для точного определения структуры порока. Связано это с тем, что магистральные сосуды сердца плода плохо видны в сроки первого скринингового обследования, что может приводить к неточной диагностике.
Из 48 случаев с ВПС 16 плодов (33,3 %) имели множественные пороки развития, причем такие изменения, как гидроцефалия, укорочение трубчатых костей, выявлялись на сроках после 30 недель. А случаи атрезии ануса были обнаружены только при рождении детей. Таким образом, выявление любых изменений в сердце является поводом для обязательного повторного ультразвукового обследования в сроки 25–30 недель (таблица).
Сочетание врожденных пороков сердца с аномалиями других органов
Название порока сердца
Сочетание ВПС с патологией других органов
Сроки выявления ВПС (неделя беременности), исход
1. Перимембранозный дефект межжелудочковой перегородки
Если вашему ребенку поставили диагноз врожденный порок сердца, не стоит опускать руки, нужно узнать все способы поддержания здоровья таких детей, а также причины развития данного заболевания, пройти необходимое обследование, чтобы врач назначил соответствующее лечение.
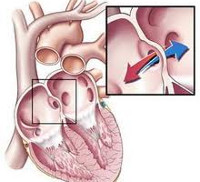
Сердце человека состоит из четырех камер: правое предсердие (ПП) и правый желудочек (ПЖ), левое предсердие (ЛП) и левый желудочек (ЛЖ). Правые и левые отделы сердца между собой никак не сообщаются. В этом нет необходимости, так как они обеспечивают движение крови каждый по своему кругу. Левые отделы сердца отвечают за движение крови по большому кругу кровообращения. Из левого предсердия через левый желудочек в аорту (Ао) поступает артериальная кровь, богатая кислородом. Из аорты по многочисленным артериям, а потом и по капиллярам она разносится по всему организму, доставляя клеткам кислород. В свою очередь, «отработанная» организмом венозная кровь собирается в мелкие вены, которые сливаются в более крупные венозные сосуды – верхнюю и нижнюю полые вены (ВПВ и НПВ). Конечная точка путешествия венозной крови – правое предсердие. Оттуда через правый желудочек кровь попадает в легочную артерию (ЛА). Малый круг кровообращения проходит через легкие, где венозная кровь обогащается кислородом и вновь становится артериальной. Отток обновленной крови осуществляется по легочным венам (ЛВ), впадающим, в свою очередь, в левое предсердие.
Особенности кровообращения у плода и новорожденного
Находясь в утробе матери, плод не дышит самостоятельно и его легкие не функционируют. Кровообращение осуществляется через плаценту. Насыщенная кислородом кровь матери поступает к плоду через пуповину: в венозный проток, откуда через систему сосудов в правое предсердие. У плода между правым и левым предсердием имеется отверстие – овальное окно. Через него кровь попадает в левое предсердие, затем в левый желудочек, аорту – и ко всем органам плода. Малый круг кровообращения отключен. В легкие плода кровь поступает через артериальный проток – соединение между аортой и легочной артерией. Венозный проток, овальное окно и артериальный проток имеются только у плода. Они называются «фетальными сообщениями». Когда ребенок рождается и пуповину перевязывают, схема кровообращения радикально изменяется. С первым вдохом ребенка его легкие расправляются, давление в сосудах легких снижается, кровь притекает в легкие. Малый круг кровообращения начинает функционировать. Фетальные сообщения больше не нужны ребенку и постепенно закрываются (венозный проток – в течение первого месяца, артериальный проток и овальное окно – через два-три месяца). В некоторых случаях своевременного закрытия не происходит, тогда у ребенка диагностируют врожденный порок сердца (ВПС). Иногда при развитии плода возникает аномалия и ребенок рождается с анатомически измененными структурами сердца, что также считается врожденным пороком сердца. Из 1000 детей с врожденными пороками рождается 8-10, и эта цифра увеличивается в последние годы (развитие и совершенствование диагностики позволяет врачам чаще и точнее распознавать пороки сердца, в том числе, когда ребенок еще в утробе матери).
«Синие» и «бледные» пороки сердца
Аномалии могут быть очень разнообразными, наиболее часто встречающиеся имеют названия и объединяются в группы. Например, пороки разделяют на «синие» (при которых кожные покровы ребенка синюшные, «цианотичные») и «бледные» (кожные покровы бледные). Для жизни и развития ребенка более опасны «синие» пороки, при которых насыщение крови кислородом очень низкое. К «синим» порокам относятся Тетрада Фалло, транспозиция магистральных сосудов, атрезия легочной артерии. К «бледным» порокам относятся дефекты перегородок – межпредсердной, межжелудочковой. В некоторых случаях порок может частично компенсироваться за счет открытого артериального протока (в норме он закрывается, как только легкие ребенка расправляются с первым криком). Также у ребенка может недоразвиться клапан сердца – сформируется клапанный порок (наиболее часто, аортальный клапан или клапан легочной артерии).
Причины развития врожденного порока сердца
У плода формирование структур сердца происходит в первом триместре, на 2-8 неделе беременности. В этот период развиваются пороки, которые являются следствием наследственных генетических причин или воздействия неблагоприятных внешних факторов (например, инфекция или отравления). Иногда у ребенка имеется несколько пороков развития, в том числе и порок сердца. Риск рождения ребенка с врожденным пороком сердца очень высок, если:
— ранее у женщины были выкидыши или мертворожденные
— возраст женщины более 35 лет
— женщина во время беременности принимает алкоголь, психоактивные вещества (наркотики), курит
— в семье женщины есть история рождения детей с пороками или мертворождения
— женщина живет в экологически неблагоприятной местности (радиация, отравляющие вещества)
или работает на экологически неблагоприятном производстве
— во время беременности (особенно первые 2 месяца) женщина перенесла инфекционные, вирусные заболевания
— женщина принимала во время беременности лекарственные препараты
с тератогенным эффектом (приводящие к развитию уродств у плода) или
эндокринные препараты для сохранения беременности (гормоны).
Можно ли поставить диагноз ВПС у плода?
Врожденный порок сердца у новорожденных
При рождении ребенка или в первые дни его жизни врачи могут заподозрить врожденный порок сердца.
На чем они основывают свои предположения?
— Шум в сердце. В первые несколько дней жизни ребенка шум в сердце нельзя расценивать как достоверный симптом врожденного порока сердца. Такого ребенка наблюдают, при сохранении шумов более 4-5 суток – обследуют. Само появление сердечного шума объясняется нарушением тока крови через сосуды и полости сердца (например, при наличии аномальных сужений, отверстий, резкой смены направления кровотока).
— синюшность кожных покровов (цианоз). В норме артериальная кровь богата кислородом и придает коже розовую окраску. Когда к артериальной крови примешивается бедная кислородом венозная кровь (в норме не происходит), кожа приобретает синюшный оттенок. В зависимости от типа порока цианоз может быть разной степени выраженности. Однако, врачам приходится уточнять причины цианоза, так как он может быть симптомом болезней органов дыхания и центральной нервной системы.
— проявления сердечной недостаточности. Сердце перекачивает кровь, работая как насос. Когда снижается насосная способность сердца, кровь начинает застаиваться в венозном русле, питание органов артериальной кровью снижается. Учащаются сердечные сокращения и дыхание, появляется увеличение печени и отечность, быстрая утомляемость и одышка. К сожалению, эти признаки очень трудно распознать у новорожденных. Высокая частота сердечных сокращений и дыхания наблюдается у маленьких детей в нормальном состоянии. Только при значительных отклонениях можно с достаточной уверенностью говорить о развитии у малыша сердечной недостаточности. Часто следствием развития сердечной недостаточности является спазм периферических сосудов, что проявляется похолоданием конечностей и кончика носа, их побледнением. Эти признаки помогают косвенно судить о недостаточности сердца.
— нарушения электрической функции сердца (сердечного ритма и проводимости), проявляющиеся аритмиями и, иногда, потерей сознания. Врач может услышать неровное сердцебиение при аускультации (выслушивании фонендоскопом) или увидеть на записи электрокардиограммы.
Как сами родители могут заподозрить у ребенка врожденный порок сердца?
Подтверждение диагноза врожденного порока сердца
В настоящее время наиболее доступным, простым, безболезненным для ребенка и высокоинформативным методом диагностики пороков сердца является эхокардиография. Во время исследования с помощью ультразвукового датчика врач видит толщину стенок, размеры камер сердца, состояние клапанной системы и расположение крупных сосудов. Допплеровский датчик позволяет увидеть направления кровотока и измерить его скорость. Во время исследования можно выполнить снимки, подтверждающие заключение специалиста. Также ребенку обязательно запишут электрокардиограмму. При необходимости более точного исследования (как правило, для определения тактики хирургического лечения порока) врач порекомендует зондирование сердца. Это инвазивная методика, для выполнения которой ребенок госпитализируется в стационар. Зондирование проводится врачем-рентгенхирургом в рентгеноперационной, в присутствии врача-анестезиолога, под внутривенным наркозом. Через прокол в вене или артерии специальные катетеры вводятся в сердце и магистральные сосуды, позволяя точно измерить давление в полостях сердца, аорте, легочной артерии. Введение специального рентген-контрастного препарата позволяет получить точное изображение внутреннего строения сердца и крупных сосудов (см. рисунок).
Диагноз – не приговор. Лечение ВПС (врожденного порока сердца)
Современная медицина позволяет не только своевременно диагностировать, но и лечить врожденные пороки сердца. Лечением ВПС занимаются кардиохирурги. При выявлении порока, сопровождающегося серьезным нарушением гемодинамики, влияющего на развитие ребенка и угрожающего жизни малыша, операция проводиться как можно раньше, иногда в первые дни жизни ребенка. При пороках, которые не влияют значительно на рост и развитие ребенка, операция может проводиться позже. Выбор сроков операции определяется хирургом. Если ребенку рекомендовали хирургическое вмешательство и его не удалось выполнить своевременно (часто из-за отказа родителей, непонимания серьезности проблемы), у ребенка может начаться патологическое изменение гемодинамики, приводящее к развитию и прогрессированию сердечной недостаточности. На определенном этапе изменения становятся необратимыми, операция уже не поможет. Отнеситесь внимательно к советам и рекомендациям врачей, не лишайте своего ребенка возможности расти и развиваться, не быть инвалидом на всю жизнь!
Операция при врожденных пороках сердца
Многие годы операции при врожденных пороках сердца выполнялись только на открытом сердце, с использованием аппарата искусственного кровообращения (АИК), который берет на себя функции сердца во время его остановки. Сегодня при некоторых пороках такой операции существует альтернатива – устранение дефекта структур сердца с помощью системы AMPLATZER. Такие операции значительно безопаснее, не требуют раскрытия грудной клетки, не отличаясь по эффективности от «большой» хирургии. Если операция выполнена своевременно и успешно, ребенок полноценно развивается и растет, и часто – навсегда забывает о существовании порока. После операции обязательным является наблюдение педиатра, контрольные эхокардиографические исследования. Дети с врожденными пороками сердца часто болеют простудными заболеваниями из-за снижения иммунитета, поэтому в послеоперационном периоде проводится общеукрепляющее лечение и ограничиваются физические нагрузки. В дальнейшем у многих детей эти ограничения снимают и даже разрешают посещать спортивные секции.
Статья была опубликована сотрудниками нашего Центра ранее на «Сибирском медицинском портале».