цитотоксическое действие что это
Цитотоксическое действие что это
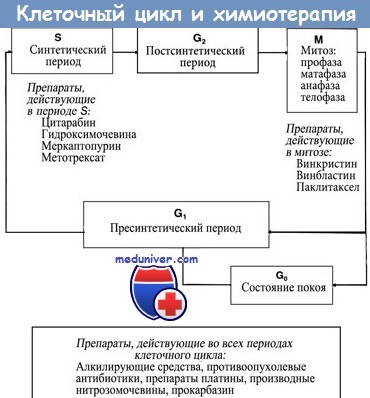
Цитотоксические вещества блокируют клеточный цикл. Все цитотоксические противоопухолевые лекарства препятствуют прохождению клетками клеточного цикла, приводя к синхронизации и замедлению пролиферации быстро размножающихся клеток. Результатом является снижение чувствительности к лекарствам в S-фазе.
Цитотоксичность пропорциональна общей лекарственной экспозиции. Фармакокинетика противоопухолевых лекарств — это сложный процесс, т.к. цитотоксичность для злокачественных клеток пропорциональна общей лекарственной экспозиции (площадь под кривой; ППК), а не концентрации препарата в плазме на пике. Сначала вещество должно проникнуть в отдельные злокачественные клетки, а затем взаимодействовать со своими молекулярными мишенями. Поскольку это взаимодействие часто обратимо, по крайней мере сначала, цитотоксическая концентрация должна сохраняться все это время.
Кроме того, число индивидуальных взаимодействий между лекарством и молекулами-мишенями, необходимое для киллинга одиночной клетки, может быть очень велико. Подсчитано, что для киллинга одной клетки с ее ДНК должен связаться как минимум 1 млн молекул цисплатина.
Комбинации противоопухолевых препаратов стали применять после того, как было обнаружено, что использование одного препарата не дает значительной ремиссии или не излечивает пациента (за исключением метотрексата при лечении хориокарциномы). Это явление объясняет гипотеза log-киллинга.
Лекарства, используемые для комбинированной терапии, должны обладать определенными свойствами:
• оказывать некоторый эффект при использовании в отдельности;
• вызывать преимущественно полный ответ (гибель всех клеток опухоли), а не частичный (гибель менее 50% клеток);
• биохимические механизмы действия препаратов должны быть разными для воздействия на опухоль, содержащую гетерогенную клеточную популяцию;
• препараты не должны обладать сходным побочным действием, т.к. в этом случае необходимо снижать их дозы, что приводит к утрате аддитивного эффекта комбинации.
По многим показателям различные опухоли являются гетерогенными, включая чувствительность к лекарственным веществам, в результате нестабильности их генетической конституции. Злокачественные клетки способны мутировать, что крайне важно для терапии, поскольку такие мутации могут привести к возникновению резистентности к лекарствам. В большинстве случаев такая резистентность определяется свойствами конкретного типа опухолей.
Клинически резистентность может стать очевидной, когда чувствительные клоны опухоли погибают, а резистентные выживают и становятся доминирующими. Излечимость пропорциональна числу злокачественных клеток, и, в соответствии с гипотезой Голди-Колдмана, существует более высокая вероятность мутации, приводящих к лекарственной резистентности, в более многочисленной клеточной популяции.
Цитотоксическое действие что это
13.1. Механизмы энергообеспечения клеток различной морфофункциональной организации в условиях нормы и гипоксических состояний
Гипоксия – типовой патологический процесс, осложняющий течение различных заболеваний.
Как известно, гипоксия определяет тяжесть течения ишемического поражения сердца, головного мозга, формирование полиорганной недостаточности при ДВС – синдроме, шоковых и коллаптоидных состояний, является неизменным спутником заболеваний инфекционной и неинфекционной природы, а также стрессовых ситуаций.
Тяжесть течения многих заболеваний и их исход в конечном итоге определяется особенностями вторичных неспецифических метаболических расстройств, степенью дестабилизации клеточных мембран, а также возможностями реактивации структурных и ферментных белков в условиях гипоксии.
Вышеизложенное указывает на необходимость дальнейшей детализации механизмов развития гипоксии на молекулярно-клеточном, органном, системном уровнях, а также патогенетического обоснования новых принципов медикаментозной коррекции метаболических и функциональных сдвигов при указанном типовом патологическом процессе.
Как указывалось выше, в соответствии с общепринятыми классическими описаниями происхождения и классификации гипоксических состояний различают гипоксии экзогенного и эндогенного происхождния. Последняя включает дыхательную, циркуляторную, гемическую и тканевую гипоксии системного или локального характера.
Общепринятым является представление о том, что в основе развития гипоксий различного генеза лежат нарушения окислительно-восстановительных реакций в связи с дефицитом кислорода. В то же время высказывается точка зрения о возможности развития субстратного типа гипоксии, обусловленной недостаточностью субстратов окисления, например, глюкозы для нервных клеток, жирных кислот для миокарда.
Как известно, динамика формирования структурных и функциональных сдвигов в различных органах и тканях при гипоксии определяются в значительной мере темпами ее развития, локализацией патологии, характером этиологических факторов, инициирующих гипоксию, и особенностями компенсаторно-приспособительных реакций в том или ином органе.
В соответствии с данными литературы устойчивость тканей различных органов и систем к гипоксии широко варьируют. Наиболее чувствительной к гипоксии является нервная система: при полном прекращении кровотока признаки повреждения коры головного мозга обнаруживается через несколько секунд. Снижение потребления кислорода на 20% структурами головного мозга вызывает потерю сознания. Через 5-6 мин аноксии головного мозга возникают глубокие структурные изменения нейронов, а в продолговатом мозге – через 10-15 мин.
В сердечной мышце мелкие очаги некроза появляются через 3-5 мин с момента, развития ишемии, а крупноочаговый инфаркт миокарда формируется уже спустя 20-30 мин.
Недостаток кислорода в тканях приводит, прежде всего, к дефициту макроэргических соединений, образуемых в сопряженных с окислительно-восстановительными процессами реакциях фосфорилирования на внутренней мембране митохондрий.
Основным энергетическим субстратом для нервной системы, а также для клеток других органов и тканей, является глюкоза. Между тем, при нормальной оксигенации миокарда основным источником его энергетического обеспечения являются высшие жирные кислоты. Так, при окислении 1 молекулы пальмитиновой кислоты образуется 130 М АТФ. В условиях ишемии миокарда усиливается конкурентное ингибирование использования жирных кислот лактатом, что приводит к значительному снижению энергообеспечения миокарда. Так, в процессе анаэробных гликолитических реакций энергетический выход на 1 молекулу глюкозы составляет 2 М АТФ.
Вышеизложенное свидетельствует о том, что независимо от характера этиологических факторов и механизмов развития гипоксии, наиболее ранними проявлениями нарушения оксигенации тканей являются сдвиги их энергетического обеспечения и связанные с ними нарушения углеводного, жирового и белкового метаболизма.
Как известно, процессы ресинтеза АТФ а митохондриях тесно связаны не только с окислительно-восстановительными реакциями, но и с реакциями гликолиза, липолиза, протеолиза, являющимися поставщиками Ац-СоА для цикла Кребса. Установлено, что регулирующими ферментами гликолиза являются фосфорилаза, гексокиназа, фосфофруктокиназа, пируваткиназа, поэтому их подавление в условиях гипоксии приводит к уменьшению образования свободной энергии и в ряде случаев носит необратимый характер. В то же время роль главного регуляторного фермента в последовательных реакциях гликолиза играет фосфофруктокиназа, которую ингибируют АТФ и цитрат, а стимулируют АМФ и АДФ.
Таким образом, в условиях гипоксии, в случаях увеличения потенциала фосфорилирования, возникает активация ключевого фермента гликолиза – фосфофруктокиназы (ФФК) и соответственно возрастание пропускной способности реакции анаэробного гликолиза. При этом резко снижается запас гликогена в сердце, мозге, печени, почках, мышцах и других тканях и соответственно накапливаются продукты гликолитических реакций – молочная и пировиноградная кислоты.
Так активация ФФК на начальных этапах ишемического или гипоксического повреждения клеток приводит к усилению мобилизации гликогена, несколько улучшает энергообеспечение тканей. При этом истощаются запасы гликогена, усиливается ацидоз, приводящий на пике своего развития к подавлению ФФК, и соответственно полной блокаде энергообеспечения клетки.
Развитие метаболического ацидоза при гипоксических состояниях усугубляется также недостаточностью реакций окисления жирных кислот, аминокислот, чрезмерным накоплением кислых продуктов метаболизма указанных соединений.
На обеих стадиях окисления жирных кислот атомы водорода или соответствующие им электроны передаются по митохондриальной цепи переноса электронов на кислород. С этим потоком электронов сопряжен процесс окислительного фосфорилирования АДФ до АТФ. Следовательно, в условиях гипоксии различного генеза блокируются процессы окисления жирных кислот в тканях, в избытке накапливаются кислые продукты, формируется метаболический ацидоз, и соответственно развиваются дефицит АТФ, подавление всех энергозависимых реакции.
Касаясь функциональной значимости метаболического ацидоза, закономерно развивающегося при гипоксии различного генеза, следует отметить ряд последующих неспецифических метаболических и функциональных расстройств, представляющих собой динамическую трансформацию реакций адаптации в реакции дезадаптации.
Как известно, типовой реакцией тучных клеток и тромбоцитов на развитие гипоксии и ацидоза является их дегрануляция с избыточным освобождением в окружающую среду высокоактивных соединений – гистамина, серотонина, ФАТ, ФХЭ, ФХН, лейкотриенов, интерлейкинов. В свою очередь, избыточное накопление ионов водорода, биологически активных соединений приводит к резкому увеличению проницаемости биологических мембран за счет структурных переходов в белках и липидах, и активации процессов свободно-радикального окисления.
Таким образом, среди механизмов, приводящих к повреждению биологических мембран при гипоксии различного генеза, необходимо выделить следующие:
1) развитие метаболического ацидоза,
2) выброс вазоактивных соединений тучными клетками,
3) активацию процессов липопероксидации,
4) высвобождение лизосомальных гидролаз при дезорганизации лизосомальных мембран с последующим усугублением метаболических сдвигов.
13.2. Механизмы развития гипоксического некробиоза.
В настоящее время очевидно, что развитие гипоксического некробиоза связано в значительной мере с дезорганизацией цитоплазматических, лизосомальных, митохондриальных, и других биологических внутриклеточных мембран, формирующих отдельные функциональные и структурные компартменты.
Причем наиболее ранние расстройства возникают у градиентсоздающих и сократительных систем клеток.
Важнейшим фактором повреждения клеток при гипоксии являются ионы кальция.
Как известно, внутриклеточная концентрация кальция в состоянии покоя поддерживается в среднем на уровне 10-7М, что в 100.000 раз меньше, чем в межклеточной жидкости. В период возбуждения кальций проникает из внеклеточной среды в клетку через потенциалзависимые кальциевые каналы. При этом возникают активация фосфолипазы С и образование липидных внутриклеточных посредников – диацилглицерина и инозинфосфамина. Цитоплазматический кальций взаимодействует с кальмодулином – внутриклеточным рецептором с последующей активацией кальмодулинзависимых протеинкиназ и включением тех или иных внутриклеточных реакций.
В условиях гипоксии, дефицита энергетического обеспечения клеток возникают недостаточность механизмов инактивации цитоплазматического кальция и удаления его из клеток в связи с подавлением активности АТФ-зависимого Са-насоса, натрий- кальциевого обменного механизма, дестабилизацией митохондриальных мембран и мембран эндоплазматического ретикулума, играющих в условиях нормы важную роль в поддержании баланса внутриклеточного кальция. При избытке внутриклеточного кальция усугубляются процессы набухания митохондрий, усиливаются дефицит АТФ и подавление всех энергозависимых реакций в клетке. Избыток кальция активизирует ядерные эндонуклеазы, фрагментирующие ДНК, индуцирует апоптоз. При высоком уровне внутриклеточного кальция активизируются нейтральные протеазы – кальципаины, разрушающие цитоскелет клетки, в частности, белки фоурин и В-актин, лизирующие рецепторы и протеинкиназу С.
При гипоксическом некробиозе вокруг гибнущих клеток формируется кальцийзависимая активация системы комплемента, активация коагуляционного и тромбоцитарного звеньев гемостаза, а также фибринолиза и калликреин-кининовой системы.
Активация под влиянием кальция мембранных фосфолипаз приводит к дальнейшей дезинтеграции мембран клеток, активации циклооксигеназы и липооксигеназы с последующим образованием простагландинов, лейкотриенов, свободных радикалов с выраженным цитотоксическим действием.
Чрезвычайно важна роль дезинтеграции митохондриальных мембран в механизмах гипоксического некробиоза клеток.
Как известно, в клетках эукариот все специфические дегидрогеназы принимают участие в окислении пирувата и других субстратов, локализованных в митохондриальном матриксе. Во внутренней мембране митохондрий локализуются переносчики электронов, составляющие дыхательную цепь и ферменты, катализирующие синтез АТФ из АДФ и фосфата.
В связи с этим очевидно, что продукты гликолиза, липолиза, протеолиза, вовлекаемые через ацетил-СоА в цикл Кребса, а также АДФ должны пройти через обе мнтохондриальные мембраны, в то время как новообразованные АТФ проникают из внутренней мембраны митохондрий в цитоплазму клетки и далее к местам энергетических трат. Установлено, что наружная мембрана легко проницаема для всех молекул и ионов небольшого размера, в то время как во внутренней мембране имеются специальные ферментативные транспортные системы, обеспечивающие трансмембранный перенос ионов и различных соединений.
Таким образом, при избыточном накоплении ионов кальция в клетке, активации процессов липопероксидации при гипоксии различного генеза резко повышается проницаемость митохондриальных мембран, возникает набухание митохондрий, пространственная дезориентация ферментативных систем транспорта электронов, синтеза АТФ. В результате происходят разобщение окислительного фосфорилирования и дыхания и соответственно подавление всех энергозависимых систем клетки: синтеза белка, трансмембранного переноса ионов, сопряжения процессов возбуждения и сокращения в мышечных структурах и т.д.
В процессе набухания митохондрии энергия потока электронов трансформируется в тепловую энергию.
Наряду с локальными и системными метаболическими сдвигами в тканях, обусловленными гипоксией, ацидозом, активизацией процессов липопероксидации, возникает комплекс метаболических и функциональных сдвигов, обусловленных выбросом гормонов адаптации – катехоламинов, глюкокортикоидов.
Как известно, при чрезмерной активации симпатоадреналовой системы (САС) реакции адаптации довольно быстро трансформируется в дезадаптационные процессы. Во-первых, при активации освобождения норадреналина происходит спазм сосудов переферических органов и тканей и соответственно усугубление циркуляторной гипоксии. На фоне активации САС при участии постсинаптических β-адренорецпторов возможна активация процессов гликолиза, гликогенолиза, липолиза, что, безусловно, усугубляет развитие ацидотических сдвигов, свойственных гипоксии.
Усиление адренергетических влияний закономерно сопровождается активацией процессов липопероксидации, что вносит весомый вклад в механизмы развития гипоксического некробиоза клеток органов и тканей, чувствительных к ишемии.
Синхронно с освобождением катехоламинов в условиях гипоксического стресса выбрасываются глюкокортикоиды, индуцирующие процессы лизиса и апоптоза в лимфоидной ткани, блокирующие процессы пролиферации и репаративной регенерации в ряде внутренних органов.
ЦИТОТОКСИНЫ
Цитотоксины (греческий kytos вместилище, здесь — клетка + токсины) — антитела, вызывающие повреждение клеток. Иногда в качестве синонима понятия «цитотоксины» употребляют термин «цитолизины», который имеет более широкое значение, так как применим к любым веществам, способным растворять клеточные элементы. Антитела, разрушающие эритроциты, обычно называют гемолизинами (см. Гемолиз), разрушающие лейкоциты — лейколизинами, инактивирующие сперматозоиды—сперматолизинами. К цитотоксинам относят также бактериолизины — антитела к бактериальным антигенам, способные в присутствии комплемента вызывать бактериолиз (см.).
Цитотоксины образуются при иммунизации животного антигенами клеточного происхождения, которые могут принадлежать к тканям животного другого вида (гетероцитотоксины), того же вида, но другой генетической линии (гомоцитотоксины), к тканям животного той же линии, что и иммунизируемое (изоцитотоксины), и к собственным тканям иммунизируемого животного (аутоцитотоксины). Чем больше антигены донора отличаются от антигенов реципиента, тем легче образуются антитела. Поэтому на практике цитотоксины получают, иммунизируя животное клеточной взвесью или антигенным материалом органов животного другого вида. Полученные при этом иммунные сыворотки содержат разные типы антицеллюлярных антител (антицеллюлярные сыворотки) или антиорганных антител (антиорганные сыворотки), как способствующих, так и не способствующих возникновению цитотоксического действия. В связи с этим термины «антицеллюлярная сыворотка» и «антиорганная сыворотка» являются более широкими, чем термин «цитотоксическая сыворотка», применяемый к тем сывороткам, цитотоксическое действие которых подтверждено.
Установлено, что при аллотрансплантации тканей в крови реципиента появляются гомоцитотоксины, которые, очевидно, играют определенную роль в механизме отторжения аллотрансплантата. При изотрансплантации, вероятно, образуется незначительное количество цитотоксинов, их значение в механизме отторжения трансплантата несущественно, и изотрансплантаты, как правило, приживают (см. Трансплантация).
В 1898 году Ж. Борде в лаборатории И. И. Мечникова показал, что иммунизация гетерогенными эритроцитами сопровождается образованием специфических антител — гемолизинов. Этим была доказана возможность получения антител не только против микроорганизмов, но и против клеточных элементов макроорганизма, что легло в основу учения о цитотоксинах. В 1900 году, иммунизируя морских свинок тканями кроличьего семенника, И. И. Мечников получил спермоцитотоксическую сыворотку, обездвиживающую сперматозоиды морской свинки. И. И. Мечников и А. М. Безредка изготовили лейкотоксическую и гемолитическую сыворотки. Лейкотоксическая сыворотка была получена при иммунизации морской свинки клетками лимфоидных органов кролика, гемолитическая сыворотка — при иммунизации эритроцитами. Обе сыворотки проявляли специфическое действие, избирательно направленное в первом случае на лейкоциты (иммобилизация и распад их), во втором — на эритроциты (гемолиз). Введение этих сывороток в больших дозах снижало соответственно число лейкоцитов и эритроцитов, инъекции малых доз, наоборот, приводили к увеличению их числа в крови. Таким образом, в лаборатории Мечникова было не только заложено учение о цитотоксинах, но и показано принципиальное различие в действии больших и малых доз цитотоксических сывороток: большие дозы проявляли токсическое действие, малые дозы действовали как активаторы.
После И. И. Мечникова спермоцитотоксины были получены С. И. Метальниковым (1900), Е. С. Лондоном (1901), М. П. Тушновым (1911) и др. В дальнейшем рядом исследователей были получены тестикулоцитотоксины, овариоцитотоксины и плацентоцитотоксины, применение которых в больших дозах приводило к дистрофическим процессам соответственно в семенниках, яичниках и плаценте. Были получены гепатоцитотоксины, вызывавшие в печени жировую дистрофию, развитие цирроза и некротические изменения; нефроцитотоксины, при введении которых развивались тяжелые изменения в почках. Вводимые в больших дозах нейротоксины вызывали тяжелые поражения головного мозга и периферических нервов. Аналогичные изменения в тканях глаза возникали под влиянием офтальмоцитотоксинов, приготовленных С. С. Головиным (1904) и др. Были получены цитотоксины, действующие на ткани сердца, желудка, селезенки, кожи, желез внутренней секреции и других органов.
В 1909 году А. А. Богомолец доказал возможность стимуляции функции надпочечников малыми дозами супрареноцитотоксинов. С помощью морфологических и физиологических методов исследования он установил, что введение кошке малых доз супрареноцитотоксической сыворотки вызывает повышение АД, учащение пульса и дыхания. Микроскопические изменения в надпочечниках свидетельствовали об усилении под влиянием цитотоксинов их гормональной активности. Эту работу А. А. Богомольца следует считать началом физиологического периода в изучении цитотоксинов в отличие от предшествовавшего, преимущественно морфологического. В 1925 году Л. А. Варшамовым и И. А. Леонтьевым в лаборатории А. А. Богомольца была впервые получена цитотоксическая сыворотка к активным элементам соединительной ткани, названная А. А. Богомольцем антиретикулярной цитотоксической сывороткой (см.).
В. К. Линдеман, H. Н. Нефедьев и П. А. Герцен показали, что при повреждении одной из почек в организме подопытного животного возникают аутоцитотоксины, оказывающие повреждающее действие на здоровую почку. Аутоцитотоксины в большем или меньшем количестве продуцируются при распаде любой ткани в организме в результате заболевания или экзогенного повреждения (лучевое воздействие, ожог и др.); при этом в кровь больного поступают аутоантигены. Аутоиммунизация, приводящая к возникновению аутоцитотоксинов (аутоантител), играет существенную роль в механизме дальнейшего развития патологического процесса. При воспалительных, дистрофических и других заболеваниях щитовидной железы установлено наличие в крови аутотиреоцитотоксинов.
Цитотоксины получают так же, как и другие высокоактивные и специфические препараты антител. Специфичность цитотоксинов достигается иммунизацией животных органоспецифическими очищенными антигенами или тщательной адсорбцией иммунной сыворотки органоспецифическими антигенами, присутствовавшими в использованном для иммунизации материале. Проблема получения узкоспецифических цитотоксинов, как и других высокоспецифических антител, решается в настоящее время на основе гибридомной техники (см. Гибридома), позволяющей получать моноклональные антитела.
Степень нарушения функции органа зависит от дозы, биологической активности цитотоксина и функциональной лабильности клеточного субстрата. Часть клеток гибнет под действием цитотоксинов у сохранившихся клеток нарушается функция.
Механизм действия малых доз цитотоксинов, стимулирующих функцию органа сложнее. В связи с образованием на мембране клетки комплекса антиген — антитело функция соответствующих клеток органа нарушается, часть тканевых элементов, очевидно, наименее стойких, погибает, но одновременно идет процесс восстановления, сопровождающийся выраженной функциональной активизацией органа. Такое объяснение действия малых доз цитотоксинов, в частности антиретикулярной цитотоксической сыворотки, дал А. А. Богомолец. В настоящее время оно является общепринятым.
Механизм действия цитотоксинов заключается в активации системы комплемента (см.) образующимся комплексом антиген—антитело (см. Антиген— антитело реакция). Цитотоксическим действием обладают антитела, принадлежащие к иммуноглобулинам (см.), с выраженной комплемент связывающей способностью. Цитотоксины принадлежат преимущественно к иммуноглобулину класса G. Изменение пространственной структуры молекулы антитела в результате связывания с антигеном приводит к обнажению на антителе участков, связывающих комплемент. Этапы последовательной активации компонентов комплемента, ведущие к цитолизу, наиболее полно изучены на эритроцитах на примере иммунного гемолиза (см.) и подтверждены на других клетках. Разрушение клеточных мембран при действии цитотоксинов и комплемента установлено с помощью электронной микроскопии. Повреждения, возникающие в мембранах эритроцитов, представляют собой круглые отверстия диаметром 8—10 нм. В ядросодержащих клетках происходит инвагинация клеточных мембран, набухание митохондрий и мембран эндоплазматической) ретикулума. Повышение проницаемости клеточной мембраны проявляется потерей внутриклеточных ионов калия, аминокислот и рибонуклеотидов. Клетки набухают, и в результате осмотического лизиса из них высвобождаются белки и нуклеиновые кислоты. Собственно лизис клеточной мембраны осуществляется на последнем этапе активации системы комплемента декамолекулярным комплексом с вовлечением компонентов комплемента C5 — C9. Декамолекулярный комплекс (по одной молекуле С5, С6, С7, С8 и 6 молекул С9) имеет молекулярный вес (массу) около 995 000. Возможно, что повреждение возникает в результате взаимодействий этого комплекса с липидами клеточной мембраны. Морфологические признаки повреждения клеточной мембраны становятся заметными после фиксации С5 вследствие детергентного действия активированной формы этого компонента (C5), который проявляет резко выраженные гидрофобные свойства по отношению к фосфолипидам мембраны. Взаимодействие других компонентов комплемента усиливает детергентное действие С5, что приводит к расплавлению участков клеточной мембраны.
Цитотоксины применяют в экспериментальных исследованиях для изучения функции отдельных органов и систем. Методы цитотоксической стимуляции и цитотоксического подавления функции различных органов и физиологических систем вошли в арсенал патофизиологических методов. Аналогичное действие цитотоксины оказывают in vitro при добавлении их в питательную среду. Так, малые дозы цитотоксинов усиливают пролиферацию соответствующих клеточных элементов, большие дозы подавляют размножение клеток.
Цитотоксины, специфичные к поверхностным антигенам определенных клеток, применяют для идентификации этих клеток в цитотоксическом тесте in vitro в присутствии комплемента. Примером может служить использование иммунных сывороток и моноклональных антител для идентификации популяций и субпопуляций лимфоидных клеток.
В клинической практике применяют в малых дозах антиретикулярную цитотоксическую сыворотку с целью повышения защитных функций организма при инфекционных и опухолевых процессах. Для усиления эритроцитопоэза, лейкоцитопоэза или тромбоцитопоэза вводят цитотоксические сыворотки, полученные при иммунизации животного соответственно эритроцитами, лейкоцитами или тромбоцитами. Для ускорения восстановления нормального состава крови у доноров, а также при гипорегенераторной анемии (см.) используют миелоцитотоксическую сыворотку.