цитограмма плоскоклеточная метаплазия что это
Плоскоклеточная метаплазия мочевого пузыря. Симптомы. Причины. Диагностика. Лечение метаплазии в Санкт-Петербурге.
Метаплазия определяется как трансформация уротелия, приводящая к замещению нормального уротелия плоским эпителием.
Проблема плоскоклеточной метаплазии мочевого пузыря изучена недостаточно.
На первоначальных этапах развития, плоскоклеточная метаплазия является защитным механизмом стенки мочевого пузыря в ответ на агрессивное воздействие на слизистую различных факторов, при этом, не исключается самостоятельное восстановление уротелия.
Существует два типа метаплазии:
Некератинизирующая плоскоклеточная метаплазия
Кератинизирующая плоскоклеточная метаплазия
В большинстве случаев плоскоклеточная метаплазия это процесс изменения эпителия слизистой мочевого пузыря без кератинизации. Кератинизирующая плоскоклеточная метаплазия достаточно редкое состояние, встречается с частотой 1 случай на 10 тыс. выявленных изменений.
Симптоматика
Симптомы плоскоклеточной метаплазии могут быть яркие, насыщенные, сходные с проявлениями цистита.
Пациенты с образованиями на слизистой оболочке мочевого пузыря жалуются на:
Эти симптомы могут указывать на разные болезни мочеполовой системы. Отсутствие положительного результата после применения антибактериальных и противовоспалительных препаратов дает повод к проведению дальнейшего обследования пациента. Наличие метаплазии подтверждается в ходе цистоскопии и патоморфологического исследования после биопсии измененных тканей.
Причины болей при плоскоклеточной метаплазии мочевого пузыря достаточно не изучены. Боль обычно объясняется нарушением слоя гликозаминогликанов (GAG, соединений сложной структуры, имеющих отрицательный заряд), покрывающих уротелий. Это нарушение приводит к «синдрому проникающего эпителия», который позволяет проникать аллергенам, химическим раздражителям, лекарствам, токсинам и ионам калия в ткань мочевого пузыря, в результате чего возникает синдром болезненного мочевого пузыря. Проникновение мочи в подслизистый слой может служить причиной поддержания постоянного воспалительного процесса в стенке мочевого пузыря. В некоторых исследованиях обсуждается лечение синдрома болезненного мочевого пузыря с использованием инстилляции в мочевой пузырь гиалуроновой кислоты (ГК), как одного из компонентов GAG слоя с положительной ответной реакцией.
В некоторых исследованиях сообщалось о возникновении плоскоклеточной метаплазии в нейрогенном мочевом пузыре, особенно среди тех, кто подвергается опорожнению мочевого пузыря с помощью постоянного катетера.
Данные исследований рецепторов мочевого пузыря, в частности исследования ванилоидных рецепторов TRPV1, которые располагаются в подслизистой основе, объяснили механизм диссинергии детрузора и сфинктера. Чрезмерное срабатывание рецептора приводит к боли и поллакиурии с возможной последующей полной анергией.
Колебания рН среды мочевого пузыря вызывают раздражение рецепторов и, как следствие, дискомфорт и расстройства поведения мочевого пузыря. Присутствие мускариновых и никотиновых рецепторов в клетках уротелия может указывать на активное участие уротелия в регуляции функции мочевого пузыря. Ацетилхолин, высвобождаемый под воздействием различных импульсов (механических, биохимических и др.), стимулирует нервную систему, что приводит к чрезмерному сокращению мышц детрузора и, как следствие, к поллакиурии.
Этиология
Выделяют следующие причины метаплазии у женщин:
Метапластические изменения без ороговения в области мочепузырного треугольника считаются нормальным процессом в женском организме и расцениваются как реакция на выработку эстрогена. Такие изменения получили название «вагинальной метаплазии» из-за того, что при исследовании состояние эпителия напоминает метаплазию шейки матки. Такой вид встречается в основном у молодых женщин. Он характеризуется отсутствием клеточной атипии, присутствует у 80 % пациенток. У мужчин такой тип метаплазии встречается обычно в случае получения эстрогенов в составе терапии заболеваний предстательной железы.
Опасения вызывает кератинизирующая метаплазия, отличие которой состоит в ороговении мембраны. На начальном этапе плоскоклеточная метаплазия выполняет защитную функцию, предохраняя стенки мочевого пузыря от негативного внешнего влияния.
Изменения могут возникнуть как ответ на различные стрессовые факторы, в частности хронический цистит, бактериурия, конкременты мочевого пузыря, склеротические изменения, а также раздражение химическими реагентами, лекарствами. Наиболее опасны внутриклеточные паразиты такие, как уреаплазма, хламидии. При этом анализы мочи будут нормальными, потому что инфекция проникает глубоко внутрь слизистой оболочки. Результатом длительного воспалительного процесса являются изменения на клеточном уровне. Обнаружить образование можно с помощью цистоскопии.
Как одну из причин возникновения плоскоклеточной метаплазии называют яйца шистосом, что вызывает серьезные осложнения.
Проникновение мочи в подслизистый слой в районе бляшек поддерживает воспалительный процесс, усугубляя картину течения болезни. Если площадь поражения составляет 50 %, есть риск трансформации в онкологическое заболевание. На это влияет и длительность течения болезни, как отмечалось ранее.
Диагностика
Самым главным и информативным методом является цистоскопия с биопсией измененной слизистой мочевого пузыря.
Цистоскопическая картина выглядит достаточно характерно: плотное белесоватое стелящееся образование или бляшки, возвышающиеся над слизистой на 1-2 мм, располагаются в области мочепузырного треугольника, могут распространяться на область устьев и шейку мочевого пузыря. Некоторыми авторами цистоскопическая картина сравнивается с «картиной талого снега». Очаги поражения могут четко выделяться на фоне гиперемированной слизистой, зачастую сливаются с ней.
Решение о проведении биопсии тканей мочевого пузыря принимается по решению врача в большинстве случаев.
Также целью обследования больных является выявление факторов, которые вызывают нарушения в деятельности мочеполовой системы. В частности, проводится микробиологическое исследование мочи, анализы соскоба методом ПЦР на скрытые инфекции или ЗППП, исследования крови и отделяемого на вирусное поражение, при необходимости привлекаются смежные специалисты: эндокринологи, неврологи.
Лечение
Терапия метаплазии зависит от возраста пациента, разновидности и тяжести заболевания. В первую очередь следует установить и ликвидировать причины, из-за которых появилось образование.
Если причиной являются инфекционные возбудители, то проводят антибактериальную терапию. Она отличается продолжительным характером и занимает около 2 – 3 месяцев, а иногда принимается решение о более длительном сроке 6-12 месяцев. В случаях, когда заболевание вызвано половыми инфекциями, лечение следует пройти обоим партнерам.
Некератинизирующая метаплазия не считается опасным заболеванием, имеющим риск развития онкологии, и не требует оперативного вмешательства в большинстве случаев. Для лечения предусмотрены современные методы терапии.
Один из способов устранения плоскоклеточной метаплазии – лазерная фототермокоагуляция. Метод заключается в использовании цистоскопа с лазерным электродом, с помощью которого прижигаются пораженные участки. Операция проводится под наркозом. После процедуры не требуется установки катетера, обезболивания. Через несколько дней больные чувствуют значительные улучшения. Рецидивы крайне редки. Исключено появление рубцов, спустя месяц на месте операции появляется гладкий эпителий. Подобные результаты достигают при использовании аргоноплазменной коагуляции.
К эффективным методам лечения относится и трансуретральная резекция. Процедура более травматичная, поэтому применяется только при наличии больших участков поражения. Проводится операция с помощью резектоскопа. Петля аппарата захватывает и удаляет образования, биологические образцы которого отправляют для дальнейшего изучения в лабораторию.
Наряду с радикальными мероприятиями предусмотрена комплексная терапия, включающая:
При появлении симптомов цистита, которые так сходны с симптомами плоскоклеточной метаплазии, не следует заниматься самолечением. В этих случаях нужно обратиться к специалистам и постараться пройти комплексное обследование, включающее цистоскопию и гистологическое исследование. Заболевание проще вылечить на ранних стадиях возникновения.
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Т. А., гинеколога со стажем в 13 лет.
Определение болезни. Причины заболевания
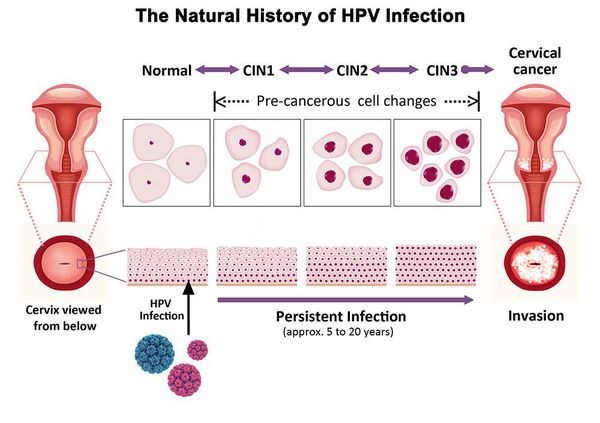
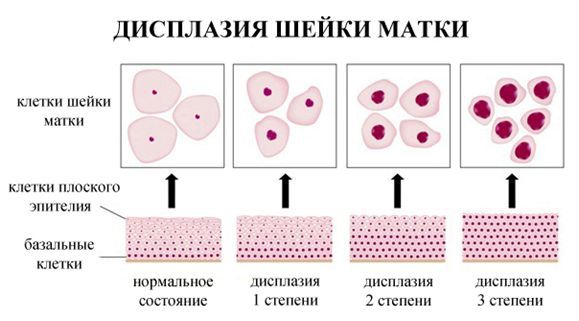
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
Основной фактор развития дисплазии и рака шейки матки — папилломавирусная инфекция (ПВИ), причем длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
Кроме того, была выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
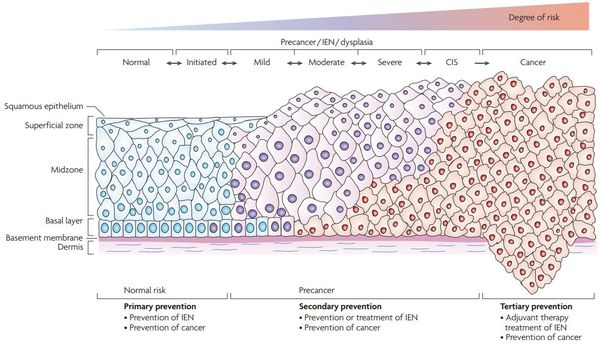
Классификация и стадии развития дисплазии шейки матки
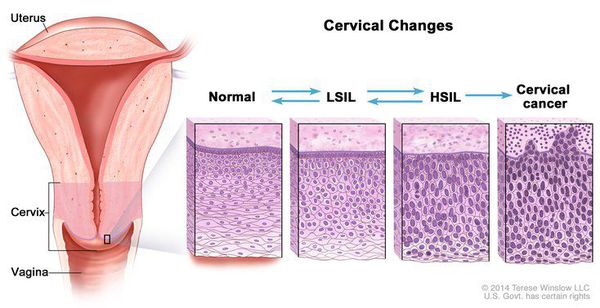
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
Классификация Папаниколау
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя шейки матки выделяют:
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
Осложнения дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
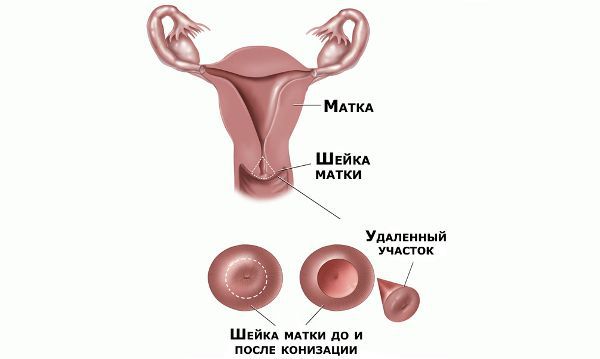
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
В России данная система включает последовательность действий:
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
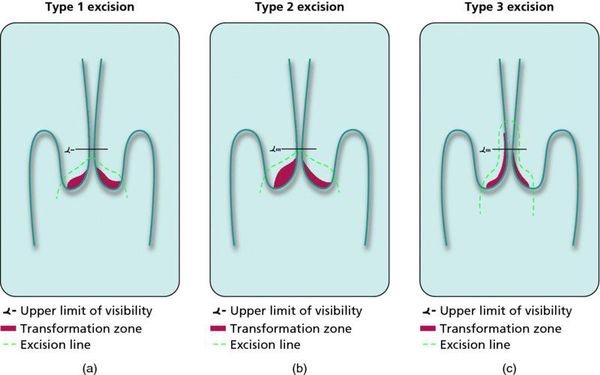
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии. При выявлении HSIL (ЦИН 2 c обнаружением белка р16 при биопсии, ЦИН 3) неизбежно хирургическое лечение в виде абляции («прижигания») или эксцизии (удаления) поврежденной ткани. Для абляции используют электро-/радио-, крио- и лазерные воздействия. Эксцизия возможна электро-/радиоволновая или ножевая.
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
Прогноз. Профилактика
При своевременном выявлении и лечении дисплазии шейки матки прогноз благоприятный. Основным фактором развития и прогрессирования дисплазии шейки матки является длительное инфицирование канцерогенными типами ВПЧ. Для предупреждения заражения ВПЧ существуют профилактические вакцины «Церварикс» (защита от 16, 18 типов ВПЧ), «Гардасил» (профилактика инфицирования 6, 11, 16, 18 типами вируса), в декабре 2014 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило использование вакцины «Гардасил9», защищающей от инфицирования 9 типами ВПЧ (6, 11, 16, 18, 31, 33, 45, 52, 58). Однако на российском рынке данный продукт ещё не доступен. «Церварикс» зарегистрирована для вакцинации женщин от 10 до 25 лет; «Гардасил» показана к применению детям и подросткам в возрасте от 9 до 15 лет и женщинам от 16 до 45 лет.
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан «Об утверждении порядка проведения диспансеризации определенных групп взрослого населения», осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.
Лечение плоскоклеточного рака шейки матки и аденокарциномы
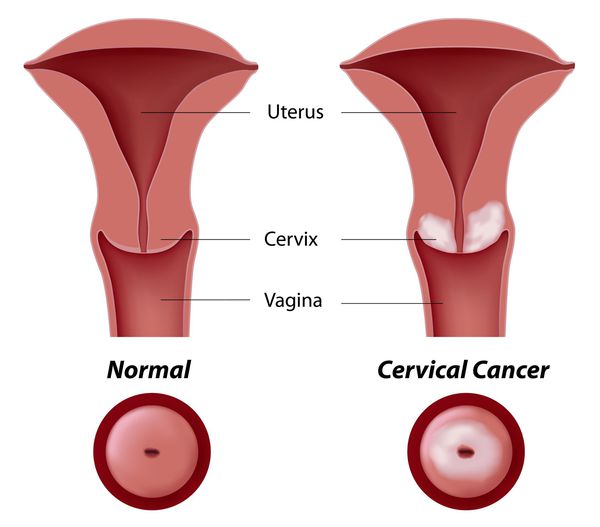
Рак шейки матки – это злокачественная опухоль, развивающаяся из клеток эндометрия и подразделяющаяся на плоскоклеточный рак и аденокарциному.
Шейка матки покрыта разными типами эпителия. Во влагалищной ее части присутствует многослойный плоский эпителий, из которого развивается плоскоклеточный рак. В цервикальном канале находится железистый цилиндрический эпителий, из которого развивается аденокарцинома. Чаще всего опухолевые образования возникают в переходной зоне этих двух видов эпителия (у наружного отверстия матки).
Причины рака шейки матки
Доказанных причин развития рака шейки матки учеными пока не обнаружено, но существуют определенные факторы, наличие которых может спровоцировать это заболевание.
Признаки рака шейки матки
Рак шейки матки может не давать яркой симптоматики на ранней стадии развития. Но существуют определенные признаки, которые должны насторожить:
Диагностика рака шейки матки
Чтобы не допустить развития рака шейки матки, необходимы постоянные профилактические обследования, а при нахождении в группе риска – и специфические диагностические мероприятия.
Только после получения всех необходимых данных, разрабатывается курс лечения.
Варианты лечение рака шейки матки
Выбор метода лечения зависит от особенностей опухоли (стадии развития, локализации, степени распространения).
Лучевая терапия. Проводится либо как основной метод лечения (при наличии противопоказаний к хирургическому вмешательству, либо как дополнение к операции). Кроме того на ранних стадиях также возможна только лучевая терапия, которая проводится сразу двумя способами: внутриполостная (через влагалище конкретно к очагу поражения) и дистанционная (снаружи).
Химиотерапия. Как правило, проводится при обнаружении метастазов, поскольку ее воздействие на саму опухоль имеет слабый эффект, так как раковое поражение эндометрия малочувствительно к использованию химиопрепаратов. Также может проводиться в комплексе с лучевой терапией. Гормональная терапия. Применяется в отдаленном послеоперационном периоде при рецидиве. Позволяет смягчить симптомы, уменьшить размер опухоли, улучшить качество жизни пациентки. Как правило, назначаются препараты, снижающие выработку эстрогена.
Проводится на последних стадиях рака, при котором имеются поражения соседних органов (прямой кишки, мочевого пузыря) и отдаленное метастазирование. Как правило, лечение связано с симптоматической терапией.
Клетки эпителия
Плоскоклеточная метаплазия
Процесс, который характеризуется нераковыми изменениями в эпителиальных клетках шейки матки. Плоскоклеточная метаплазия возникает в результате совокупности общих и местных факторов, которые негативно влияют на организм, вызывая обратимый процесс, в ходе которого дифференцированные эпителиальные клетки преобразуются в более выносливые клетки многослойного плоского эпителия, с ороговением или без. Плоскоклеточная метаплазия цервикального канала также возникает как результат слияния с находящимся рядом эндоцервиксом. Изменение типа клеток может приводить к снижению функции эпителия. Когда патологические раздражители устраняются, метапластические клетки приобретают свою первоначальную форму и функцию. Сохранение физиологических стрессоров в областях, подверженных метаплазии, может приводить к дисплазии или предраковым клеточным изменениям. Развитие метаплазированных клеток происходит под влиянием герпеса или бактериальных инфекций (хламидиоз, токсоплазмоз, уреаплазмоз), протекающих на фоне ослабленного иммунитета и имеющих хроническую форму.
Кератоз
Представляет собой патологический процесс, который характеризуется пролиферацией и ороговением клеток плоского эпителия, выстилающего влагалищную часть шейки матки. При этом образуются утолщения или бляшки белого цвета с четкими границами, выступающие над поверхностью слизистых оболочек и могут быть видимы невооруженным глазом до любой обработки растворами.
Гиперкератоз
Это усиленное ороговение верхнего слоя многослойного плоского эпителия шейки матки. Считается, что причиной может быть недостаток эстрогена в организме женщины. В процессе ороговения слизистая покрывается плотными белесоватыми структурами, слегка выступающими над поверхностью здоровой ткани.
Паракератоз
Нарушения Ороговения эпителиального слоя эпидермиса (неполное ороговение). Характеризуется ороговением слизистых оболочек, потерей эпидермисом способности синтезировать кератогиалин (предшественник кератина) и нарушением морфологии слизистой оболочки. При данном процессе пораженный участок цервикального канала выглядит сморщенным из-за нарушения эластичности ткани. Такие островки более грубые.
Опасность представляет лейкоплакия, возникшая в результате активизации вируса папилломы человека высокого канцерогенного риска.
Трубная метаплазия
Характеризуется наличием в строме шейки матки нормальных по строению желез, выстланных клетками, напоминающими эпителий маточной трубы. Данная патология обычно представлена одиночной железой или группой желез и может быть реснитчатая либо секреторная. Трубная метаплазия часто встречается в неупорядоченном пролиферативном эндометрии
Атрофические изменения
Атрофия матки и шейки в большинстве случаев диагностируется у женщин в климактерическом периоде. Результатом данной патологии становится регресс эпителиальной ткани. Однако женщины детородного возраста также не застрахованы от атрофии шейки матки. Заболевание может развиться при дефиците эстрогенов, после оперативных вмешательств на шейке матки, при системных патологиях соединительной ткани. Атрофия шейки матки – один из факторов, вызывающих женское бесплодие.
В основном атрофические изменения происходят в период менопаузы. Снижение выработки гормонов приводит к исчезновению слизистой секреции, изменению бактериальной флоры. В результате происходит поэтапное сокращение толщины эпителия, что приводит ткани к раздражениям, травмам.
Изменения при беременности
В течение беременности устанавливается типичная для данного процесса картина мазка. Эти изменения связаны с продукцией гормонов плацентой и могут быть неверно трактованы как предопухолевые или опухолевые. Реактивные изменения шейки матки связаны с нарушением клеток ее эпителия. Возникают при: воспалениях, гиперкератозе, паракератозе, дискератозе, плоскоклеточной метаплазии, железистой гиперплазии, полипах, лимфоцитарном (фолликулярном) цервиците.