какую реакцию на индикатор показывают амины жирного ряда
Какую реакцию на индикатор показывают амины жирного ряда
3. Какую реакцию на индикатор показывают амины жирного ряда?
Ответ 1 : кислотную
Ответ 2 : нейтральную
Ответ 3 : щелочную
Ответ 4 : не действуют на индикатор
4. Характерной химической реакцией аминов, обусловленной наличием в их молекулах аминогруппы, является …
Ответ 1 : радикальное замещение
Ответ 2 : взаимодействие с кислотами с образованием солей
Ответ 3 : электрофильное присоединение
Ответ 4 : нуклеофильное присоединение
5. Какие реакции характерны для анилина?
- а) C 6 H 5 NH 2 + Br 2
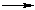
б) C 6 H 5 NH 2 + NaOH
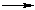
в) C 6 H 5 NH 2 + HCl
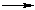
г) C 6 H 5 NH 2 + C 6 H 6
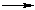
Ответ 1 : в
Ответ 2 : а, в
Ответ 3 : б, г
Ответ 4 : г
6. В приведенной схеме превращений соединением, относящимся к классу аминов,

Ответ 2 : Б
Ответ 3 : В
Ответ 4 : Г
7. Определите массу хлорида фениламмония, если к анилину массой 13,95 г добавили хлороводород, выделившийся на первой стадии хлорирования метана объемом Калькулятор
Амины
Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.
Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).
Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.
Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.
Получение
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.
При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.
В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.
В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.
Химические свойства аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.
Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.
Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».
Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.
При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Тесты по теме: «Амины»
Тесты по теме: «Амины»
1. При замещении водорода в аммиаке на органические радикалы получают:
а) амины; б) амиды; в) азиды; г) нитраты.
2. К ароматическим аминам относится
1) метиламин 2) бутиламин 3) триэтиламин 4) дифениламин
3. К первичным аминам не относится
1) изопропиламин 2) бутиламин 3) метилэтиламин 4) анилин
4. Вещество, относящееся к аминам, имеет формулу
6. Вещество CH3-NH-CH(CH3)2 относится к ряду …
7. Вещество, формула которого имеет вид C6H5-N(CH3)2, называется …
Получение.
8. Метиламин можно получить в реакции
А) аммиака с метаном
Б) восстановления нитрометана
В) хлорметана с аммиаком
Г) хлорида метиламмония с гидроксидом натрия
Д) метана с концентрированной азотной кислотой
Е) метанола с концентрированной азотной кислотой
9. Амины получаются в результате
1) нитрования алканов 2) окисления альдегидов
3) восстановления нитросоединений 4) взаимодействия карбоновых кислот с аммиаком
10. Анилин образуется при
1) восстановлении нитробензола 2) окислении нитробензола
3) дегидрировании нитроциклогексана 4) нитровании бензола
Свойства.
11. Водные растворы аминов окрасятся фенолфталеином в цвет
1) малиновый 2) желтый 3) фиолетовый 4) оранжевый
12. В водном растворе метиламина среда раствора
1) кислая 2) щелочная 3) нейтральная 4)слабокислая
13. Какую реакцию на индикатор показывают амины жирного ряда?
14. Ароматические амины проявляют
1) слабые кислотные свойства 2) сильные кислотные свойства
3) слабые основные свойства 4) амфотерные свойства
15. Более сильные основные свойства проявляет
1) анилин 2) аммиак 3) диметиламин 4) метиламин
16. Более слабым основанием, чем аммиак, является
1) этиламин 2) диметиламин 3) диэтиламин 4) дифениламин
17. Характерной химической реакцией аминов, обусловленной наличием в их молекулах аминогруппы, является …
| 1)радикальное замещение | 2)взаимодействие с кислотами с образованием солей | 3) электрофильное присоединение | 4) нуклеофильное присоединение 18. Метиламин взаимодействует с 1) серной кислотой 2) гидроксидом натрия 3) оксидом алюминия 4) толуолом 19. Какие из следующих утверждений верны? А. Анилин легче реагирует с бромом, чем бензол. Б. Анилин является более сильным основанием, чем аммиак 1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны 20. В реакцию с анилином не вступает 1) Вr2(р-р) 2)КОН 3)НСl 4) HNО3 21. При полном сгорании аминов образуются 22. При взаимодействии этиламина с водным раствором НВr образуется 1)бромэтан 2) бромид аммония 3) бромид этиламмония 4) аммиак 23. Какие реакции характерны для анилина? 1)б 2) а, в 3) б, г 4) г 24. Анилин от бензола можно отличить с помощью 1) раствора едкого натра 2) свежеосажденного гидроксида меди (II) 3) бромной воды 4) аммиака 25. Наличием неподелённой электронной пары у атома азота в диэтиламине можно объяснить его 1) основные свойства 2) способность к горению 3) способность к хлорированию 4) летучесть 26. Метилэтиламин взаимодействует с 1) этаном 2) бромоводородной кислотой, 3) кислородом 4) гидроксидом калия 5) пропаном 6) водой 27. Анилин взаимодействует с 1) гидроксидом натрия 2) пропионовой кислотой 3)хлором 4) толуолом 5) хлороводородом 6) метаном 28. Пропиламин взаимодействует с 2) муравьиной кислотой 29. Анилин взаимодействует с В) бромоводородной кислотой Д) гидроксидом натрия 30. Пропиламин может взаимодействовать с А) соляной кислотой Б) аммиаком В) водой Г) гидроксидом калия Д) хлоридом натрия Е) кислородом 31. Диметиламин взаимодействует с 1) гидроксидом бария 2) кислородом 3) оксидом меди (П) 4) пропаном 5) уксусной кислотой 6) водой 32. Метиламин А) газообразное вещество В) проявляет основные свойства Г) является менее сильным основанием, чем аммиак Д) реагирует с серной кислотой Е) реагирует с водородом 33. Этиламин Б) изменяет окраску лакмуса на синюю В) является донором электронной пары Г) проявляет амфотерность Е) реагирует с этаном 34. Этиламин взаимодействует с 1) метаном 2) водой 3) бромоводородом 4) бензолом 5) кислородом 6) пропаном Т. С. Боротюк, МКОУ СОШ №14, Тайшет, Иркутская область Хотите получать уведомления о возможности бесплатной публикации в журналах из списка ВАК и РИНЦ? Амины: способы получения, строение и свойстваАмины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы. Строение аминовТакже атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований. Классификация аминовПо количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины. По типу радикалов амины делят на алифатические, ароматические и смешанные.
Физические свойства аминовПри обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха. Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества. Первичные и вторичные амины образуют слабые межмолекулярные водородные связи: Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой. Амины также способны к образованию водородных связей с водой: Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются. Химические свойства аминов
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов: |


| Поэтому амины и аммиак обладают свойствами оснований. |
1. Основные свойства аминов
| Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. |
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
| Основные свойства аминов возрастают в ряду: |
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
| Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II): |
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
| Это качественная реакция на первичные амины – выделение азота. |
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.
| Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется. |
При 18 о С в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
| Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. |
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
| Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓). |
Получение аминов
Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.
Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Соли аминов
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
12 комментариев
Добавить ваш
Да, спасибо, поправил. В узком смысле реакцией Зинина называют получение именно ароматических аминов, в широком смысле так называют восстановление любых нитросоединений сульфидом аммония.
Здравствуйте! Скажите, пожалуйста, реагируют ли третичные амины с галогеналканами? Если да, то как идет реакция и что получается? Например,при взаимодействии триметиламина с хлорметаном?
Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
Здравствуйте! Не показано взаимодействие аминов со спиртами.
Третичные амины с алкилгалогенидами реагируют. Получаются четвертичные аммониевые соли. Говорить, что они вообще не реагируют, неправильно. Они не вступают в реакцию алкилирования.
По такой схеме за счет пары электронов на азоте реагируют алифатические амины, ароматические амины, пиридин с получением N-алкилпиридинийхлорида (иодида) и пр.
Да, спасибо за комментарий. Я имел в виду, что не идет дальнейшее замещение.
спасибо, отличная идея!
для полноты информации я бы добавил оптическую изомерию и примеры этой изомерии ко всем классам органических веществ, потому что на егэ это есть
На ЕГЭ пока оптической изомерии нет.
Admin>Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
что значит «дальнейшее»? у триметиламина — и так уже нет N-H связей, может вы имели в виду протонированный триметил-амин (скажем) солянокислый, что в форме соли он останется третичным амином например до момента щелочного депротонирования(высвобождения основания амина)
—
а что кстати, есть способ галоидным алкилом моноалкилирование первичного ароматического амина до вторичного осуществить, избежав образования третичного амина — диалкилированного уже
на этилировании уже проще, а вот метиллирование нейромедиаторов не удавалось остановить на стадии N,N-ДиМет.(например в ацетоне с карбонатом калия, или с DIPEA), выход третичного целевого амина всегда оказывался либо самым низким из продуктов реакции, либо просто очень низким(10% в сложной смеси аминов с преобладанием четвертичной соли триметиламмония метилиодида, а сейчас подумал — если при N-метилировании первичного ароматического амина метилиодидом, образуется гидроиодид N-метил…исх.пер.амина, он же даже во второе метиллирование уже не должен входить, усиленным основанием став (скажем адреналином, основнее норадреналина исходного как я понимаю за счет появившегося электроннодонороного метила) и так будет выведен из реакционной среды(например выпав осадком соли, не солватированной в неполярной РС)
получается в отсутствие основного катализа алкилирование первичных аминов ограничивается моно-алкилированием — не далее чем до вторичного амина? или на практике соли не так надёжны как в оптимистичных прогнозах теоретизирующего учащегося?
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.




















































