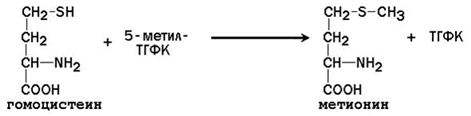какую реакцию катализирует карбамоилфосфатсинтетаза
| Карбамоилфосфатсинтетаза (гидролизующий глутамин) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 6.3.5.5 | ||||||||
| Количество CAS | 37233-48-0 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
| карбамоилфосфатсинтетаза 1, аспартаттранскарбамилаза и дигидрооротаза | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Условное обозначение | CAD | ||||||
| Ген NCBI | 790 | ||||||
| HGNC | 1424 | ||||||
| OMIM | 114010 | ||||||
| RefSeq | NM_004341 | ||||||
| UniProt | P27708 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 2 стр. 21 | ||||||
| |||||||
В биосинтезе пиримидина он служит ферментом, ограничивающим скорость, и катализирует следующую реакцию:
Ни CPSI, ни CPSII не требуют биотина в качестве кофермента, как видно из большинства реакций карбоксилирования.
Номенклатура
Карбамоилфосфатсинтетаза (гидролизирующая глутамин) также известна как:
Цикл мочевины и катаболизм аминокислот
Содержание
Цикл мочевины и краткий обзор катаболизма аминокислот [ править | править код ]
Рис. 44.1. Краткий обзор катаболизма аминокислот и детоксикации ионов NН4 + путем образования мочевины
При катаболизме аминокислот образуются ионы аммония (NН4 + ) [ править | править код ]
В желудке белки гидролизуются под действием пепсина с образованием аминокислот. Дальнейший гидролиз белков и всасывание аминокислот проходят в кишечнике. Часть этих аминокислот используется для биосинтеза белков, в том числе при восстановлении поврежденных тканей, биосинтеза гормонов, пиримидинов, пуринов и т.д. Избыток аминокислот может использоваться в глюконеогенезе или энергетическом обмене. Но при катаболизме аминокислот образуются очень токсичные ионы аммония (NН4 + ). Чтобы обезопасить организм от их действия, ферменты превращают ионы NН4 + в нетоксичную мочевину, которая сразу выводится почками.
В цикле мочевины из ионов аммония образуется мочевина [ править | править код ]
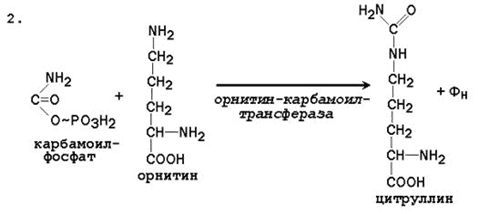
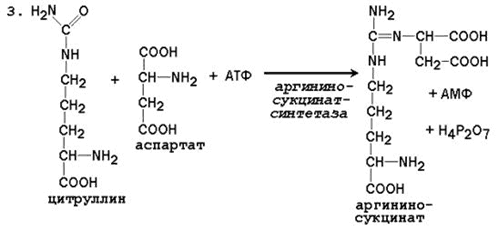
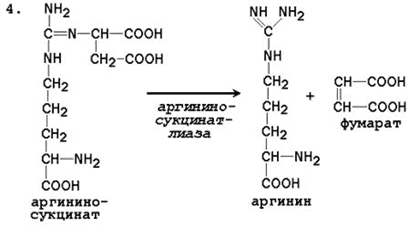
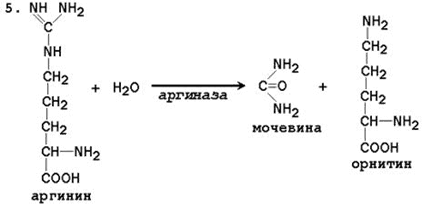
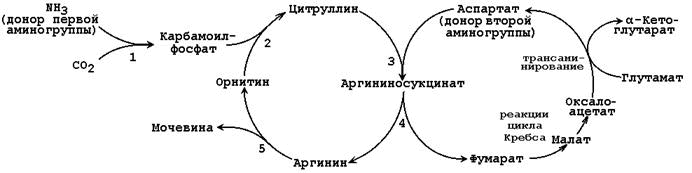
При катаболизме аминокислот ионы NН4 + образуются либо непосредственно при дезаминировании некоторых аминокислот, либо сначала в результате трансаминирования образуется глутамат, который затем дезаминируется, образуя NН4 + (рис. 44.1). Затем ион аммония реагирует с ионом бикарбоната и двумя молекулами АТФ с образованием карбамоилфосфата (реакцию катализирует карбамоилфосфатсинтетаза). Карбамоилфосфат реагирует с орнитином, образуя (под действием фермента орнитин-карбамоилтрансферазы) цитруллин. Затем с цитруллином связывается аспартат (он является донором второй аминогруппы мочевины) и образуется аргининосукцинат, который расщепляется на фумарат и аргинин. Наконец, аргинин в реакции гидролиза под действием аргиназы расщепляется на мочевину и орнитин, и орнитин вновь поступает в цикл образования мочевины.
Примечание: не путайте упомянутую карбамоилфосфатсинтетазу с карбамоилфосфатсинтетазой II, которая участвует в синтезе пиримидинов.
Нарушения цикла мочевины: недостаточность орнитин-карбамоилтрансферазы [ править | править код ]
Существует целый ряд довольно редких нарушений цикла образования мочевины. Самое распространенное среди них — недостаточность орнитин-карбамоилтрансферазы, наследственное Х-сцепленное заболевание. При тяжелом течении болезни новорожденные мальчики быстро умирают из-за отравления аммиаком. Но у некоторых мальчиков встречаются и легкие формы заболевания. У девочек-гетерозигот клинические проявления болезни варьируют широко: иногда болезнь протекает бессимптомно.
В 1990-х гг. все возлагали надежды, что генная терапия поможет вылечить недостаточность орнитин-карбамоилтрансферазы. Больным с легкими формами недостаточности вводили в печень соответствующий ген с использованием аденовирусного вектора. Однако у 17 больных перенос генов был выражен слабо, а когда 18-й больной умер от осложнений, клинические испытания были запрещены.
При недостаточности орнитин-карбамоилтрансферазы карбамоилфосфат накапливается в цитозоле клеток и превращается в оротовую кислоту. Эту реакцию катализирует аспар-таттранскарбамоилаза. Оротовая кислота обнаруживается в моче, и этот показатель используется в диагностике заболевания.
Креатин [ править | править код ]
Предшественником креатина является аргинин. Он реагирует с АТФ с образованием креатинфосфата. Креатин в форме креатинина выводится с мочой.
Тема 9.5. Орнитиновый цикл и его биологическая роль
Содержание мочевины в сыворотке крови в норме составляет 2,5-8,4 мМ/л (15-50 мг/дл).
Катаболизм аминокислот и образование аммиака происходит во многих тканях. Азот из тканей транспортируется в печень в составе трех соединений: глутамина, аланина и аммиака.
Молекула мочевины (карбамида, двойного амида угольной кислоты) содержит два атома азота:
• первая аминогруппа (ем. рис. 9.10) включается в цикл в виде аммиака, образующегося в митохондриях гепатоцитов при дезаминировании аминокислот или поступающего из крови. Реакцию катализирует митохондриальная карбамоилфосфатсинтетаза I (цитоплазматическая карбамоилфосфатсинтетаза II участвует в синтезе пиримидиновых нуклеотидов);
• вторая аминогруппа (см. рис. 9.10) вводится в молекулу мочевины из аспартата.
2. Аммиак, используемый карбамоилфосфатсинтетазой I, поставляется в печень, главным образом, из кишечника с кровью воротной вены.Роль других источников, в том числе окислительного дезаминирования глутамата и гидролиза глутамина в печени, существенно меньше.
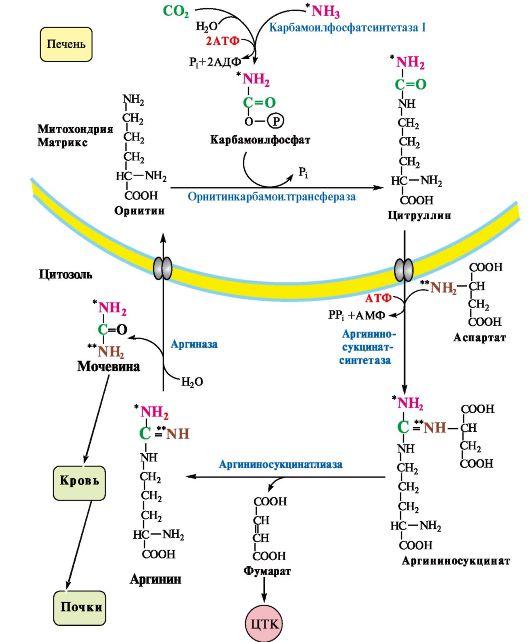
Ферменты орнитинового цикла локализованы в митохондриях и цитозоле гепатоцитов. В цикле происходит трансмембранный перенос цитруллина и орнитина. На схеме показаны пути включения двух атомов азота из разных аминокислот в молекулу мочевины:
— азот второй аминогруппы поставляется в составе аспартата в цитозоле (**N)
Аспартат, необходимый для синтеза аргининосукцината, образуется в печени:
• преимущественно с использованием аминогруппы аланина, который поступает из мышц и клеток кишечника (рис. 9.11);
• путем трансаминирования глутамата с оксалоацетатом. Образующийся в орнитиновом цикле фумарат включается в реакции
цитратного цикла и превращается в оксалоацетат, который путем трансаминирования снова образует аспартат (см. рис. 9.11). Таким образом, с орнитиновым циклом сопряжен цикл регенерации аспартата из фумарата. Пируват, образующийся в этом цикле, используется в ОПК или для глюконеогенеза.

3. В орнитиновом цикле расходуется энергия четырех макроэргических связей трех молекул АТФ на синтез одной молекулы мочевины. Затраты энергии происходят также при трансмембранном переносе компонентов цикла (цитруллина, орнитина, мочевины) (см. рис. 9.10). В почках перенос мочевины из крови в мочу происходит за счет градиента ионов натрия, создаваемого К, Na-АТФазой, которая потребляет АТФ.
Процесс синтеза мочевины имеет возможность компенсации энергозатрат (см. рис. 9.11):
• при регенерации аспартата из фумарата на стадии дегидрирования малата образуется NADH, который может обеспечить синтез трех молекул АТФ;
4. Орнитиновый цикл в печени выполняет две функции:
• превращение азота аминокислот в мочевину, которая экскретируется и помогает избежать накопления аммиака в организме;
• синтез аргинина и пополнение его фонда в организме.
Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Такой запас мощности необходим для предотвращения гипераммониемии при изменениях количества белка в пище.
5. Регуляторными реакциями являются синтез карбамоилфосфата, цитруллина и заключительная реакция, катализируемая аргиназой. Основным регуляторным фактором является содержание субстратов, прежде всего аммиака. Высокий уровень NH3 вызывает повышение уровня образования мочевины. Кроме того, скорость орнитинового цикла регулируется с помощью двух механизмов:
• аллостерическая активация карбамоилфосфатсинтетазы I N-ацетил- глутаматом (N-АГ);
• индукция синтеза ферментов карбамоилфосфатсинтетазы I, орнитинкарбамоилтрансферазы и аргиназы кортизолом.
N-ацетилглутамат является активатором карбамоилфосфатсинтетазы I. Образуется в матриксе митохондрий гепатоцитов из глутамата и ацетил-КоА специфической синтазой (рис. 9.12), которая активируется при повышении содержания аргинина в печени.
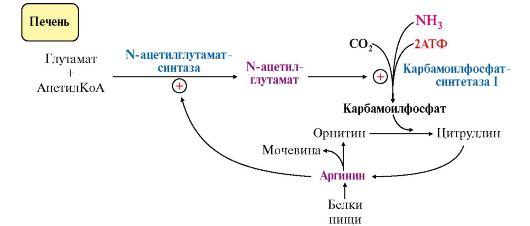
Индукция синтеза ферментов орнитинового цикла происходит в ответ на повышение скорости распада белков при голодании, длительной физической работе и при высокобелковой диете. В этих случаях углерод аминокислот превращается в глюкозу, а азот включается в молекулу мочевины. Индукция синтеза ферментов орнитинового цикла происходит параллельно с индукцией ферментов глюконеогенеза, АЛТ и глутаматдегидрогеназы. Заболевания, характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.), также сопровождаются активацией орнитинового цикла.
Ответы 61-80
61. Биосинтез мочевины. Связь орнитинового цикла с превращениями фумаровой и аспарагиновой кислот. Причины гипераммониемии. Уремия как следствие нарушения выведения мочевины из организма.
Биосинтез мочевины – основной путь обезвреживания аммиака. Мочевина синтезируется в орнитиновом цикле, протекающем в клетках печени. Эту последовательность реакций открыли Х.Кребс и К.Хензелейт в 1932 г. Согласно современным представлениям, цикл мочевины включает последовательность пяти реакций.
Две начальные реакции биосинтеза мочевины происходят в митохондриях клеток печени.
Последующие реакции протекают в цитоплазме клеток печени.
Общая схема орнитинового цикла представлена на рисунке 24.2:
Рисунок 24.2. Схема орнитинового цикла и его связь с превращениями фумаровой и аспарагиновой кислот.
Цифрами обозначены ферменты, катализирующие реакции орнитинового цикла: 1 – карбамоилфосфатсинтетаза; 2 – орнитин-карбамоилтрансфераза; 3 – аргининосукцинатсинтетаза; 4 – аргининосукцинатлиаза; 5 – аргиназа.
24.4.2. Орнитиновый цикл находится в тесной взаимосвязи с циклом трикарбоновых кислот:
Ацетил-КоА + Глутамат N-ацетилглутамат + КоА-SH
Концентрация ферментов орнитинового цикла зависит от содержания белка в пищевом рационе. При переходе на диету, богатую белком, в печени повышается синтез ферментов орнитинового цикла. При возвращении к сбалансированному рациону концентрация ферментов снижается. В условиях голодания, когда усиливается распад тканевых белков и использование аминокислот как энергетических субстратов, возрастает продукция аммиака, концентрация ферментов орнитинового цикла увеличивается.
24.4.4. Нарушения орнитинового цикла. Известны метаболические нарушения, обусловленные частичным блокированием каждого из 5 ферментов, катализирующих в печени реакции синтеза мочевины, а также N-ацетилглутаматсинтазы. Эти генетические дефекты, очевидно, являются частичными. Полное блокирование какой-либо из стадий цикла мочевины в печени, по-видимому, несовместимо с жизнью, потому что другого эффективного пути удаления аммиака не существует.
Общим признаком всех нарушений синтеза мочевины является повышенное содержание NH 4 + в крови (гипераммониемия). Наиболее тяжёлые клинические проявления наблюдаются при дефекте фермента карбамоилфосфатсинтетазы. Клиническими симптомами, общими для всех нарушений цикла мочевины, являются рвота, нарушение координации движений, раздражительность, сонливость и умственная отсталость. Если заболевание не диагностируется, то быстро наступает гибель. У детей старшего возраста проявлениями заболевания служат повышенная возбудимость, увеличение размеров печени и отвращение к пище с высоким содержанием белка.
Лабораторная диагностика заболеваний включает определение содержания аммиака и метаболитов орнитинового цикла в крови, моче и спинномозговой жидкости; в сложных случаях прибегают к биопсии печени.
Значительное улучшение наблюдается при ограничении белка в диете, при этом могут быть предотвращены многие нарушения мозговой деятельности. Малобелковая диета приводит к снижению содержания аммиака в крови и к улучшению клинической картины при мягких формах этих наследственных нарушений. Пищу следует принимать часто, небольшими порциями, для того чтобы избежать резкого повышения уровня аммиака в крови.
24.4.5. Клинико-диагностическое значение определения мочевины в крови и моче. В крови здорового человека содержание мочевины составляет 3,33 – 8,32 ммоль/л. За сутки с мочой выводится 20 – 35 г мочевины.
Изменения содержания мочевины в крови при заболеваниях зависят от соотношения процессов её образования в печени и выведения почками. Повышение содержания мочевины в крови (гиперазотемия) отмечается при почечной недостаточности, снижение – при недостаточности печени, при диете с низким содержанием белков.
Повышение экскреции мочевины с мочой наблюдается при употреблении пищи с высоким содержанием белков, при заболеваниях, сопровождающихся усилением катаболизма белков в тканях, при приёме некоторых лекарств (например, салицилатов). Снижение экскреции мочевины с мочой характерно для заболеваний и токсических поражений печени, заболеваний почек, сопровождающихся нарушением их фильтрационной способности.
62. Обмен глутамата и аспартата, роль в азотистом обмене, распад до конечных продуктов.
Аммиак, образующийся в тканях, сначала превращается в нетоксичное соединение и в таком виде переносится кровью к печени или почкам. Такими транспортными формами являются аминокислоты глутамин, аспарагин и аланин.
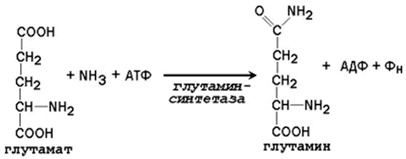
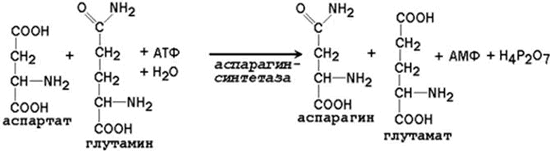
24.2.2. Образование глутамина и аспарагина из глутамата и аспартата соответственно происходит во многих тканях, включая головной мозг:
Образовавшийся глутамат переносит затем свою α-аминогруппу на пируват, всегда имеющийся в достаточном количестве, поскольку это продукт протекающего в мышцах гликолиза. Реакция катализируется аланинаминотрансферазой.
Глутамат + Пируват α-Кетоглутарат + Аланин
Аланин (нейтральная аминокислота, не несущая суммарного заряда при значениях рН, близких к 7) выходит из клеток и доставляется кровью к печени. Здесь он под действием аланинаминотрансферазы передаёт свою аминогруппу α-кетоглутарату, в результате чего образуется глутамат.
α-Кетоглутарат + Аланин Глутамат + Пируват
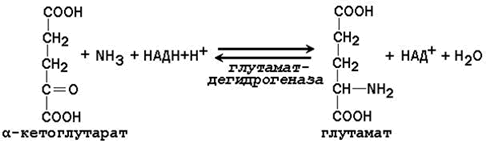
Далее в реакции, катализируемой глутаматдегидрогеназой, глутамат дезаминируется с образованием α-кетоглутарата и аммиака, который в печени превращается в мочевину.
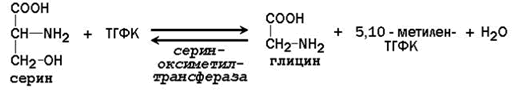
63. Роль серина и глицина в образовании одноуглеродных групп и их использование в биологических синтезах. Участие ТГФК в этих процессах.
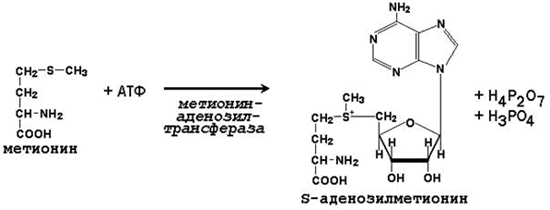
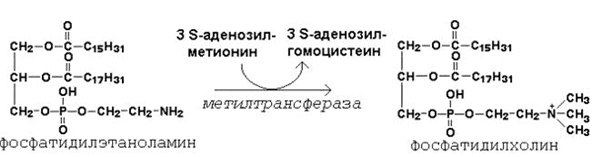
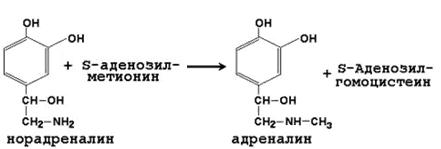
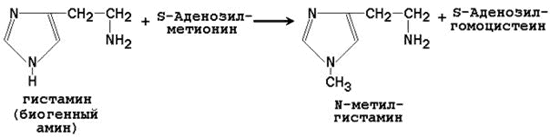
64. Метионин и S-аденозилметионин: строение, участие в процессах трансметилирования. Регенерация S-аденозилметионина из гомоцистеина..
| Субстрат | Метилированный продукт |
|---|---|
| Норадреналин | Адреналин |
| Адреналин | Метоксиадреналин |
| Гуанидинацетат | Креатин |
| Карнозин | Ансерин |
| Гистамин | N-метилгистамин |
| Фосфатидилэтаноламин | Фосфатидилхолин |
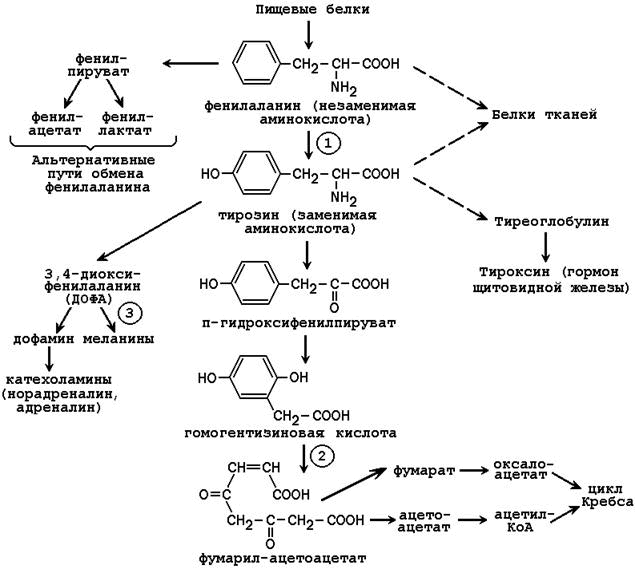
65. Обмен фенилаланина и тирозина. Использование тирозина для синтеза катехоламинов, тироксина, меланинов. Распад тирозина до конечных продуктов. Наследственные нарушения обмена фенилаланина и тирозина (фенилкетонурия, алкаптонурия, альбинизм).
66. Синтез гема и гемоглобина. Распад гемоглобина, обмен желчных пигментов. Нарушения обмена желчных пигментов. Значение определения желчных пигментов в диагностике желтух. Условно физиологическая желтуха новорожденных.
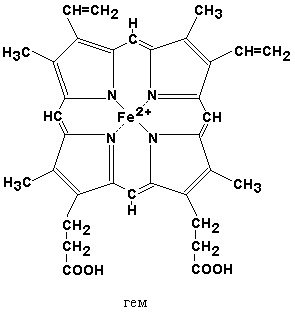
Хромопротеины относятся к сложным белкам. Молекулы хромопротеинов состоят из полипептидных цепей и небелковых компонентов (простетических групп), из которых наиболее распространённым является гем.
26.1.2. Гем в качестве простетической группы содержат следующие белки:
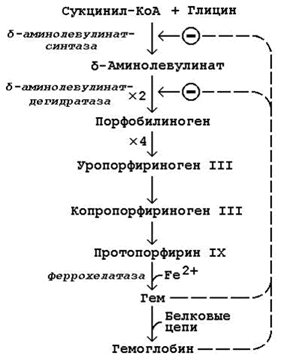
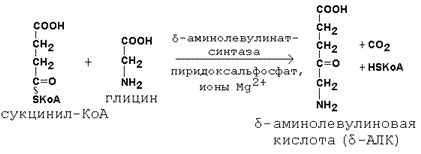
Схема биосинтеза гемоглобина представлена на рисунке 26.1. Исходными веществами в этом метаболическом пути являются аминокислота глицин и метаболит цикла Кребсасукцинил-КоА. Синтез происходит в ретикулоцитах (незрелых эритроцитах, содержащих клеточное ядро). Реакции идут в митохондриях и цитоплазме клеток.
Рисунок 26.1. Биосинтез гемоглобина и его регуляция.
Имеются данные о том, что некоторые лекарственные препараты, а также стероидные гормоны, напротив, индуцируют синтез печёночной δ-аминолевулинат-синтазы.
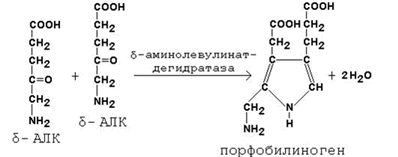
Во второй реакции, катализируемой δ-аминолевулинат-дегидратазой, при конденсации двух молекул δ-аминолевулината образуется порфобилиноген.
В дальнейшем из четырёх молекул порфобилиногена в результате ряда сложных ферментативных реакций образуется протопорфирин IX – непосредственный предшественник гема. При участии митохондриального фермента феррохелатазы двухвалентное железо включается в уже готовую структуру протопорфирина. Для протекания этой реакции необходимы аскорбиновая кислота и цистеин в качестве восстановителей. Ингибитором феррохелатазы является свинец. На заключительном этапе происходит соединение гема с белковыми цепями, характерными для синтезируемого хромопротеина. Конечные продукты этого биосинтеза (гем, гемоглобин) подавляют начальные реакции по механизму отрицательной обратной связи (рисунок 9).
При врождённых и приобретённых нарушениях биосинтеза гема развиваются заболевания – порфирии.
26.2.2. Порфирии – группа наследственных заболеваний, обусловленных частичным дефицитом одного из ферментов синтеза гема. Снижение образования гема приводит к снятию его ингибирующего эффекта на начальные этапы биосинтеза, результатом чего является избыточное образование порфиринов и их предшественников. Основными симптомами порфирий являются:
Порфиринурия может также развиваться при отравлениях свинцом.
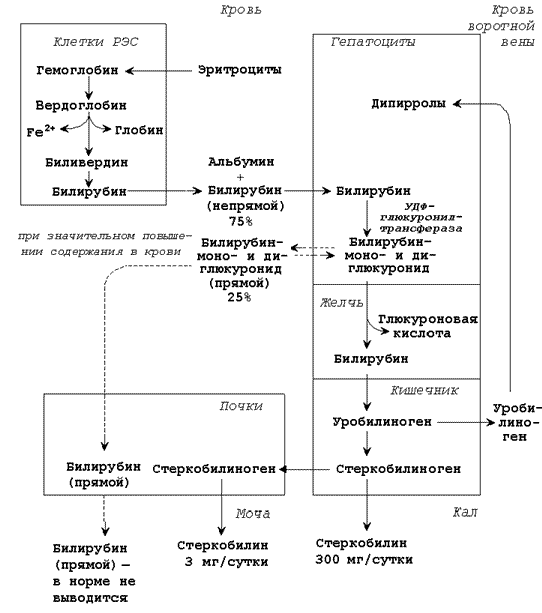
 | Билирубин (свободный или неконъюгированный билирубин) образуется в клетках ретикуло-эндотелиальной системы (РЭС), транспортируется в гепатоциты. Билирубин нерастворим в воде и растворим в жирах, токсичен, в крови присутствует в виде комплекса с альбумином, не проникает через почечный фильтр. Эта фракция билирубина в плазме крови называется непрямым билирубином, так как взаимодействует с диазореактивом только после осаждения альбуминов. |
 | Билирубиндиглюкуронид (связанный или конъюгированный билирубин) образуется в гепатоцитах под действием фермента билирубин-глюкуронилтрансферазы, путём активного транспорта выводится в желчные канальцы. Он хорошо растворим в воде и не растворим в жирах, малотоксичен, в крови не связан с белками плазмы, может проникать через почечный фильтр. Эта фракция билирубина в плазме крови называется прямым билирубином, так как непосредственно может взаимодействовать с диазореактивом. |
Общее содержание билирубина в крови здорового человека составляет 8 – 20 мкмоль/л, из них 6 – 15 мкмоль/л приходится на непрямой билирубин, 2 – 5 мкмоль/л – на прямой билирубин. Увеличение общего билирубина в крови (более 27 мкмоль/л) приводит к окрашиванию кожи, слизистых оболочек, склеры глаз в жёлтый цвет (желтуха). Определение содержания желчных пигментов в крови используют при выяснении происхождения желтух. Желтуха бывает надпечёночная (гемолитическая), печёночная (паренхиматозная), подпечёночная (обтурационная или механическая).
26.5.2. Надпечёночная (гемолитическая) желтуха вызвана массивным распадом эритроцитов в результате резус-конфликта, попадания в кровь веществ, вызывающих разрушение мембран эритроцитов и некоторых других заболеваниях. При этой форме желтухи в крови повышено содержание непрямого билирубина, в моче повышено содержание стеркобилина, билирубин отсутствует, в кале повышено содержание стеркобилина.
26.5.3. Печёночная (паренхиматозная) желтуха вызвана повреждением клеток печени при инфекциях и интоксикациях. При этой форме желтухи в крови повышено содержание непрямого и прямого билирубина, в моче повышено содержание уробилина, присутствует билирубин, в кале понижено содержание стеркобилина.
26.5.4. Подпечёночная (обтурационная) желтуха вызвана нарушением оттока желчи, например, при закупорке желчевыводящего протока камнем. При этой форме желтухи в крови повышено содержание прямого билирубина (иногда и непрямого), в моче отсутствует стеркобилин, присутствует билирубин, в кале понижено содержание стеркобилина.
26.5.5. Условно физиологическая желтуха новорождённых развивается у большинства здоровых новорождённых в первые дни после рождения и продолжается около двух недель. При различных заболеваниях, возникающих у новорождённых, а также у недоношенных детей желтушный период затягивается. Увеличение длительности гипербилирубинемии может привести к серьёзным последствиям: накоплению билирубина в ткани мозга (ядерная желтуха).
Повышению содержания билирубина в крови новорождённых могут способствовать следующие особенности обмена веществ в их организме:
67. Обмен железа. Суточная потребность, источники, всасывание, транспорт, депонирование, использование в организме, реутилизация железа.
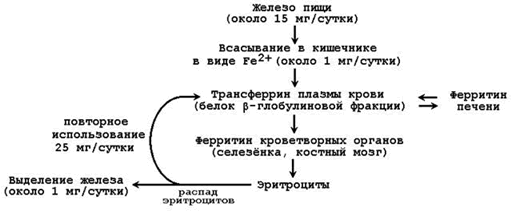
В организме человека содержится 4 – 6 г железа. Из этого количества 65-70% приходится на долю гемоглобина. Значительно меньше Fе находится в составе других гемсодержащих белков (миоглобин, цитохромы), а также металлопротеинов (ферритин, трансферрин). Поэтому обмен железа в организме определяется прежде всего синтезом и распадом гемоглобина эритроцитов. Недостаточное поступление железа в организм проявляется в первую очередь как анемия (железодефицитная). Общая схема обмена железа представлена на рисунке 26.2.
Рисунок 26.2. Обмен железа в организме.
26.3.2. В кишечнике всасывается лишь небольшая часть (около 1/10) имеющегося в пище железа. Транспортной формой железа в крови служит белок плазмы крови трансферрин. Другой белок, участвующий в метаболизме железа – ферритин – служит для депонирования железа, присутствует в большинстве тканей. Железо, освобождающееся при разрушении эритроцитов, может, как правило, повторно использоваться (реутилизироваться) для построения новых молекул хромопротеинов. Однако часть железа теряется организмом, главным образом, с желчью. Эти потери компенсируются поступлением железа с пищей.
68. Биосинтез пуриновых нуклеотидов. Происхождение атомов N и С пуринового кольца. Резервные пути биосинтеза пуриновых нуклеотидов. Распад пуриновых нуклеотидов. Особенности экскреции мочевой кислоты с мочой у детей раннего возраста. Нарушения обмена пуринов.
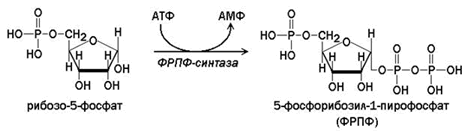
ФРПФ образуется при взаимодействии рибозо-5-фосфата и АТФ. Источниками рибозофосфата служат пентозофосфатный путь и распад нуклеотидов. Катализирует реакцию фермент ФРПФ-синтаза.
Внутриклеточная концентрация ФРПФ обычно низкая и строго регулируется. Скорость синтеза ФРПФ зависит от наличия субстратов синтеза, особенно рибозо-5-фосфата, и каталитической активности ФРПФ-синтазы, на которую влияют концентрация неорганического фосфата и концентрация АМФ, ГМФ и ИМФ, выступающих в качестве эффекторов.
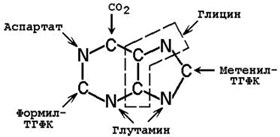
26.8.2. Молекула ФРПФ служит основой для последующего синтеза пуринового ядра. Источниками атомов углерода и азота являются аминокислоты глутамин, глицин и аспартат, СО 2 и два одноуглеродных производных ТГФК – формил-ТГФК и метенил-ТГФК (рисунок 26.7).
Рисунок 26.7. Происхождение атомов пуринового ядра.
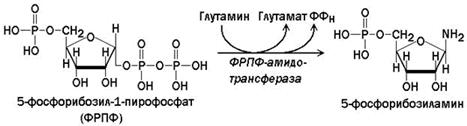
Сначала в реакции, катализируемой фосфорибозил-пирофосфат-амидотрансферазой, из ФРПФ при участии глутамина образуется 5-фосфорибозиламин.
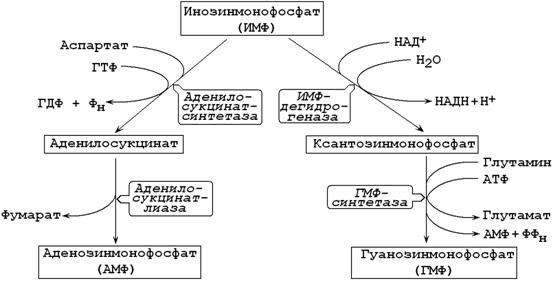
Далее к атому азота последовательно присоединяются все остальные компоненты пуринового ядра. Первым продуктом биосинтеза, содержащим готовую пуриновую структуру, является инозинмонофосфат (ИМФ). В его состав входит азотистое основание гипоксантин.
26.8.3. ИМФ является предшественником аденилового и гуанилового нуклеотидов (рисунок 26.5). В синтезе АМФ из ИМФ при взаимодействии аспартатом образуется аденилосукцинат. В следующей реакции отщепляется фумарат и образуется АМФ.
Рисунок 26.8. Образование АМФ и ГМФ из инозинмонофосфата.
Интересно отметить, что синтез АМФ требует участия ГТФ, а синтез ГМФ – участия АТФ. Эта особенность биосинтеза способствует поддержанию нужного соотношения адениловых и гуаниловых нуклеотидов в клетке.
26.8.4. Наряду с биосинтезом пуриновых нуклеотидов в клетке de novo существуют пути регенерации пуриновых нуклеотидов из свободных азотистых оснований, образующихся при гидролизе нуклеиновых кислот и нуклеотидов. Эти реакции проще, чем пути синтеза нуклеотидов de novo, и энергетическая цена их значительно меньше. Наибольшее значение имеет механизм фосфорибозилирования пуриновых оснований.
В клетках имеются 2 фермента, участвующих в реакциях синтеза нуклеотидов из пуриновых оснований.
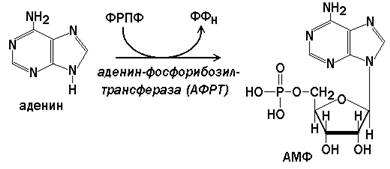
Аденин-фосфорибозилтрансфераза (АФРТ) катализирует перенос фосфорибозы с ФРПФ на аденин:
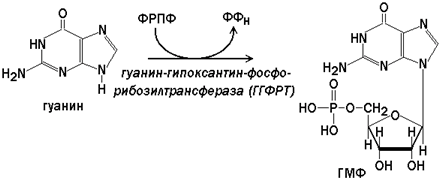
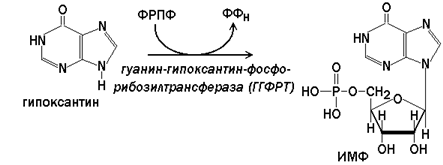
Гипоксантин-гуанин-фосфорибозилтрансфераза(ГГФРТ) катализирует перенос фосфорибозы с ФРПФ на гуанин или гипоксантин:
Реакции с участием второго фермента протекают более активно, чем синтез АМФ из аденина.
26.8.5. Нарушения обмена пуриновых нуклеотидов. При нарушениях пуринового обмена часто наблюдается гиперурикемия – повышение содержания мочевой кислоты в крови. Гиперурикемия может быть первичной или вторичной.
Первичная гиперурикемия является ведущим симптомом подагры – полиэтиологического заболевания, как правило, наследственной природы. Гиперурикемия при подагре обусловлена главным образом, избыточным образованием образованием мочевой кислоты, а также снижением её экскреции с мочой. Значительная и длительная гиперурикемия сопровождается отложением солей мочевой кислоты в хрящевой ткани, сухожилиях и слизистых сумках суставов. Накопление кристаллов уратов в тканях может вызывать резкую воспалительную реакцию (подагрический артрит), что приводит впоследствии к деформации сустава. Избыток мочевой кислоты способствует также образованию уратных камней в нижних отделах мочевыводящих путей.
Повышение уровня мочевой кислоты в крови отмечается также при наследственных дефектах некоторых ферментов:
Синдром Леша-Нихана (полное отсутствие ГГФРТ) наследуется как сцепленный с Х-хромосомой рецессивный признак. Болезнь характеризуется параличом, сопровождающимся судорогами, стремлением к членовредительству и тяжёлой гиперурикемией. Вследствие ферментативного дефекта нарушается переход гуанина и гипоксантина в ГМФ и ИМФ соответственно и указанные пуриновые основания превращаются в мочевую кислоту. Кроме того, повышенная концентрация ФРПФ способствует усилению синтеза пуринов de novo. Биохимическая основа неврологических отклонений при синдроме Леша-Нихана неизвестна.
Гликогеноз I типа или болезнь Гирке (дефицит глюкозо-6-фосфатазы) сопровождается повышением активности пентозофосфатного пути и приводит к повышению внутриклеточного уровня рибозо-5-фосфата, из которого синтезируется ФРПФ. Повышенный уровень ФРПФ приводит к увеличению синтеза пуринов de novo. Для данного заболевания характерен также лактатный ацидоз, приводящий к повышению порога секреции уратов почками; это способствует накоплению уратов в организме.
Вторичная гиперурикемия сопутствует заболеваниям, сопровождающимся усиленным распадом клеток (лейкозы, серповидно-клеточная анемия, сахарный диабет, псориаз).
Реже встречается гипоурикемия – снижение содержания мочевой кислоты в крови. Она может быть связана с понижением реабсорбции уратов из клубочкового фильтрата в почках. В этом случае наблюдается увеличение экскреции мочевой кислоты с мочой.
Гипоурикемия развивается и при недостаточности ксантиноксидазы, возникающей при генетическом дефекте фермента или при тяжёлом поражении печени. Это состояние сопровождается повышенной экскрецией гипоксантина и ксантина (ксантинурией), а также образованием в почках ксантиновых камней.
69. Регуляция метаболизма. Иерархия регуляторных систем. Значение эндокринной системы. Роль гормонов гипоталамуса и гипофиза.
Выучите определение понятия: гормоны – биологически активные соединения, выделяемые железами внутренней секреции в кровь или лимфу и оказывающие влияние на метаболизм клетки.
23.1.2. Запомните основные особенности действия гормонов на органы и ткани:
23.1.3. Гормоны осуществляют своё биологическое действие, образуя комплекс со специфическими молекулами – рецепторами. Клетки, содержащие рецепторы к определённому гормону, называются клетками-мишенями для этого гормона. Большинство гормонов взаимодействуют с рецепторами, расположенными на плазматической мембране клеток-мишеней; другие гормоны взаимодействуют с рецепторами, локализованными в цитоплазме и ядре клеток-мишеней. Имейте в виду, что дефицит как гормонов, так и их рецепторов может приводить к развитию заболеваний.
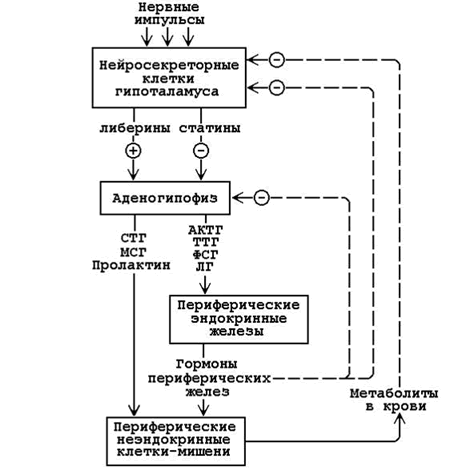
апомните, что в организме существует несколько уровней регуляции гомеостаза, которые тесно взаимосвязаны и функционируют как единая система (см. рисунок 23.1).
Рисунок 23.1. Иерархия регуляторных систем организма (пояснения в тексте).
23.2.2. 1. Сигналы из внешней и внутренней среды поступают в центральную нервную систему (высший уровень регуляции, осуществляет контроль в пределах целого организма). Эти сигналы трансформируются в нервные импульсы, попадающие на нейросекреторные клетки гипоталамуса. В гипоталамусе образуются:
Либерины и статины по системе портальных капилляров достигают гипофиза, где вырабатываются тропные гормоны. Тропные гормоны действуют на периферические ткани-мишени и стимулируют(знак “+”) образование и секрецию гормонов периферических эндокринных желёз. Гормоны периферических желёз угнетают (знак “–”) образование тропных гормонов, действуя на клетки гипофиза или нейросекреторные клетки гипоталамуса. Кроме того, гормоны, действуя на обмен веществ в тканях, вызывают изменения содержания метаболитов в крови, а те, в свою очередь, влияют (по механизму обратной связи) на секрецию гормонов в периферических железах (или непосредственно, или через гипофиз и гипоталамус).
2. Гипоталамус, гипофиз и периферические железы образуют средний уровень регуляции гомеостаза, обеспечивающий контроль нескольких метаболических путей в пределах одного органа, или ткани, или разных органов.
Гормоны эндокринных желёз могут влиять на обмен веществ:
3. Внутриклеточные механизмы регуляции представляют собой низший уровень регуляции. Сигналами для изменения состояния клетки служат вещества, образующиеся в самих клетках или поступающие в неё.
Как уже упоминалось, местом непосредственного взаимодействия высших отделов центральной нервной системы и эндокринной системы является гипоталамус. Это небольшой участок переднего мозга, который расположен непосредственно над гипофизом и связан с ним при помощи системы кровеносных сосудов, образующих портальную систему.
23.4.1. Гормоны гипоталамуса. В настоящее время известно, что нейросекреторные клетки гипоталамуса продуцируют 7 либеринов (соматолиберин, кортиколиберин, тиреолиберин, люлиберин, фоллиберин, пролактолиберин, меланолиберин) и 3 статина (соматостатин, пролактостатин, меланостатин). Все эти соединения являются пептидами.
Характеристика наиболее изученных либеринов и статинов приведена в таблице 23.2.
23.4.2. Гормоны аденогипофиза. Аденогипофиз (передняя доля гипофиза) продуцирует и выделяет в кровь ряд тропных гормонов, регулирующих функцию как эндокринных, так и неэндокринных органов. Все гормоны гипофиза являются белками или пептидами. Внутриклеточным посредником всех гипофизарных гормонов (кроме соматотропина и пролактина) служит циклический АМФ (цАМФ). Характеристика гормонов передней доли гипофиза приводится в таблице 3.
| Гормон | Ткань-мишень | Основные биологические эффекты | Регуляция секреции |
|---|---|---|---|
| Адренокортикотропный гормон (АКТГ) | Кора надпочечников | Стимулирует синтез и секрецию стероидов корой надпочечников | Стимулируется кортиколиберином |
| Тиреотропный гормон (ТТГ) | Щитовидная железа | Усиливает синтез и секрецию тиреоидных гормонов | Стимулируется тиреолиберином и подавляется тиреоидными гормонами |
| Соматотропный гормон (гормон роста, СТГ) | Все ткани | Стимулирует синтез РНК и белка, рост тканей, транспорт глюкозы и аминокислот в клетки, липолиз | Стимулируется соматолиберином, подавляется соматостатином |
| Фолликулостимулирующий гормон (ФСГ) | Семенные канальцы у мужчин, фолликулы яичников у женщин | У мужчин повышает образование спермы, у женщин – образование фолликулов | Стимулируется люлиберином |
| Лютеинизирующий гормон (ЛГ) | Интерстициальные клетки семенников (у мужчин) и яичников (у женщин) | Вызывает секрецию эстрогенов, прогестерона у женщин, усиливает синтез и секрецию андрогенов у мужчин | Стимулируется люлиберином |
| Пролактин | Молочные железы (альвеолярные клетки) | Стимулирует синтез белков молока и развитие молочных желёз | Подавляется пролактостатином |
| Меланоцитостимулирующий гормон (МСГ) | Пигментные клетки | Повышает синтез меланина в меланоцитах (вызывает потемнение кожи) | Подавляется меланостатином |
23.4.3. Гормоны нейрогипофиза. К гормонам, секретируемым в кровоток задней долей гипофиза, относятся окситоцин и вазопрессин. Оба гормона синтезируются в гипоталамусе в виде белков-предшественников и перемещаются по нервным волокнам в заднюю долю гипофиза.
Окситоцин – нонапептид, вызывающий сокращения гладкой мускулатуры матки. Он используется в акушерстве для стимуляции родовой деятельности и лактации.
Вазопрессин – нонапептид, выделяемый в ответ на повышение осмотического давления крови. Клетками-мишенями для вазопрессина являются клетки почечных канальцев и гладкомышечные клетки сосудов. Действие гормона опосредовано цАМФ. Вазопрессин вызывает сужение сосудов и повышение артериального давления, а также усиливает реабсорбцию воды в почечных канальцах, что приводит к снижению диуреза.
23.4.4. Основные виды нарушений гормональной функции гипофиза и гипоталамуса. При дефиците соматотропного гормона, возникающем в детском возрасте, развивается карликовость (низкий рост). При избытке соматотропного гормона, возникающем в детском возрасте, развивается гигантизм (аномально высокий рост).
При избытке соматотропного гормона, возникающем у взрослых (в результате опухоли гипофиза), развивается акромегалия – усиленный рост кистей рук, ступней, нижней челюсти, носа.
При недостатке вазопрессина, возникающем вследствие нейротропных инфекций, черепно-мозговых травм, опухолей гипоталамуса, развивается несахарный диабет. Основным симптомом этого заболевания является полиурия – резкое увеличение диуреза при пониженной (1,001 – 1,005) относительной плотности мочи.
70. Механизм действия дистантных гормонов. Роль мембраносвязанных ферментов в передаче внешнего сигнала внутрь клетки.
71. Циклический аденозинмонофосфат – строение, синтез, распад, роль в клетке. Факторы, влияющие на синтез и распад циклического аденозинмонофосфата.
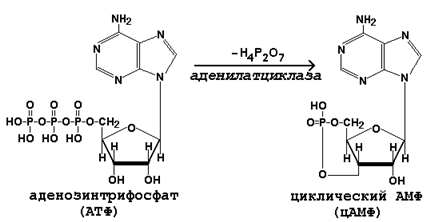
Гормоны дистантного действия. К гормонам дистантного действия относятся гидрофильные (растворимые в воде) гормоны – катехоламины и гормоны белково-пептидной природы. Так как эти вещества не растворимы в липидах, они не могут проникать через клеточные мембраны. Рецепторы для этих гормонов расположены на наружной поверхности плазматической мембраны клеток-мишеней. Гормоны дистантного действия реализуют своё действие на клетку при помощи вторичного посредника, в качестве которого чаще всего выступает циклический АМФ (цАМФ).
Циклический АМФ синтезируется из АТФ под действием аденилатциклазы:
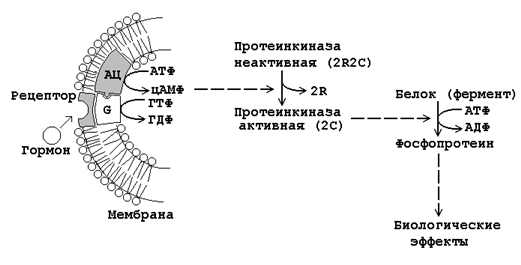
Механизм дистантного действия гормонов показан на рисунке 23.3.
Рисунок 23.3. Механизм влияния на клетку гормонов дистантного действия.
Взаимодействие гормона с его специфическим рецептором приводит к активации G-белка клеточной мембраны. G-белок связывает ГТФ и активирует аденилатциклазу.
Активная аденилатциклаза превращает АТФ в цАМФ, цАМФ активирует протеинкиназу.
Неактивная протеинкиназа представляет собой тетрамер, который состоит из двух регуляторных (R) и двух каталитических (C) субъединиц. В результате взаимодействия с цАМФ происходит диссоциация тетрамера и освобождается активный центр фермента.
Протеинкиназа фосфорилирует белки-ферменты за счёт АТФ, либо активируя их, либо инактивируя. В результате этого изменяется (в одних случаях – увеличивается, в других – уменьшается) скорость химических реакций в клетках-мишенях.
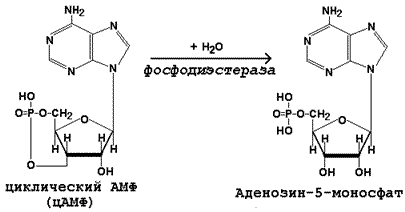
Инактивация цАМФ происходит при участии фермента фосфодиэстеразы:
Гормоны аденогипофиза. Аденогипофиз (передняя доля гипофиза) продуцирует и выделяет в кровь ряд тропных гормонов, регулирующих функцию как эндокринных, так и неэндокринных органов. Все гормоны гипофиза являются белками или пептидами. Внутриклеточным посредником всех гипофизарных гормонов (кроме соматотропина и пролактина) служит циклический АМФ (цАМФ). Характеристика гормонов передней доли гипофиза приводится в таблице 3.
| Гормон | Ткань-мишень | Основные биологические эффекты | Регуляция секреции |
|---|---|---|---|
| Адренокортикотропный гормон (АКТГ) | Кора надпочечников | Стимулирует синтез и секрецию стероидов корой надпочечников | Стимулируется кортиколиберином |
| Тиреотропный гормон (ТТГ) | Щитовидная железа | Усиливает синтез и секрецию тиреоидных гормонов | Стимулируется тиреолиберином и подавляется тиреоидными гормонами |
| Соматотропный гормон (гормон роста, СТГ) | Все ткани | Стимулирует синтез РНК и белка, рост тканей, транспорт глюкозы и аминокислот в клетки, липолиз | Стимулируется соматолиберином, подавляется соматостатином |
| Фолликулостимулирующий гормон (ФСГ) | Семенные канальцы у мужчин, фолликулы яичников у женщин | У мужчин повышает образование спермы, у женщин – образование фолликулов | Стимулируется люлиберином |
| Лютеинизирующий гормон (ЛГ) | Интерстициальные клетки семенников (у мужчин) и яичников (у женщин) | Вызывает секрецию эстрогенов, прогестерона у женщин, усиливает синтез и секрецию андрогенов у мужчин | Стимулируется люлиберином |
| Пролактин | Молочные железы (альвеолярные клетки) | Стимулирует синтез белков молока и развитие молочных желёз | Подавляется пролактостатином |
| Меланоцитостимулирующий гормон (МСГ) | Пигментные клетки | Повышает синтез меланина в меланоцитах (вызывает потемнение кожи) | Подавляется меланостатином |
73. Гормоны задней доли гипофиза: вазопрессин и окситоцин. Строение, механизм действия, биологическая роль. Последствия нарушения продукции вазопрессина.
Гормоны нейрогипофиза. К гормонам, секретируемым в кровоток задней долей гипофиза, относятся окситоцин и вазопрессин. Оба гормона синтезируются в гипоталамусе в виде белков-предшественников и перемещаются по нервным волокнам в заднюю долю гипофиза.
Окситоцин – нонапептид, вызывающий сокращения гладкой мускулатуры матки. Он используется в акушерстве для стимуляции родовой деятельности и лактации.
Вазопрессин – нонапептид, выделяемый в ответ на повышение осмотического давления крови. Клетками-мишенями для вазопрессина являются клетки почечных канальцев и гладкомышечные клетки сосудов. Действие гормона опосредовано цАМФ. Вазопрессин вызывает сужение сосудов и повышение артериального давления, а также усиливает реабсорбцию воды в почечных канальцах, что приводит к снижению диуреза.
23.4.4. Основные виды нарушений гормональной функции гипофиза и гипоталамуса. При дефиците соматотропного гормона, возникающем в детском возрасте, развивается карликовость (низкий рост). При избытке соматотропного гормона, возникающем в детском возрасте, развивается гигантизм (аномально высокий рост).
При избытке соматотропного гормона, возникающем у взрослых (в результате опухоли гипофиза), развивается акромегалия – усиленный рост кистей рук, ступней, нижней челюсти, носа.
При недостатке вазопрессина, возникающем вследствие нейротропных инфекций, черепно-мозговых травм, опухолей гипоталамуса, развивается несахарный диабет. Основным симптомом этого заболевания является полиурия – резкое увеличение диуреза при пониженной (1,001 – 1,005) относительной плотности мочи.
75. Изменения активности внутриклеточных ферментов под действием инсулина, влияние инсулина на обмен веществ.
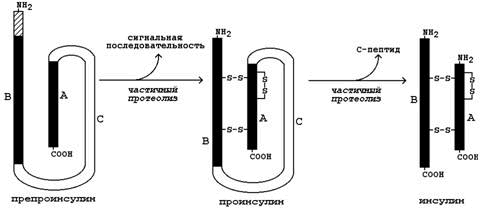
Инсулин. Инсулин – белково-пептидный гормон, вырабатываемый β-клетками островков Лангерганса. Молекула инсулина состоит из двух полипептидных цепей (А и В), содержащих 21 и 30 аминокислотных остатков соответственно; цепи инсулина связаны между собой двумя дисульфидными мостиками. Образуется инсулин из белка-предшественника (препроинсулина) путём частичного протеолиза (см. рисунок 4). После отщепления сигнальной последовательности образуется проинсулин. В результате ферментативного превращения удаляется фрагмент полипептидной цепи, содержащий около 30 аминокислотных остатков (С-пептид), и образуется инсулин.
Стимулом для секреции инсулина является гипергликемия – повышение содержания глюкозы в крови (например, после приёма пищи). Главные мишени для инсулина – клетки печени, мышц и жировой ткани. Механизм действия – дистантный.
Рисунок 4. Схема превращения препроинсулина в инсулин.
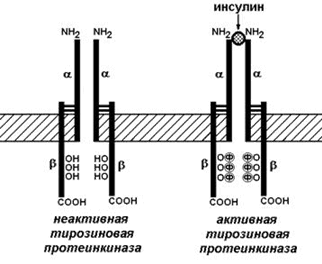
Рецептор инсулина представляет собой сложный белок – гликопротеин, расположенный на поверхности клетки-мишени. Этот белок состоит их двух α-субъединиц и двух β-субъединиц, связанных между собой дисульфидными мостиками. β-Субъединицы содержат несколько аминокислотных остатков тирозина. Рецептор инсулина обладает тирозинкиназной активностью, т.е. способен катализировать перенос остатков фосфорной кислоты от АТФ на ОН-группу тирозина (рисунок 5).
Рисунок 5. Инсулиновый рецептор.
В отсутствие инсулина рецептор не проявляет ферментативной активности. При связывании с инсулином рецептор подвергается аутофосфорилированию, т.е. β-субъединицы фосфорилируют друг друга. В результате изменяется конформация рецептора и он приобретает способность фосфорилировать другие внутриклеточные белки. В дальнейшем комплекс инсулина с рецептором погружается в цитоплазму и его компоненты расщепляются в лизосомах.
Образование гормон-рецепторного комплекса повышает проницаемость клеточных мембран для глюкозы и аминокислот. Под действием инсулина в клетках-мишенях:
а) снижается активность аденилатциклазы и увеличивается активность фосфодиэстеразы, что приводит к понижению концентрации цАМФ;
б) повышается скорость окисления глюкозы и снижается скорость глюконеогенеза;
в) увеличивается синтез гликогена и жиров и подавляется их мобилизация;
г) ускоряется синтез белка и тормозится его распад.
Все эти изменения направлены на ускоренное использование глюкозы, что приводит к снижению содержания глюкозы в крови. Инактивация инсулина происходит главным образом в печени и заключается в разрыве дисульфидных связей между цепями А и В.
Глюкагон. Глюкагон – полипептид, содержащий 29 аминокислотных остатков. Он продуцируется α-клетками островков Лангерганса в виде белка-предшественнника (проглюкагона). Частичный протеолиз прогормона и секреция глюкагона в кровь происходит при гипогликемии, вызванной голоданием.
Клетки-мишени для глюкагона – печень, жировая ткань, миокард. Механизм действия – дистантный (посредником является цАМФ).
Под действием глюкагона в клетках-мишенях:
а) ускоряется мобилизация гликогена в печени (см. рисунок 6) и тормозится его синтез;
б) ускоряется мобилизация жиров (липолиз) в жировой ткани и тормозится их синтез;
в) угнетается синтез белка и усиливается его катаболизм;
г) ускоряется глюконеогенез и кетогенез в печени.
Конечный эффект глюкагона – поддержание высокого уровня глюкозы в крови.
77. Биохимические изменения при сахарном диабете. Метаболические механизмы развития осложнений при сахарном диабете. Последствия длительной гипергликемии. Особенности сахарного диабета у детей.
1. Инсулинзависимый сахарный диабет
Провоцировать возникновение диабета I типа может вирусная инфекция, вызывающая деструкцию b-клеток. К таким вирусам, называемым β-цитотропными, относят вирусы оспы, краснухи, кори, цитомегаловирус, эпидемического паротита, Коксаки, аденовирус. Некоторые р-цитотропные вирусы вызывают лизис β-клеток.
Известны некоторые токсические вещества, например, такие как производные нитрозомочевины и другие нитро- или аминосодержащие соединения, избирательно поражающие β-клетки и индуцирующие аутоиммунную реакцию. Кроме того, ИЗСД может быть результатом частичного генетически обусловленного дефекта системы иммунологического надзора и сочетаться с другими аутоиммунными заболеваниями. На долю ИЗСД приходится примерно 25-30% всех случаев сахарного диабета. Как правило, разрушение β-клеток происходит медленно, и начало заболевания не сопровождается нарушениями метаболизма. Когда погибает 80-95% клеток, возникает абсолютный дефицит инсулина, и развиваются тяжёлые метаболические нарушения. ИЗСД поражает в большинстве случаев детей, подростков и молодых людей, но может проявиться в любом возрасте (начиная с годовалого).
2. Инсулинонезависимый сахарный диабет
Возможными причинами ИНСД могут быть: образование антител к рецепторам инсулина; генетический дефект пострецепторного аппарата инсулинзависимых тканей; нарушения регуляции секреции инсулина. К факторам, определяющим развитие и клиническое течение болезни, относят ожирение, неправильный режим питания, малоподвижный образ жизни, стресс.
Мутации генов, контролирующих секрецию инсулина, энергетический обмен в β-клетках и обмен глюкозы в клетках-мишенях инсулина, приводят к возникновению нескольких форм ИНСД с аутосомно-доминантным наследованием.
Основным провоцирующим фактором инсулинонезависимого диабета служит ожирение.
При сахарном диабете, как правило, соотношение инсулин/глюкагон снижено. При этом ослабевает стимуляция процессов депонирования гликогена и жиров, и усиливается мобилизация запасов энергоносителей. Печень, мышцы и жировая ткань даже после приёма пищи функционируют в режиме постабсорбтивного состояния.
1. Симптомы сахарного диабета
сахарного диабета. В этих случаях у людей отсутствуют жалобы и клинические симптомы, характерные для сахарного диабета, а концентрация глюкозы в крови натощак соответствует норме. Однако использование провокационных проб (например, сахарной нагрузки) выявляет снижение толерантности к глюкозе (рис. 11-30).
Повышение концентрации глюкозы в плазме крови обусловлено снижением скорости использования глюкозы тканями вследствие недостатка инсулина или снижения биологического действия инсулина в тканях-мишенях.
При дефиците инсулина уменьшается количество белков-переносчиков глюкозы (ГЛЮТ-4) на мембранах инсулинзависимых клеток (жировой ткани и мышц). В мышцах и печени глюкоза не депонируется в виде гликогена, в жировой ткани уменьшается скорость синтеза и депонирования жиров. Кроме того, при снижении инсулинглюкагонового индекса активируется глюконеогенез из аминокислот, глицерола и лактата. Повышение концентрации глюкозы в крови при сахарном диабете превышает концентрационный почечный порог, что становится причиной выделения глюкозы с мочой (глюкозурия). В норме проксимальные канальцы почек реабсорбируют всю фильтрующуюся в клубочках глюкозу, если её уровень не превышает 8,9 ммоль/л (160 мг/дл).
2. Острые осложнения сахарного диабета.
Механизмы развития диабетической комы
Коматозные состояния при сахарном диабете могут проявляться в трёх основных формах: кетоацидотической, гиперосмолярной и лакто-ацидотической. Для кетоацидотической комы характерны выраженный дефицит инсулина, кетоацидоз, полиурия, полидипсия. Гипергликемия (20-30 ммоль/л), обусловленная инсулиновой недостаточностью, сопровождается большими потерями жидкости и электролитов, дегидратацией и гиперосмоляльностью плазмы. Общая концентрация кетоновых тел достигает 100 мг/дл и выше.
При гиперосмолярной коме наблюдают чрезвычайно высокие уровни глюкозы в плазме крови, полиурию, полидипсию, всегда проявляется тяжёлая дегидратация. Предполагают, что у большинства больных гипергликемия обусловлена сопутствующим нарушением функции почек. Кетоновые тела в сыворотке крови обычно не определяются.
При лактоацидотической коме преобладают гипотония, снижение периферического кровообращения, гипоксия тканей, приводящая к смещению метаболизма в сторону анаэробного гликолиза, что обусловливает повышение концентрации молочной кислоты в крови (лакто-ацидоз).
Разные варианты диабетической комы в чистом виде практически не встречаются. Их возникновение может быть обусловлено разными факторами, например инфекционными заболеваниями, травмами, хирургическими вмешательствами, токсическими соединениями и др.
3. Поздние осложнения сахарного диабета
Рис. 11-31. Изменение метаболизма при сахарном диабете и причины диабетической комы.
и нарушению функций различных тканей и органов.
К медленно обменивающимся белкам относятся белки межклеточного матрикса, базальных мембран. Утолщение базальных мембран, одно из характерных осложнений сахарного диабета, приводит к развитию диабетических ангиопатий.
Причиной многих поздних осложнений сахарного диабета также служит повышение скорости превращения глюкозы в сорбитол (см. раздел 7).
Диабетические ангиопатий. Диабетические ангиопатий обусловлены прежде всего поражением базальных мембран сосудов. При высокой концентрации глюкозы в плазме крови протеогликаны, коллагены, гликопротеины гликозилируются, нарушается обмен и соотношение между компонентами базальных мембран, нарушается их структурная организация.
Нефропатия развивается примерно у трети больных сахарным диабетом. Электронно-микроскопические изменения базальной мембраны в почечных клубочках можно обнаружить уже на первом году после установления диагноза. Однако у большинства больных клинические признаки диабетической нефропатии проявляются через 10-15 лет существования диабета. Признаком ранних стадий нефропатии служит микроальбуминурия (в пределах 30-300 мг/сут), которая в дальнейшем развивается до классического нефротического синдрома, характеризующегося высокой протеинурией, гипоальбуминемией и отёками.
Ретинопатия, самое серьёзное осложнение сахарного диабета и наиболее частая причина слепоты, развивается у 60-80% больных сахарным
диабетом. На ранних стадиях развивается базальная ретинопатия, которая проявляется в кровоизлияниях в сетчатку, расширении сосудов сетчатки, отёках, Если изменения не затрагивают жёлтого пятна, потеря зрения обычно не происходит. В дальнейшем может развиться пролиферативная ретинопатия, проявляющаяся в новообразовании сосудов сетчатки и стекловидного тела. Ломкость и высокая проницаемость новообразованных сосудов определяют частые кровоизлияния в сетчатку или стекловидное тело. На месте тромбов развивается фиброз, приводящий к отслойке сетчатки и потере зрения.
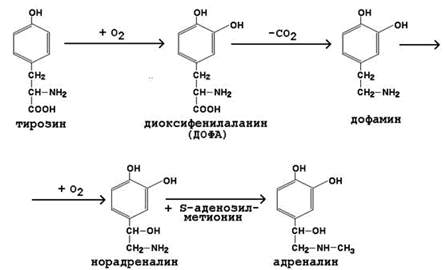
К гормонам мозгового вещества надпочечников относятся адреналин и норадреналин (катехоламины). Они синтезируются в хромаффинных клетках из тирозина (рисунок 7).
Рисунок 7. Схема синтеза катехоламинов.
Секреция адреналина усиливается при стрессе, физических нагрузках. Мишени для катехоламинов – клетки печени, мышечной и жировой ткани, сердечно-сосудистая система. Механизм действия – дистантный. Эффекты реализуются через аденилатциклазную систему и проявляются изменениями углеводного обмена. Подобно глюкагону, адреналин вызывает активацию мобилизации гликогена (см. рисунок 6) в мышцах и печени, липолиз в жировой ткани. Это приводит к увеличению содержания глюкозы, лактата и жирных кислот в крови. Адреналин усиливает также сердечную деятельность, вызывает сужение сосудов.
Обезвреживание адреналина происходит в печени. Основными путями обезвреживания являются: метилирование (фермент – катехол-орто-метилтрансфераза, КОМТ), окислительное дезаминирование (фермент – моноаминооксидаза, МАО) и конъюгация с глюкуроновой кислотой. Продукты обезвреживания выводятся с мочой.
79. Глюкокортикоиды – образование, механизм действия, биологическая роль, строение. Метаболические изменения при избытке глюкокортикоидов.
Запомните основные эффекты глюкокортикоидов:
а) в мышечной и лимфоидной тканях глюкокортикоиды ингибируют синтез белков и усиливают их распад. Это вызывает поступление большого количества свободных аминокислот в кровь;
б) в печени и почках глюкокортикоиды усиливают синтез многих белков, в том числе аминотрансфераз и ферментов глюконеогенеза. Это благоприятствует использованию свободных аминокислот для синтеза глюкозы. Синтезированная глюкоза поступает в кровь; частично она используется для синтеза гликогена в печени и мышцах;
в) глюкокортикоиды усиливают мобилизацию (расщепление) жиров в жировой ткани; образующийся глицерол поступает в печень и включается в глюконеогенез; жирные кислоты подвергаются окислению, продукты которого используются в синтезе кетоновых тел.
80. Минералокортикоиды – механизм действия, биологическая роль, строение. Метаболические изменения при избытке и недостатке минералокортикоидов.
29.2.3. Нарушения гормональной функции надпочечников. Основные проявления гипер- и гипофункции коры надпочечников представлены в таблице 4.