какую постоянную степень окисления имеет стронций
Стронций Sr
Стронций в таблице менделеева занимает 38 место, в 5 периоде.
| Символ | Sr |
| Номер | 38 |
| Атомный вес | 87.6200000 |
| Латинское название | Strontium |
| Русское название | Стронций |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема стронция
Sr: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2
Порядок заполнения оболочек атома стронция (Sr) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Стронций имеет 38 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
Степень окисления стронция
Атомы стронция в соединениях имеют степени окисления 2.
Ионы стронция
Валентность Sr
Атомы стронция в соединениях проявляют валентность II.
Валентность стронция характеризует способность атома Sr к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Sr
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Стронций Sr
Стронций в таблице менделеева занимает 38 место, в 5 периоде.
| Символ | Sr |
| Номер | 38 |
| Атомный вес | 87.6200000 |
| Латинское название | Strontium |
| Русское название | Стронций |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема стронция
Sr: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2
Порядок заполнения оболочек атома стронция (Sr) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Стронций имеет 38 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
Степень окисления стронция
Атомы стронция в соединениях имеют степени окисления 2.
Ионы стронция
Валентность Sr
Атомы стронция в соединениях проявляют валентность II.
Валентность стронция характеризует способность атома Sr к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Sr
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Стронций, свойства атома, химические и физические свойства
Стронций, свойства атома, химические и физические свойства.
87,62(1) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2
Стронций — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 38. Расположен во 2-й группе (по старой классификации — главной подгруппе второй группы), пятом периоде периодической системы.
Физические свойства стронция
Атом и молекула стронция. Формула стронция. Строение атома стронция:
Стронций – щёлочноземельный металл.
Стронций обозначается символом Sr.
Как простое вещество стронций при нормальных условиях представляет собой мягкий, ковкий и пластичный металл серебристо-белого цвета.
Молекула стронция одноатомна.
Химическая формула стронция Sr.
Строение атома стронция. Атом стронция состоит из положительно заряженного ядра (+38), вокруг которого по пяти оболочкам движутся 38 электронов. При этом 36 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку стронций расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и четвертая – внутренние оболочки представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома стронция на 5s-орбитали находятся два спаренных электрона. В свою очередь ядро атома стронция состоит из 38 протонов и 50 нейтронов. Стронций относится к элементам s-семейства.
Радиус атома стронция (вычисленный) составляет 219 пм.
Атомная масса атома стронция составляет 87,62(1) а. е. м.
Стронций обладает высокой химической активностью.
Изотопы и модификации стронция:
Свойства стронция (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Стронций |
| 102 | Прежнее название | |
| 103 | Латинское название | Strontium |
| 104 | Английское название | Strontium |
| 105 | Символ | Sr |
| 106 | Атомный номер (номер в таблице) | 38 |
| 107 | Тип | Металл |
| 108 | Группа | Щёлочноземельный металл |
| 109 | Открыт | Уильям Крюйкшенк и Адер Кроуфорд, Великобритания, 1787 г. |
| 110 | Год открытия | 1787 г. |
| 111 | Внешний вид и пр. | Мягкий, ковкий и пластичный серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
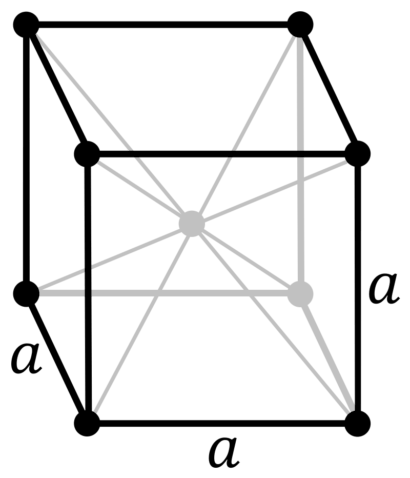
| 114 | Аллотропные модификации | 3 аллотропных модификации: – α-стронций с кубической гранецентрированной кристаллической решёткой, – β-стронций с гексагональной кристаллической решёткой, |
| 204 | Радиус атома (вычисленный) | 219 пм |
| 205 | Эмпирический радиус атома* | 200 пм |
| 206 | Ковалентный радиус* | 195 пм |
| 207 | Радиус иона (кристаллический) | Sr 2+ 2,375 г/см 3 (при температуре плавления 777 °C и иных стандартных условиях , состояние вещества – жидкость) |
| 402 | Температура плавления* | 777 °C (1050 K, 1431 °F) |
| 403 | Температура кипения* | 1377 °C (1650 K, 2511 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 7,43 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 141 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,31 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 26,4 Дж/(K·моль) |
| 411 | Молярный объём | 33,7 см³/моль |
| 412 | Теплопроводность | 35,4 Вт/(м·К) (при стандартных условиях ), 35,4 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-стронций |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 513 | Параметры решётки | 6,080 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 147 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 521 | Кристаллическая решётка #2 | β-стронций |
| 522 | Структура решётки | Гексагональная |
| 523 | Параметры решётки | a = 0,431 Å, c = 0,705 Å |
| 524 | Отношение c/a | 1,636 |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | |
| 527 | Номер пространственной группы симметрии | |
| 531 | Кристаллическая решётка #3 | γ-стронций |
| 532 | Структура решётки | Кубическая объёмно-центрированная |
| 533 | Параметры решётки | a = 0,485 Å |
| 534 | Отношение c/a | |
| 535 | Температура Дебая | |
| 536 | Название пространственной группы симметрии | Im_ 3m |
| 537 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-24-6 |
205* Эмпирический радиус атома стронция согласно [1] и [3] составляет 215 пм.
206* Ковалентный радиус стронция согласно [1] составляет 195±10 пм и 216 пм соответственно.
401* Плотность стронция согласно [3] и [4] составляет 2,54 г/см 3 (при 0 °C и иных стандартных условиях , состояние вещества – твердое тело) и 2,63 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) соответственно.
402* Температура плавления стронция согласно [3] и [4] составляет 768,85 °С (1042 K, 1415,93 °F) и 768 °С (1041,15 K, 1414,4 °F) соответственно.
403* Температура кипения стронция согласно [3] и [4] составляет 1383,85 °С (1657 K, 2522,93 °F) и 1390 °С (1663,15 K, 2534 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) стронция согласно [3] и [4] составляет 9,20 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) стронция согласно [3] и [4] составляет 144 кДж/моль и 141,4 кДж/моль соответственно.
410* Молярная теплоёмкость стронция согласно [3] составляет 26,79 Дж/(K·моль).
Стронций
Стронций / Strontium (Sr), 38
Стро́нций — элемент главной подгруппы второй группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 38. Обозначается символом Sr (лат. Strontium ). Простое вещество стронций (CAS-номер: 7440-24-6) — мягкий, ковкий и пластичный щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью, на воздухе быстро реагирует с влагой и кислородом, покрываясь жёлтой оксидной плёнкой.
Содержание
История и происхождение названия
Новый элемент обнаружили в минерале стронцианите, найденном в 1764 году в свинцовом руднике близ шотландской деревни Строншиан, давшей впоследствии название новому элементу. Присутствие в этом минерале оксида нового металла было установлено в 1787 году Уильямом Крюйкшенком и Адером Кроуфордом. Выделен в чистом виде сэром Хемфри Дэви в 1808 году.
Нахождение в природе
В свободном виде стронций не встречается. Он входит в состав около 40 минералов. Из них наиболее важный — целестин SrSO4 (51,2 % Sr). Добывают также стронцианит SrCO3 (64,4 % Sr). Эти два минерала имеют промышленное значение. Чаще всего стронций присутствует как примесь в различных кальциевых минералах.
Среди прочих минералов стронция:
В природе стронций встречается в виде смеси 4 стабильных изотопов 84 Sr (0,56 %), 86 Sr (9,86 %), 87 Sr (7,02 %), 88 Sr (82,56 %).
Месторождения
Получение
Существуют 3 способа получения металлического стронция:
Основным промышленным способом получения металлического стронция является термическое восстановление его оксида алюминием. Далее полученный стронций очищается возгонкой.
Электролитическое получение стронция электролизом расплава смеси SrCl2 и NaCl не получило широкого распространения из-за малого выхода по току и загрязнения стронция примесями.
При термическом разложении гидрида или нитрида стронция образуется мелкодисперсный стронций, склонный к легкому воспламенению.
Физические свойства
Стронций — мягкий серебристо-белый металл, обладает ковкостью и пластичностью, легко режется ножом.
Полиморфен — известны три его модификации. До 215 о С устойчива кубическая гранецентрированная модификация (α-Sr), между 215 и 605 о С — гексагональная (β-Sr), выше 605 о С — кубическая объемно-центрированная модификация (γ-Sr).
Температура плавления — 768 о С, Температура кипения — 1390 о С.
Химические свойства
Стронций в своих соединениях всегда проявляет валентность +2. По свойствам стронций близок к кальцию и барию, занимая промежуточное положение между ними.
В электрохимическом ряду напряжений стронций находится среди наиболее активных металлов (его нормальный электродный потенциал равен −2,89 В). Энергично реагирует с водой, образуя гидроксид:
Взаимодействует с кислотами, вытесняет тяжёлые металлы из их солей. С концентрированными кислотами (H2SO4, HNO3) реагирует слабо.
Металлический стронций быстро окисляется на воздухе, образуя желтоватую плёнку, в которой помимо оксида SrO всегда присутствуют пероксид SrO2 и нитрид Sr3N2. При нагревании на воздухе загорается, порошкообразный стронций на воздухе склонен к самовоспламенению.
Энергично реагирует с неметаллами — серой, фосфором, галогенами. Взаимодействует с водородом (выше 200 о С), азотом (выше 400 о С). Практически не реагирует с щелочами.
При высоких температурах реагирует с CO2, образуя карбид:
Применение
Основные области применения стронция и его химических соединений — это радиоэлектронная промышленность, пиротехника, металлургия, пищевая промышленность.
Металлургия
Стронций применяется для легирования меди и некоторых её сплавов, для введения в аккумуляторные свинцовые сплавы, для десульфурации чугуна, меди и сталей.
Металлотермия
Стронций чистотой 99,99—99,999 % применяется для восстановления урана.
Магнитные материалы
Магнитотвёрдые ферриты стронция широко употребляются в качестве материалов для производства постоянных магнитов.
Пиротехника
В пиротехнике применяются карбонат, нитрат, перхлорат стронция для окрашивания пламени в карминово-красный цвет. Сплав магний-стронций обладает сильнейшими пирофорными свойствами и находит применение в пиротехнике для зажигательных и сигнальных составов.
Атомноводородная энергетика
Уранат стронция играет важную роль при получении водорода (стронций-уранатный цикл, Лос-Аламос, США) термохимическим способом (атомно-водородная энергетика), и в частности разрабатываются способы непосредственного деления ядер урана в составе ураната стронция для получения тепла при разложении воды на водород и кислород.
Высокотемпературная сверхпроводимость
Оксид стронция применяется в качестве компонента сверхпроводящих керамик.
Вакуумные электронные приборы
Оксид стронция, в составе твёрдого раствора оксидов других щёлочноземельных металлов — бария и кальция (BaO, CaO), используется в качестве активного слоя катодов косвенного накала в вакуумных электронных приборах.
Химические источники тока
Фторид стронция используется в качестве компонента твердотельных фторионных аккумуляторных батарей с большой энергоемкостью и энергоплотностью.
Сплавы стронция с оловом и свинцом применяются для отливки токоотводов аккумуляторных батарей. Сплавы стронций-кадмий для анодов гальванических элементов.
Медицина
Биологическая роль
Влияние на организм человека
Стронций природный — составная часть микроорганизмов, растений и животных. Стронций является аналогом кальция, поэтому он наиболее эффективно откладывается в костной ткани. В мягких тканях задерживается менее 1 %. Стронций с большой скоростью накапливается в организме детей до четырёхлетнего возраста, когда идет активное формирование костной ткани. Обмен стронция изменяется при некоторых заболеваниях органов пищеварения и сердечно-сосудистой системы.
Влияние нерадиоактивного стронция проявляется крайне редко и только при воздействии других факторов (дефицит кальция и витамина Д, неполноценное питание, нарушения соотношения микроэлементов таких как барий, молибден, селен и др.). Тогда он может вызывать у детей «стронциевый рахит» и «уровскую болезнь» — поражение и деформация суставов, задержка роста и другие нарушения.
Радиоактивный стронций практически всегда негативно воздействует на организм человека. Откладываясь в костной ткани, он облучает костную ткань и костный мозг, что увеличивает риск заболевания раком костного мозга, а при поступлении большого количества может вызвать лучевую болезнь.
Изотопы
Стронций-90
Изотоп стронция 90 Sr является радиоактивным с периодом полураспада 28.9 лет. 90 Sr претерпевает β-распад, переходя в радиоактивный 90 Y (период полураспада 64 ч.) Полный распад стронция-90, попавшего в окружающую среду, произойдет лишь через несколько сотен лет. 90 Sr образуется при ядерных взрывах и внутри ядерного реактора во время его работы.
Применяется в производстве радиоизотопных источников тока в виде титаната стронция (плотность 4,8 г/см³, а энерговыделение около 0,54 Вт/см³).
Стронций
549,0 (5,69) кДж/моль (эВ)
Стронций — элемент главной подгруппы второй группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 38. Обозначается символом Sr (лат. Strontium). Простое вещество стронций (CAS-номер: 7440-24-6) — мягкий, ковкий и пластичный щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью, на воздухе быстро реагирует с влагой и кислородом, покрываясь жёлтой оксидной плёнкой.
Присутствие в природе
Содержание в земной коре — 0,384 % в свободном виде стронций не встречается. Он входит в состав около 40 минералов. Из них наиболее важный — целестин SrSO4. Добывают также стронцианит SrCO3. Эти два минерала имеют промышленное значение.
Стронций содержится в морской воде (0,1 мг/л), в почвах (0,035 масс%).
В природе стронций встречается в виде смеси 4 стабильных изотопов 84 Sr (0,56 %), 86 Sr (9,86 %), 87 Sr (7,02 %), 88 Sr (82,56 %).
Получение Стронция
Три способа получения металлического стронция:
— термическое разложение некоторых соединений
— электролиз
— восстановление оксида или хлорида
Основным промышленным способом получения металлического стронция является термическое восстановление его оксида алюминием. Далее полученный стронций очищается возгонкой.
Электролитическое получение стронция электролизом расплава смеси SrCl2 и NaCl не получило широкого распространения из-за малого выхода по току и загрязнения стронция примесями.
При термическом разложении гидрида или нитрида стронция образуется мелкодисперсный стронций, склонный к легкому воспламенению.
Физические свойства
Стронций — мягкий серебристо-белый металл, обладает ковкостью и пластичностью, легко режется ножом.
Полиморфен — известны три его модификации. До 215 о С устойчива кубическая гранецентрированная модификация (α-Sr), между 215 и 605 о С — гексагональная (β-Sr), выше 605 о С — кубическая объемно-центрированная модификация (γ-Sr).
Температура плавления — 768 о С, Температура кипения — 1390 о С.
Химические свойства
Стронций в своих соединениях всегда проявляет валентность +2. По свойствам стронций близок к кальцию и барию, занимая промежуточное положение между ними.
В электрохимическом ряду напряжений стронций находится среди наиболее активных металлов (его нормальный электродный потенциал равен −2,89 В. Энергично реагирует с водой, образуя гидроксид:
Взаимодействует с кислотами, вытесняет тяжелые металлы из их солей. С концентрированными кислотами (H2SO4, HNO3) реагирует слабо.
Металлический стронций быстро окисляется на воздухе, образуя желтоватую плёнку, в которой помимо оксида SrO всегда присутствуют пероксид SrO2 и нитрид Sr3N2. При нагревании на воздухе загорается, порошкообразный стронций на воздухе склонен к самовоспламенению.
Энергично реагирует с неметаллами — серой, фосфором, галогенами. Взаимодействует с водородом (выше 200 о С), азотом (выше 400 о С). Практически не реагирует с щелочами.
При высоких температурах реагирует с CO2, образуя карбид:
Применение
Основные области применения стронция и его химических соединений — это радиоэлектронная промышленность, пиротехника, металлургия, пищевая промышленность.
Металлургия
Стронций применяется для легирования меди и некоторых ее сплавов, для введения в аккумуляторные свинцовые сплавы, для обессеривания чугуна, меди и сталей.
Металлотермия
Стронций чистотой 99,99—99,999 % применяется для восстановления урана.
Магнитные материалы
Магнитотвердые ферриты стронция — широкоупотребительные материалы для производства постоянных магнитов.
Пиротехника
В пиротехнике применяются карбонат, нитрат, перхлорат стронция для окрашивания пламени в кирпично-красный цвет. Сплав магний-стронций обладает сильнейшими пирофорными свойствами и находит применение в пиротехнике для зажигательных и сигнальных составов.
Изотопы
Радиоактивный 90 Sr (период полураспада 28,9 лет) применяется в производстве радиоизотопных источников тока в виде титаната стронция (плотность 4,8 г/см³, а энерговыделение около 0,54 Вт/см³).
Атомноводородная энергетика
Уранат стронция играет важную роль при получении водорода (стронций-уранатный цикл, Лос-Аламос, США) термохимическим способом (атомно-водородная энергетика), и в частности разрабатываются способы непосредственного деления ядер урана в составе ураната стронция для получения тепла при разложении воды на водород и кислород.
Высокотемпературная сверхпроводимость
Оксид стронция применяется в качестве компонента сверхпроводящих керамик.
Химические источники тока
Фторид стронция используется в качестве компонента твердотельных фторионных аккумуляторных батарей с громадной энергоемкостью и энергоплотностью.
Сплавы стронция с оловом и свинцом применяются для отливки токоотводов аккумуляторных батарей. Сплавы стронций-кадмий для анодов гальванических элементов.
Биологическая роль
Влияние на организм человека
Не следует путать действие на организм человека природного (нерадиоактивного, малотоксичного и более того, широко используемого для лечения остеопороза) и радиоактивных изотопов стронция. Изотоп стронция 90 Sr является радиоактивным с периодом полураспада 28.9 лет. 90 Sr претерпевает β-распад, переходя в радиоактивный 90 Y (период полураспада 64 ч.) Полный распад стронция-90, попавшего в окружающую среду, произойдет лишь через несколько сотен лет. 90 Sr образуется при ядерных взрывах и выбросах с АЭС. По химическим реакциям радиоактивный и нерадиоактивные изотопы стронция практически не отличаются. Стронций природный — составная часть микроорганизмов, растений и животных. Независимо от пути и ритма поступления в организм растворимые соединения стронция накапливаются в скелете. В мягких тканях задерживается менее 1 %. Путь поступления влияет на величину отложения стронция в скелете. На поведение стронция в организме оказывает влияние вид, пол, возраст, а также беременность, и другие факторы. Например, в скелете мужчин отложения выше, чем в скелете женщин. Стронций является аналогом кальция. Стронций с большой скоростью накапливается в организме детей до четырехлетнего возраста, когда идет активное формирование костной ткани. Обмен стронция изменяется при некоторых заболеваниях органов пищеварения и сердечно-сосудистой системы. Пути попадания:
Влияние нерадиоактивного стронция проявляется крайне редко и только при воздействии других факторов (дефицит кальция и витамина Д, неполноценное питание, нарушения соотношения микроэлементов таких как барий, молибден, селен и др.). Тогда он может вызывать у детей «стронциевый рахит» и «уровскую болезнь» — поражение и деформация суставов, задержка роста и другие нарушения Напротив, радиоактивный стронций практически всегда негативно воздействует на организм человека:
Изотопы
Стронций-90
Изотоп стронция 90 Sr является радиоактивным с периодом полураспада 28,79 лет. 90 Sr претерпевает β-распад, переходя в радиоактивный иттрий 90 Y (период полураспада 64 часа). 90 Sr образуется при ядерных взрывах и выбросах с АЭС.
Стронций является аналогом кальция и способен прочно откладываться в костях. Длительное радиационное воздействие 90 Sr и 90 Y поражает костную ткань и костный мозг, что приводит к развитию лучевой болезни, опухолей кроветворной ткани и костей.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда