какую функцию выполняет рецептор
Какую функцию выполняет рецептор
• Рецепторы содержат домен, связывающий лиганд и эффекторный домен
• Модульный принцип организации рецептора позволяет использовать для самых разнообразных сигналов ограниченное число регуляторных механизмов
• Клетка может экспрессировать различные рецепторы для одного и того же лиганда
• В зависимости от эффекторного домена рецептора, один и тот же лиганд может по-разному действовать на клетку
Рецепторы обеспечивают реакцию клетки на огромное количество внеклеточных информационных молекул; поэтому клетка должна экспрессировать много разнообразных рецепторов, каждый из которых способен связываться со своим лигандом.
Вместе с тем, каждый рецептор должен быть способен инициировать ответную реакцию клетки. Таким образом, рецепторы содержат два функциональных домена: домен, связывающий лиганд, и эффекторный домен. Иногда они соответствуют определенным структурным доменам в молекулах белков.
Разделение связывающей и эффекторной функций позволяет рецепторам различных лигандов, посредством нескольких эффекторных доменов, генерировать ограниченное число эволюционно-консервативных внутриклеточных сигналов.
Фактически существует лишь ограниченное число семейств рецепторов, близких друг к другу по своему строению и сигнальным функциям.
Доменная природа рецепторов обеспечивает их другие полезные характеристики. Например, клетка может регулировать свою способность реагировать на внешний сигнал, изменяя интенсивность синтеза, деградацию рецептора, или его активность.
Наряду с этим, природа клеточного ответа обычно определяется рецептором и его эффекторным доменом, а не физико-химическими свойствами лиганда. Рисунок ниже иллюстрирует положение, согласно которому лиганд может связываться более чем с одним типом рецепторов и обеспечивать несколько типов ответа клетки и несколько разных лигандов могут действовать одинаковым образом, связываясь с функционально-близкими рецепторами.
Например, нейромедиатор ацетилхолин связывается с двумя классами рецепторов. К одному классу относятся ионные каналы, представители другого регулируют G-белки. Аналогичным образом стероидные гормоны связываются с ядерными рецепторами, которые ассоциируют с хроматином и регулируют транскрипцию, и с другими рецепторами на плазматической мембране.
Наоборот, когда множество лигандов связывается с рецепторами одного биохимического класса, они генерируют аналогичный клеточный ответ.
Например, достаточно часто клетка экспрессирует несколько разных рецепторов, стимулирующих образование внутриклеточных сигнальных молекул цАМФ.
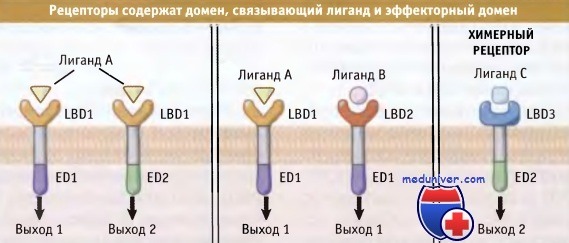
Такая структура предполагает, что два рецептора, реагирующие с разными лигандами (в середине),
могут инициировать одинаковый ответ за счет активации сходных эффекторных доменов.
Возможно также, что клетка экспрессирует две изоформы рецептора (слева),
которые узнают один и тот же лиганд и обеспечивают развитие различных ответных реакций за счет различных эффекторных доменов.
Не исключено, что может образоваться искусственный химерный рецептор, обладающий новыми свойствами.
Влияние рецептора на клетку также будет в существенной степени зависеть от ее биологии и состояния в каждый данный момент времени.
В зависимости от специфики внешнего сигнала, домен связывания лиганда и эффекторный домен могут разобщаться. Например, родопсины млекопитающих и беспозвоночных передают сигналы через различные эффекторные G-белки (G1 и Gq соответственно).
Другим примером служит калмодулин, небольшой регуляторный белок млекопитающих, связывающий кальций. У растений он представлен отдельным доменом в составе больших белков.
Двухдоменная природа рецепторов позволяет клетке независимо регулировать связывание лиганда и ответ на него. Сродство лиганда к рецептору и/или способность связанного лиганда генерировать сигнал может измениться за счет его ковалентной модификации или при аллостерической регуляции.
Рецепторы можно классифицировать в зависимости или от природы связываемого ими лиганда, или характера генерируемого сигнала. Сигнал на выходе, который определяется эффекторным доменом, обычно лучше всего коррелирует с общим характером и последовательностью событий его передачи.
Однако особенно ценной для понимания организации эндокринной и нервной системы и для классификации многочисленных физиологических реакций, связанных с применением лекарств, оказывается фармакологическая классификация рецепторов в соответствии с их специфичностью к лигандам.
Экспрессии рецептора, который обычно в клетке отсутствует, часто оказывается достаточно для того, чтобы она приобрела чувствительность к соответствующему лиганду. Такая чувствительность развивается часто, и клетка экспрессирует другие компоненты, необходимые для дальнейшей передачи сигнала от рецептора.
Природа ответной реации клетки определяется ее биологией. В эксперименте реакцию клетки на то или иное соединение можно индуцировать с помощью кДНК, кодирующей рецептор. Например, рецепторы клеток млекопитающих могут экспрессироваться в дрожжах, и последние приобретают чувствительность к соответствующим лигандам.
Таким образом, пользуясь этой моделью, можно обнаруживать новые химические соединения (лекарственные средства), активирующие рецепторы.
Наконец, можно создавать химерные рецепторы путем слияния домена, связывающего лиганд от одного рецептора, с эффекторным доменом другого. Подобные химерные рецепторы при присоединении лиганда могут обеспечивать принципиально новый характер ответа.
За счет генетической модификации домена, связывающего лиганд, можно создать рецепторы, чувствительные к новым лигандам. Таким образом, исследователи могут управлять функциями клетки и ее чувствительностью к совершенно чужеродным химическим соединениям.
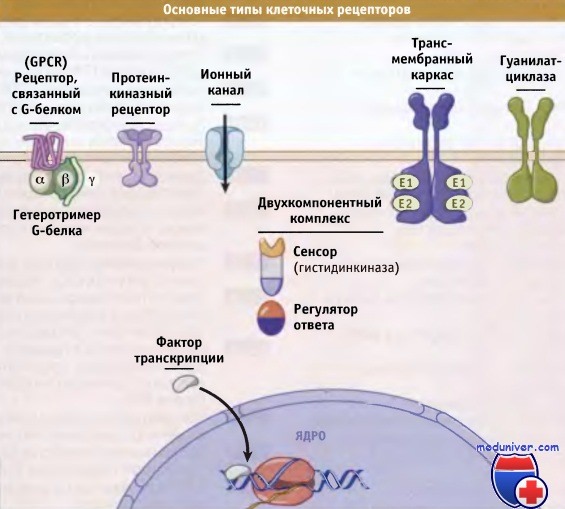
которые характеризуются общими механизмами действия и общностью структуры.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Какую функцию выполняет рецептор
Цитоархитектоника головного мозга человека организована таким образом, что более чем 10 млрд. нервных клеток, занимая относительно небольшое пространство и будучи сформированными в специализированные структуры, обеспечивают специфические функции мозга, связанные с восприятием, переработкой и проведением информации, в соответствии с которой осуществляется взаимодействие организма с внешней средой на основе высокой нейрональной специфичности и пластичности.
Основной структурной единицей нервной системы является нейрон. Различные типы нейронов дифференцируются по величине и форме тела клетки, а также по длине и степени ветвистости ее отростков.
Клеточное тело по своим размерам варьирует очень широко — от 5 до 100 мкм в диаметре. Оно содержит следующие органеллы: ядро, митохондрии, эндоплазматический ретикулум (гладкий и шероховатый), расположенные на цистернах эндоплазматического ретикулума и в свободном пространстве рибосомы и полисомы, комплекс Гольджи и различные внутриклеточные включения (гранулы гликогена, липидные капли, скопления частиц пигмента в особых нейронах и др.), везикулы, а также лизосомы. Группы параллельно расположенных цистерн шероховатого эндоплазматического ретикулума в виде ограниченных мембраной удлиненных цистерн с прикрепленными к ним рибосомами образуют субстанцию (тельца) Ниссля (тигроидное вещество). В цитоплазме имеются также нейрофиламенты и нейротрубочки (рис. 3).
Все перечисленные ультраструктурные органеллы клетки несут определенные функции. Ядро является субстратом основных генетических процессов в клетке. Митохондрии обеспечивают энергетический обмен — в них происходит окислительное фосфорилирование, приводящее к продукции энергии в виде молекул АТФ. Эндоплазматический ретикулум с прикрепленными на его цистернах рибосомами, а также свободно расположенные рибосомы и их комплексы (полисомы) имеют отношение к белковому обмену и синтетическим процессам в клетке. Лизосомам приписывается обменно-выделительная роль. Нейротрубочки и нейрофиламенты обеспечивают транспорт внутриклеточных веществ, имеющих отношение к проведению нервного импульса. Долгое время считали, что комплекс Гольджи, состоящий из параллельно расположенных цистерн и скоплений пузырьков на их концах, выполняет неопределенные обменно-выделительные функции. Хотя об этом комплексе известно далеко не все, привлекают к себе накопленные многими исследователями данные, свидетельствующие о том, что он играет главную роль в процессах обновления клеточной мембраны и ее генетически обусловленной специализации. Известно, что в комплексе Гольджи может происходить первичная сборка специализированных участков мембраны (рецепторов), которые в виде пузырьков транспортируются к наружной клеточной оболочке и встраиваются в нее. Такие исследования были обобщены А.А.Милохиным (1983).
От тела нейрона отходят основной отросток — аксон и многочисленные ветвящиеся отростки — дендриты. Длина аксонов различных нейронов колеблется от 1 мм до почти 1 м (нервное волокно). Вблизи окончания аксон разделяется на терминали, на которых расположены синапсы, контактирующие с телом и дендритами других нейронов. Синапсы вместе с нейрофиламентами и нейротрубочками являются субстратом проведения нервного импульса.
Рис. 3. Основные ультраструктурные компоненты нейрона.
Л — лизосомы; ШЭР — шероховатый эндоплазматический ретикулум (цистерны с прикрепленными рибосомами); М — митохондрии; НФ — нейрофиламенты; НТ — нейротрубочки; P — рибосомы; П — полисомы (комплексы рибосом); КГ — комплекс Гольджи; Я — ядро; ЦЭР — цистерны эндоплазматического ретикулума; ЛГ — липидные гранулы; ЛФ — липофусцин.
Кроме нейронов, в ткани мозга имеются различные виды глиальных клеток — астроглия, олигодендроглия, микроглия. Астроглия играет большую роль в обеспечении функции нейрона и формировании реакции мозговой ткани на вредоносные воздействия (инфекция, интоксикация и др.) — принимает участие в воспалительных процессах и ликвидации их последствий (заместительный глиоз). Олигодендроглия, как известно, обеспечивает миелинизацию нервного волокна и регулирует водный обмен (дренажная глия). Функции микроглии не до конца изучены, но ее значение подчеркивается размножением этих клеток при некоторых специфических процессах (участие в формировании сенильных бляшек; существует предположение о выработке микроглиальными клетками амилоидных фибрилл и т.п.).
Особые клеточные структуры характерны для желудочковых поверхностей головного мозга и его сосудистого сплетения. Желудочковая поверхность мозга покрыта клетками эпендимы с многочисленными микроворсинками и ресничками, принимающими участие в ликворообращении; сосудистое сплетение представлено «гроздьями» ворсинок, состоящих из капилляров, покрытых эпителиальными клетками. Их основная функция связана с обменом веществ между кровью и цереброспинальной жидкостью.
Типичный синапс состоит из пресинаптической терминали, постсинаптической области и расположенной между ними синаптической щели. Пресинаптическая терминаль является окончанием аксона. Она содержит нейрофиламенты, нейротрубочки, митохондрии и синаптические пузырьки, скопления которых видны около пресинаптической мембраны. Через последнюю переносятся содержащиеся в пузырьках нейротрансмиттеры. Постсинапс характеризуется наличием постсинаптического утолщения. Постсинаптическое утолщение представлено мембраной клетки с расположенными на ней рецепторами, входящими в структуру самой мембраны. Синапс представлен на рис. 4, а его электронно-микроскопическая картина на рис. 5.
Синапс может быть расположен на теле (соме) клетки — аксосоматический синапс, на дендрите — аксодендритный, на шипике дендрита — аксошипиковый (рис. 6) и на аксоне другой клетки — аксо-аксональный. Аксошипиковые синапсы несколько отличаются по своему строению от типичного синапса, что определяется строением шипика, имеющего в составе постсинапса особый шипиковый аппарат.
Взаимодействие пресинапса и постсинапса обеспечивается благодаря переносу нейротрансмиттера через синаптическую щель. Выделяясь из пресинапса, нейротрансмиттер (медиатор) может связываться с рецептором постсинаптической мембраны, инактивироваться в синаптической щели и частично вновь захватываться пресинаптической мембраной (процесс обратного захвата — reuptake ). Если рецептор постсинаптической мембраны заблокирован, то возможны оба последних процесса, а также избыточное накопление медиатора и связанное с этим развитие гиперчувствительности рецепторов (см. рис. 4).
Более подробно эти процессы рассматриваются в разделе «Нейрохимические системы мозга».
Рецепторы нейронов — это белковые структуры, расположенные на внешней поверхности мембраны клеток. Они способны «распознавать» и связывать биологически активные вещества — нейротрансмиттеры, различные эндогенные вещества, а также экзогенные соединения, в том числе психофармакологические средства. Соединения, которые могут связывать рецепторы, называются лигандами. Лиганды бывают эндогенными и экзогенными.
Распознавание лиганда рецептором обеспечивается специальными структурными элементами, или сайтами. Специфичность связывания лиганда происходит благодаря структурному соответствию молекул лиганда и рецептора, когда они подходят друг к другу по типу «ключ к замку». Реакция связывания является моментом запуска каскада внутриклеточных реакций, приводящих к изменению функционального состояния нейрона. В зависимости от «силы» и «прочности» связывания лиганда с рецептором употребляют понятие аффинности (сродства) лиганда по отношению к рецептору.
При связывании рецептора с лигандом может происходить как активация, так и блокада рецептора. В связи с этим говорят об агонистах и антагонистах рецепторов, а также о частичных агонистах (рис. 7).
Максимальную эффективность в отношении активации рецептора имеет полный агонист, минимальную (практически нулевую) — антагонист. Между ними находятся вещества, называемые частичными агонистами. Последние действуют значительно мягче, чем полные агонисты. Частичные агонисты, кроме того, занимая определенное пространственное положение в молекуле рецептора, могут предотвращать избыточное действие полного агониста, т.е. действуют частично как антагонисты. В этом случае употребляют понятие агонист/антагонист.
Высокой аффинностью могут обладать как агонисты, так и антагонисты рецептора. Агонист активирует рецептор, вызывая соответствующий физиологический эффект, в то время как антагонист, связываясь с рецептором, блокирует его и предотвращает развитие физиологического эффекта, выявляемого агонистами. Примером антагонистов могут служить нейролептики, которые предотвращают эффекты дофамина на уровне дофаминового рецептора.
При связывании лиганда с рецептором происходит изменение конфигурации последнего (рис. 7).
Многие вещества, как эндогенные, так и экзогенные, реагируют не с одним, а с несколькими типами рецепторов — «семейством» их, которое подразделяется на отдельные типы. Примером могут служить многие нейротрансмиттеры, реагирующие с несколькими типами специфических рецепторов (например, Д1—Д5-типы дофаминовых рецепторов). Существование нескольких рецепторов к одному лиганду носит название гетерогенности рецепторов.
Представление о функции рецепторов было бы неполным, если не представить внутриклеточные процессы, развивающиеся после связывания рецептора соответствующим веществом, и механизмы, обеспечивающие трансформацию внешнего сигнала в процессы, приводящие к появлению нервного импульса. Связывание лиганда с рецептором может приводить либо непосредственно к открытию (или закрытию) соответствующих ионных каналов (см. рис. 7), либо к активации вторичных мессенджерных систем (в качестве первичного мессенджера рассматривается вещество, реагирующее с рецептором).
Позднее были открыты и другие вторичные мессенджеры. Сейчас выделяют среди них 3 класса: 1) циклические нуклеотиды (цАМФ, циклический гуанозинмонофосфат — цГМФ); 2) ионы кальция (Са 2+ ); 3) метаболиты фосфолипидов — инозитол-1,4,5-трифосфат (1Р 3 ), диглицерин (ДАГ), арахидоновую кислоту. В отличие от других вторичных мессенджеров Са 2+ транспортируется в нейрон из внутриклеточного пространства.
5-HT1А рецептор: роль в регуляции различных видов поведения
Полный текст:
Аннотация
Нейромедиатор мозга серотонин регулирует различные формы как нормального, так и патологического поведения, действуя на 14 типов серотониновых (5-НТ) рецепторов. Все 5-НТ рецепторы, за исключением 5-НТ3, представляющего ионный канал (ионотропный рецептор), принадлежат к суперсемейству метаботропных рецепторов, сопряженных с G- белками. Каждый из типов и подтипов рецепторов характеризуется уникальным контролирующим геном, спектром сродства к разнообразным агонистам и антагонистам серотонина, специфическим распределением в мозге и рядом регулируемых функций. Среди этого многообразия 5-НТ рецепторов особый интерес вызывает эволюционно наиболее древний 5-НТ1А рецептор, играющий ключевую роль в ауторегуляции серотониновой системы мозга. Эта роль 5-НТ1А рецепторов обусловлена особенностями их локализации (пост- или пресинаптически на 5-НТ нейронах), в зависимости от которой они могут оказывать прямо противоположное действие на функциональную активность 5-НТ системы. Обзор посвящен данным литературы и результатам, полученным авторами, о факторах, регулирующих экспрессию и функциональную активность 5-НТ1А рецепторов, и их влиянии на поведение. Описана структура гена 5-НТ1А рецептора, приведены новейшие данные о посттрансляционной регуляции активности 5-НТ1А рецепторов и взаимодействии 5-НТ рецепторов. Особое внимание уделено роли гетеромеризации 5-НТ1А рецептора при его взаимодействии с 5-НТ7 серотониновым рецептором с образованием гетеродимера и функциональной инактивации 5-НТ1А рецептора. Показано участие 5-НТ1А рецепторов в регуляции агрессивного поведения, каталепсии, тревожности, депрессии и уникальной природной адаптации – зимней спячки. Особое внимание уделено участию этих рецепторов в регуляции 1) вызванной страхом защитно-оборонительной агрессии по отношению к человеку – основы процесса доместикации; 2) межсамцовой (intermale) агрессии по отношению к сопернику (конкуренту), приводящей к установлению отношения доминант – субординант в сообществе животных и лежащей в основе асоциального поведения человека; 3) механизмов депрессии и действия клинически эффективных антидепрессантов группы ингибиторов обратного захвата серотонина. Выдвинута гипотеза о роли 5-НТ1А / 5-НТ7 гетеродимеризации в механизме действия антидепрессантов.
Ключевые слова
Об авторах
Список литературы
1. Барыкина Н.Н., Чепкасов И.Л., Алехина Т.А., Колпаков В.Г. Селекция крыс Вистар на предрасположенность к каталепсии. Генетика. 1983;19:2014-2021.
2. Беляев Д.К., Бородин П.М. Влияние стресса на наследственную изменчивость и его роль в эволюции. Ленинград: ЛГУ, 1982:35-59.
3. Куликов А.В., Базовкина Д.В. Проверка гипотез о сцеплении в гибридологическом анализе альтернативных поведенческих признаков с неполной пенетрантностью. Генетика. 2003;39(8): 1066-1072.
4. Куликов А.В., Базовкина Д.В., Муазан М., Мормед П. Картирование гена предрасположенности к каталепсии у мышей с помощью микросателлитных маркеров. Докл. Акад. наук. 2003; 393(1):134-137.
5. Науменко В.С., Иванова Е.А., Куликов А.В., Попова Н.К. Влияние генетического нокаута моноаминоксидазы А на экспрессию 5-НТ1А рецепторов. Докл. РАН. 2005;402(2):282-285.
6. Науменко В.С., Кондаурова Е.М., Куликов А.В., Попова Н.К. Влияние селекции на высокую предрасположенность к каталепсии, на функциональную активность 5-НТ1А-рецепторов и экспрессию кодирующего их гена. Докл. РАН. 2006;409:133-135.
7. Никулина Э.М., Бородин П.М., Попова Н.К. Изменение некоторых форм агрессивного поведения и содержания моноаминов в мозге в процессе селекции на приручение диких крыс. Журн. высш. нервн. деят-сти им. И.П. Павлова. 1985a;35:703-709.
8. Никулина Э.М., Трапезов О.В., Попова Н.К. Содержание моноаминов в головном мозге норок, различающихся по реакции на человека. Журн. высш. нервн. деят-сти им. И.П. Павлова. 1985б; 35:1142-1145.
9. Попова Н.К. Серотонин мозга в генетически детерминированном защитном поведении. Журн. высш. нервн. деят-сти им. И.П. Пав-лова. 1997;47:93-97.
10. Попова Н.К. Роль серотонина мозга в экспрессии генетически детерминированного защитно-оборонительного поведения. Генетика. 2004;40(6):770-778.
11. Попова Н.К., Науменко В.С. Полиморфизм серотониновых 5-НТ рецепторов как основа полифункциональности серотонина. Рос. физиол. журн. им. И.М. Сеченова. 2010;96(8):778-786.
12. Попова Н.К., Науменко Е.В., Колпаков В.Г. Серотонин и поведение. Новосибирск, Наука, 1978.
13. Трут Л.Н. Некоторые новые данные по селекции серебристо-черных лисиц (Vulpes fulvus Desm.) по свойствам их оборонительного поведения. Генетика поведения. Ленинград: Наука, 1969.
14. Трут Л.Н. Очерки по генетике поведения. Новосибирск: Наука, 1978.
15. Abe M., Nakai H., Tabata R., Saito K., Egawa M. Effect of 5-[3-[((2S)-1,4-benzodioxan-2-ylmethyl)amino]propoxy]-1,3-benzodioxole HCl (MKC-242), a novel 5-HT1A-receptor agonist, on aggressive behavior and marble burying behavior in mice. Jpn. J. Pharmacol. 1998;76(3):297-304.
16. Aghajanian G. Electrophysiology of serotonin receptor subtypes and signal transduction pathways. Psychopharmacology: The Fourth Generation of Progress. Eds F.R. Bloom, D.J. Kupfer. N.Y.: Raven Press, 1995;1451-1459.
17. Albert P.R., Lemonde S. 5-HT1A receptors, gene repression, and depression: guilt by association. Neuroscientist. 2004;10(6):575-593.
18. Albert P.R., Sajedi N., Lemonde S., Ghahremani M.H. Constitutive G(i2)-dependent activation of adenylyl cyclase type II by the 5-HT1A receptor. Inhibition by anxiolytic partial agonists. J. Biol. Chem. 1999;274(50):35469-35474.
19. Albert P.R., Zhou Q.Y., Van Tol H.H., Bunzow J.R., Civelli O. Cloning, functional expression, and mRNA tissue distribution of the rat 5-hydroxytryptamine1A receptor gene. J. Biol. Chem. 1990;265(10): 5825-5832.
20. Amir S., Brown Z.W., Amit Z., Ornstein K. Body pinch induces long lasting cataleptic like immobility in mice: behavioral characterization and the effect of naloxone. Life Sci. 1981;28(10):1189-1194.
21. Barnes N.M., Sharp T. A review of central 5-HT receptors and their function. Neuropharmacology. 1999;38(8):1083-1152.
22. Belyaev D.K. The Wilhelmine E. Key 1978 invitational lecture. Destabilizing selection as a factor in domestication. J. Hered. 1979;70(5): 301-308.
23. Blanchard D.C., Herbert M., Blanchard R.J. Continuity versus (Political) Correctness: Animal Models and Human Aggression. Animal Models of Human Emotion and Cognition. (Eds M. Haug, R.E. Whalen, D.C. Washington). American Psychological Association, 1999;297-316.
24. Blier P., Ward N.M. Is there a role for 5-HT1A agonists in the treatment of depression? Biol. Psychiatry. 2003;53(3):193-203.
25. Boutrel B., Monaca C., Hen R., Hamon M., Adrien J. Involvement of 5-HT1A receptors in homeostatic and stress-induced adaptive regulations of paradoxical sleep: studies in 5-HT1A knock-out mice. J. Neurosci. 2002;22(11):4686-4692.
26. Broekkamp C.L., Oosterloo S.K., Berendsen H.H., van Delft A.M. Effect of metergoline, fenfluramine, and 8-OHDPAT on catalepsy induced by haloperidol or morphine. Naunyn Schmiedebergs Arch. Pharmacol. 1988;338(2):191-195.
27. Brunner H.G., Nelen M., Breakefield X.O., Ropers H.H., van Oost B.A. Abnormal behavior associated with a point mutation in the structural gene for monoamine oxidase A. Science. 1993;262(5133): 578-580.
28. Cases O., Seif I., Grimsby J., Gaspar P., Chen K., Pournin S., Muller U., Aguet M., Babinet C., Shih J.C. De Maeyer E.. Aggressive behavior and altered amounts of brain serotonin and norepinephrine in mice lacking MAOA. Science. 1995;268(5218):1763-1766.
29. Charest A., Wainer B.H., Albert P.R. Cloning and differentiation-induced expression of a murine serotonin1A receptor in a septal cell line. J. Neurosci. 1993;13(12):5164-5171.
30. Clotfelter E.D., O’Hare E.P., McNitt M.M., Carpenter R.E., Summers C.H. Serotonin decreases aggression via 5-HT1A receptors in the fighting fish Betta splendens. Pharmacol. Biochem. Behav. 2007;87(2):222-231.
31. Creti P., Capasso A., Grasso M., Parisi E. Identification of a 5-HT1A receptor positively coupled to planarian adenylate cyclase. Cell Biol. Int. Rep. 1992;16(5):427-432.
32. D’Eath R.B., Ormandy E., Lawrence A.B., Sumner B.E., Meddle S.L. Resident-intruder trait aggression is associated with differences in lysine vasopressin and serotonin receptor 1A (5-HT1A) mRNA expression in the brain of pre-pubertal female domestic pigs (Sus scrofa). J. Neuroendocrinol. 2005;17(10):679-686.
33. Dacks A.M., Dacks J.B., Christensen T.A., Nighorn A.J. The cloning of one putative octopamine receptor and two putative serotonin receptors from the tobacco hawkmoth, Manduca sexta. Insect Biochem. Mol. Biol. 2006;36(9):741-747.
34. De Boer S.F., Lesourd M., Mocaer E., Koolhaas J.M. Selective antiaggressive effects of alnespirone in resident-intruder test are mediated via 5-hydroxytryptamine1A receptors: A comparative pharmacological study with 8-hydroxy-2-dipropylaminotetralin, ipsapirone, buspirone, eltoprazine, and WAY-100635. J. Pharmacol. Exp. Ther. 1999;288(3):1125-1133.
35. De Boer S.F., Lesourd M., Mocaer E., Koolhaas J.M. Somatodendritic 5-HT(1A) autoreceptors mediate the anti-aggressive actions of 5-HT(1A) receptor agonists in rats: an ethopharmacological study with S-15535, alnespirone, and WAY-100635. Neuropsychopharmacology. 2000;23(1):20-33.
36. De Vry J. 5-HT1A receptor agonists: recent developments and controversial issues. Psychopharmacology (Berl.). 1995;121(1):1-26.
37. Deng D.R., Djalali S., Holtje M., Grosse G., Stroh T., Voigt I., Kusserow H., Theuring F., Ahnert-Hilger G., Hortnagl H. Embryonic and postnatal development of the serotonergic raphe system and its target regions in 5-HT1A receptor deletion or overexpressing mouse mutants. Neuroscience. 2007;147(2):388-402.
38. Dixon A.K. Ethological strategies for defence in animals and humans: their role in some psychiatric disorders. Br. J. Med. Psychol. 1998;71(Pt 4):417-445.
39. Drevets W.C., Thase M.E., Moses-Kolko E.L., Price J., Frank E., Kupfer D.J., Mathis C. Serotonin-1A receptor imaging in recurrent depression: replication and literature review. Nucl. Med. Biol. 2007;34(7):865-877.
40. Edwards D.H., Kravitz E.A. Serotonin, social status and aggression. Curr. Opin. Neurobiol. 1997;7(6):812-819.
41. Estrada-Camarena E., Fernandez-Guasti A., Lopez-Rubalcava C. Participation of the 5-HT1A receptor in the antidepressant-like effect of estrogens in the forced swimming test. Neuropsychopharmacology. 2006;31(2):247-255.
42. Evrard A., Malagie I., Laporte A.M., Boni C., Hanoun N., Trillat A.C., Seif I., De Maeyer E., Gardier A., Hamon M., Adrien J. Altered regulation of the 5-HT system in the brain of MAO-A knock-out mice. Eur. J. Neurosci. 2002;15(5):841-851.
43. Fargin A., Raymond J.R., Lohse M.J., Kobilka B.K., Caron M.G., Lefkowitz R.J. The genomic clone G-21 which resembles a betaadrenergic receptor sequence encodes the 5-HT1A receptor. Nature. 1988;335(6188):358-360.
44. Fricchione G.L. Neuroleptic catatonia and its relationship to psychogenic catatonia. Biol. Psychiatry. 1985;20(3):304-313.
45. Fuller R.W. Role of serotonin in therapy of depression and related disorders. J. Clin. Psychiatry. 1991;52(Suppl):52-57.
46. Gerhardt C.C., van Heerikhuizen H. Functional characteristics of heterologously expressed 5-HT receptors. Eur. J. Pharmacol. 1997; 334(1):1-23.
47. Goodwin G.M., De Souza R.J., Green A.R., Heal D.J. The pharmacology of the behavioural and hypothermic responses of rats to 8-hydroxy-2-(di-n-propylamino)tetralin (8-OH-DPAT). Psychopharmacology (Berl.). 1987;91(4):506-511.
48. Haleem D.J., Shireen E., Haleem M.A. Somatodendritic and postsynaptic serotonin-1A receptors in the attenuation of haloperidolinduced catalepsy. Progr. Neuropsychopharmacol. Biol. Psychiatry. 2004;28(8):1323-1329.
49. Hammer R.P., Jr., Hori K.M., Blanchard R.J., Blanchard D.C. Domestication alters 5-HT1A receptor binding in rat brain. Pharmacol. Biochem. Behav. 1992;42(1):25-28.
50. Handley S.L. 5-Hydroxytryptamine pathways in anxiety and its treatment. Pharmacol. Ther. 1995;66(1):103-148.
51. Hansenne M., Pitchot W., Pinto E., Reggers J., Scantamburlo G., Fuchs S., Pirard S., Ansseau M. 5-HT1A dysfunction in borderline personality disorder. Psychol. Med. 2002;32(5):935-941.
52. Hassanain M., Bhatt S., Siegel A. Differential modulation of feline defensive rage behavior in the medial hypothalamus by 5-HT1A and 5-HT2 receptors. Brain Res. 2003;981(1-2):201-209.
53. Heisler L.K., Chu H.M., Brennan T.J., Danao J.A., Bajwa P., Parsons L.H., Tecott L.H. Elevated anxiety and antidepressant-like responses in serotonin 5-HT1A receptor mutant mice. Proc. Natl Acad. Sci. USA. 1998;95(25):15049-15054.
54. Hill R.H., Svensson E., Dewael Y., Grillner S. 5-HT inhibits N-type but not L-type Ca(2+) channels via 5-HT1A receptors in lamprey spinal neurons. Eur. J. Neurosci. 2003;18(11):2919-2924.
55. Hirvonen J., Karlsson H., Kajander J., Lepola A., Markkula J., Rasi-Hakala H., Nagren K., Salminen J.K., Hietala J. Decreased brain serotonin 5-HT1A receptor availability in medication-naive patients with major depressive disorder: an in-vivo imaging study using PET and [carbonyl-11C]WAY-100635. Int. J. Neuropsychopharmacology. 2008;11(4):465-476.
56. Hjorth S. Hypothermia in the rat induced by the potent serotoninergic agent 8-OH-DPAT. J. Neural. Transm. 1985;61(1-2):131-135.
57. Hsiung S.C., Adlersberg M., Arango V., Mann J.J., Tamir H., Liu K.P. Attenuated 5-HT1A receptor signaling in brains of suicide victims: involvement of adenylyl cyclase, phosphatidylinositol 3-kinase, Akt and mitogen-activated protein kinase. J. Neurochem. 2003;87(1): 182-194.
58. Humphrey P.P., Barnard E.A. International Union of Pharmacology. XIX. The IUPHAR receptor code: a proposal for an alphanumeric classification system. Pharmacol. Rev. 1998;50(2):271-277.
59. Humphrey P.P., Hartig P., Hoyer D. A proposed new nomenclature for 5-HT receptors. Trends Pharmacol. Sci. 1993;14(6):233-236.
60. Kaufman J., Sullivan G.M., Yang J., Ogden R.T., Miller J.M., Oquendo M.A., Mann J.J., Parsey R.V., DeLorenzo C. Quantification of the serotonin 1A receptor using PET: identification of a potential biomarker of major depression in males. Neuropsychopharmacology. 2015;40(7):1692-1699.
61. Kobe F., Guseva D., Jensen T.P., Wirth A., Renner U., Hess D., Muller M., Medrihan L., Zhang W., Zhang M., Braun K., Westerholz S., Herzog A., Radyushkin K., El-Kordi A., Ehrenreich H., Richter D.W., Rusakov D.A., Ponimaskin E. 5-HT7R/G12 signaling regulates neuronal morphology and function in an age-dependent manner. J. Neurosci. 2012;32(9):2915-2930.
62. Kobilka B.K., Frielle T., Collins S., Yang-Feng T., Kobilka T.S., Francke U., Lefkowitz R.J., Caron M.G. An intronless gene encoding a potential member of the family of receptors coupled to guanine nucleotide regulatory proteins. Nature. 1987;329(6134):75-79.
63. Kondaurova E.M., Bazovkina D.V., Kulikov A.V., Popova N.K. Selective breeding for catalepsy changes the distribution of microsatellite D13Mit76 alleles linked to the 5-HT serotonin receptor gene in mice. Genes Brain Behav. 2006;5(8):596-601.
64. Korte S.M., Meijer O.C., de Kloet E.R., Buwalda B., Keijser J., Sluyter F., van Oortmerssen G., Bohus B. Enhanced 5-HT1A receptor expression in forebrain regions of aggressive house mice. Brain Res. 1996;736(1-2):338-343.
65. Kulikov A.V., Bazovkina D.V., Moisan M-P., Mormede P. The mapping of the gene of susceptibility to catalepsy in mice using polymorphic microsatellite markers. Dokl. Biol. Sci. 2003;393:531-534.
66. Lai M.K., Tsang S.W., Francis P.T., Esiri M.M., Keene J., Hope T., Chen C.P. Reduced serotonin 5-HT1A receptor binding in the temporal cortex correlates with aggressive behavior in Alzheimer disease. Brain Res. 2003;974(1-2):82-87.
67. Lanzenberger R.R., Mitterhauser M., Spindelegger C., Wadsak W., Klein N., Mien L.K., Holik A., Attarbaschi T., Mossaheb N., Sacher J., Geiss-Granadia T., Kletter K., Kasper S., Tauscher J. Reduced serotonin-1A receptor binding in social anxiety disorder. Biol. Psychiatry. 2007;61(9):1081-1089.
68. Lemonde S., Du L., Bakish D., Hrdina P., Albert P.R. Association of the C(-1019)G 5-HT1A functional promoter polymorphism with antidepressant response. Int. J. Neuropsychopharmacol. 2004;7(4): 501-506.
69. Lemonde S., Turecki G., Bakish D., Du L., Hrdina P.D., Bown C.D., Sequeira A., Kushwaha N., Morris S.J., Basak A., Ou X.M., Albert P.R. Impaired repression at a 5-hydroxytryptamine 1A receptor gene polymorphism associated with major depression and suicide. J. Neurosci. 2003;23(25):8788-8799.
70. Lopez J.F., Chalmers D.T., Little K.Y., Watson S.J. A.E. Bennett Research Award. Regulation of serotonin1A, glucocorticoid, and mineralocorticoid receptor in rat and human hippocampus: implications for the neurobiology of depression. Biol. Psychiatry. 1998;43(8): 547-573.
71. Maurel J.L., Autin J.M., Funes P., Newman-Tancredi A., Colpaert F., Vacher B. High-efficacy 5-HT1A agonists for antidepressant treatment: a renewed opportunity. J. Med. Chem. 2007;50(20):5024-5033.
72. Maxson A.C. Aggression: concepts and methods relevant to genetic analyses in mice and humans. Neurobehavioral genetics. Methods and applications. (Eds B.C. Jones, P. Mormede). N.W., Boca Raton, Florida: CRC Press LLC, 1999;293-300.
73. Mendoza D.L., Bravo H.A., Swanson H.H. Antiaggressive and anxiolytic effects of gepirone in mice, and their attenuation by WAY 100635. Pharmacol. Biochem. Behav. 1999;62(3):499-509.
74. Miyata S., Shimoi T., Hirano S., Yamada N., Hata Y., Yoshikawa N., Ohsawa M., Kamei J. Effects of serotonergic anxiolytics on the freezing behavior in the elevated open-platform test in mice. J. Pharmacol. Sci. 2007;105(3):272-278.
75. Monti J.M., Jantos H. Effects of the 5-HT1A receptor ligands flesinoxan and WAY 100635 given systemically or microinjected into the laterodorsal tegmental nucleus on REM sleep in the rat. Behav. Brain Res. 2004;151(1-2):159-166.
76. Moyer K.B. Kinds of aggression and their physiological basis. Commun. Behav. Biol. 1968;2:65-87.
77. Naumenko V.S., Ivanova E.A., Kulikov A.V., Popova N.K. Effect of monoamine oxidase A knockout on the expression of 5-HTlA receptors. Dokl. Biol. Sci. 2005;402:205-207.
78. Naumenko V.S., Kondaurova E.M., Kulikov A.V., Popova N.K. Effect of selection for a high predisposition to catalepsy on the functional activity of 5-HT1A receptors and expression of their gene. Dokl. Biol. Sci. 2006;409:299-301
79. Naumenko V.S., Kondaurova E.M., Popova N.K. Central 5-HT3 receptor-induced hypothermia in mice: interstrain differences and comparison with hypothermia mediated via 5-HT1A receptor. Neurosci. Lett. 2009;465(1):50-54.
80. Naumenko V.S., Kondaurova E.M., Popova N.K. On the role of brain 5-HT7 receptor in the mechanism of hypothermia: comparison with hypothermia mediated via 5-HT1A and 5-HT3 receptor. Neuropharmacology. 2011;61(8):1360-1365.
81. Naumenko V.S., Kozhemyakina R.V., Plyusnina I.F., Kulikov A.V., Popova N.K. Serotonin 5-HT1A receptor in infancy-onset aggression: comparison with genetically defined aggression in adult rats. Behav. Brain. Res. 2013;243:97-101.
82. Naumenko V.S., Popova N.K., Lacivita E., Leopoldo M., Ponimaskin E.G. Interplay between serotonin 5-HT1A and 5-HT7 receptors in depressive disorders. CNS Neurosci. Ther. 2014;20(7):582-590.
83. Naumenko V.S., Tkachev S.E., Kulikov A.V., Semenova T.P., Amerhanov Z.G., Smirnova N.P., Popova N.K. The brain 5-HT1A receptor gene expression in hibernation. Genes. Brain. Behav. 2008;7(3): 300-305.
84. Oakey R.J., Caron M.G., Lefkowitz R.J., Seldin M.F. Genomic organization of adrenergic and serotonin receptors in the mouse: linkage mapping of sequence-related genes provides a method for examining mammalian chromosome evolution. Genomics. 1991;10(2): 338-344.
85. Olivier B., Mos J., van Oorschot R., Hen R. Serotonin receptors and animal models of aggressive behavior. Pharmacopsychiatry. 1995;28(Suppl. 2):80-90.
86. Ou X.M., Jafar-Nejad H., Storring J.M., Meng J.H., Lemonde S., Albert P.R. Novel dual repressor elements for neuronal cell-specific transcription of the rat 5-HT1A receptor gene. J. Biol. Chem. 2000; 275(11):8161-8168.
87. Ou X.M., Storring J.M., Kushwaha N., Albert P.R. Heterodimerization of mineralocorticoid and glucocorticoid receptors at a novel negative response element of the 5-HT1A receptor gene. J. Biol Chem. 2001;276(17):14299-14307.
88. Overstreet D.H., Commissaris R.C., De La Garza R., 2nd, File S.E., Knapp D.J., Seiden L.S. Involvement of 5-HT1A receptors in animal tests of anxiety and depression: evidence from genetic models. Stress. 2003;6(2):101-110.
89. Parks C.L., Robinson P.S., Sibille E., Shenk T., Toth M. Increased anxiety of mice lacking the serotonin1A receptor. Proc. Natl Acad. Sci. USA. 1998;95(18):10734-10739.
90. Peroutka S.J., Howell T.A. The molecular evolution of G protein-coupled receptors: focus on 5-hydroxytryptamine receptors. Neuropharmacology. 1994;33(3-4):319-324.
91. Plyusnina I., Oskina I. Behavioral and adrenocortical responses to open-field test in rats selected for reduced aggressiveness toward humans. Physiol. Behav. 1997;61(3):381-385.
92. Plyusnina I.Z., Oskina I.N., Tibeikina M.A., Popova N.K. Cross-fostering effects on weight, exploratory activity, acoustic startle reflex and corticosterone stress response in Norway gray rats selected for elimination and for enhancement of aggressiveness towards human. Behav. Genet. 2009;39(2):202-212.
93. Popa D., El Yacoubi M., Vaugeois J.M., Hamon M., Adrien J. Homeostatic regulation of sleep in a genetic model of depression in the mouse: effects of muscarinic and 5-HT1A receptor activation. Neuropsychopharmacology. 2006;31(8):1637-1646.
94. Popova N.K. Serotonin in genetically determined types of defensive behavior. Zh. Vyssh. Nerv. Deiat. im. I.P. Pavlova. 1997;47(2): 350-357.
95. Popova N. Brain serotonin in genetically defined defensive behaviour. Complex Brain Functions: Conceptual Advances in Russian Neuroscience. (Eds R. Millar, A. Ivanitsky, P. Balaban). London: Harwood Press, 1999;307-329.
96. Popova N.K., Avgustinovich D.F., Kolpakov V.G., Plyusnina I.Z. Specific [3H]8-OH-DPAT binding in brain regions of rats genetically predisposed to various defense behavior strategies. Pharmacol. Biochem. Behav. 1998;59(4):793-797.
97. Popova N.K., Gilinsky M.A., Amstislavskaya T.G., Morosova E.A., Seif I., De Maeyer E. Regional serotonin metabolism in the brain of transgenic mice lacking monoamine oxidase A. J. Neurosci. Res. 2001;66(3):423-427.
98. Popova N.K., Kulikov A.V., Nikulina E.M., Kozlachkova E.Y., Maslova G.B. Serotonin metabolism and serotonergic receptors in Norway rats selected for low aggressiveness to man. Aggressive Behav. 1991a;17:207-213.
99. Popova N.K., Naumenko V.S. 5-HT1A receptor as a key player in the brain 5-HT system. Rev. Neurosci. 2013;24(2):191-204.
100. Popova N.K., Naumenko V.S., Plyusnina I.Z., Kulikov A.V. Reduction in 5-HT1A receptor density, 5-HT1A mRNA expression, and functional correlates for 5-HT1A receptors in genetically defined aggressive rats. J. Neurosci. Res. 2005;80(2):286-292.
101. Popova N.K., Voitenko N.N., Kulikov A.V., Avgustinovich D.F. Evidence for the involvement of central serotonin in mechanism of domestication of silver foxes. Pharmacol. Biochem. Behav. 1991b; 40(4):751-756.
102. Pruus K., Skrebuhhova-Malmros T., Rudissaar R., Matto V., Allikmets L. 5-HT1A receptor agonists buspirone and gepirone attenuate apomorphine-induced aggressive behaviour in adult male Wistar rats. J. Physiol. Pharmacol. 2000;51(4 Pt 2):833-846.
103. Rakel R.E. Long-term buspirone therapy for chronic anxiety: a multicenter international study to determine safety. South Med. J. 1990; 83(2):194-198.
104. Ramboz S., Oosting R., Amara D.A., Kung H.F., Blier P., Mendelsohn M., Mann J.J., Brunner D., Hen R. Serotonin receptor 1A knockout: an animal model of anxiety-related disorder. Proc. Natl Acad. Sci. USA. 1998;95(24):14476-14481.
105. Raymond J.R. Protein kinase C induces phosphorylation and desensitization of the human 5-HT1A receptor. J. Biol. Chem. 1991;266(22): 14747-14753.
106. Renner U., Zeug A., Woehler A., Niebert M., Dityatev A., Dityateva G., Gorinski N., Guseva D., Abdel-Galil D., Frohlich M., Doring F., Wischmeyer E., Richter D.W., Neher E., Ponimaskin E.G. Heterodimerization of serotonin receptors 5-HT1A and 5-HT7 differentially regulates receptor signalling and trafficking. J. Cell. Sci. 2012;125(Pt 10):2486-2499.
107. Ricci L.A., Rasakham K., Grimes J.M., Melloni R.H., Jr. Serotonin-1A receptor activity and expression modulate adolescent anabolic/androgenic steroid-induced aggression in hamsters. Pharmacol. Biochem. Behav. 2006;85(1):1-11.
108. Robinson D.S., Alms D.R., Shrotriya R.C., Messina M., Wickramaratne P. Serotonergic anxiolytics and treatment of depression. Psychopathology. 1989;22(Suppl. 1):27-36.
109. Sanberg P.R., Bunsey M.D., Giordano M., Norman A.B. The catalepsy test: its ups and downs. Behav. Neurosci. 1988;102(5):748-759.
110. Saudou F., Hen R. 5-Hydroxytryptamine receptor subtypes: molecular and functional diversity. Adv. Pharmacol. 1994;30:327-380.
111. Sawiniec J., Borkowski K., Ginalska G., Lewandowska-Stanek H. Association between 5-hydroxytryptamine 1A receptor gene polymorphism and suicidal behavior. Przegl. Lek. 2007;64(4-5):208-211.
112. Serretti A., Artioli P., De Ronchi D. The 5-HT2C receptor as a target for mood disorders. Expert Opin. Ther. Targets. 2004;8(1):15-23.
113. Shively C.A., Friedman D.P., Gage H.D., Bounds M.C., Brown-Proctor C., Blair J.B., Henderson J.A., Smith M.A., Buchheimer N. Behavioral depression and positron emission tomography-determined serotonin 1A receptor binding potential in cynomolgus monkeys. Arch. Gen. Psychiatry. 2006;63(4):396-403.
114. Sibille E., Arango V., Galfalvy H.C., Pavlidis P., Erraji-Benchekroun L., Ellis S.P., John Mann J. Gene expression profiling of depression and suicide in human prefrontal cortex. Neuropsychopharmacology.2004;29(2):351-361.
115. Singerman B., Raheja R. Malignant catatonia-a continuing reality. Ann. Clin. Psychiatry. 1994;6(4):259-266.
116. Sperry T.S., Thompson C.K., Wingfield J.C. Effects of acute treatment with 8-OH-DPAT and fluoxetine on aggressive behaviour in male song sparrows (Melospiza melodia morphna). J. Neuroendocrinol. 2003;15(2):150-160.
117. Stein D.J., Miczek K.A., Lucion A.B., de Almeida R.M. Aggressionreducing effects of F15599, a novel selective 5-HT1A receptor agonist, after microinjection into the ventral orbital prefrontal cortex, but not in infralimbic cortex in male mice. Psychopharmacology (Berl.). 2013;230(3):375-387.
118. Storring J.M., Charest A., Cheng P., Albert P.R. TATA-driven transcriptional initiation and regulation of the rat serotonin 5-HT1A receptor gene. J. Neurochem. 1999;72(6):2238-2247.
119. Sun Y.N., Wang T., Wang Y., Han L.N., Li L.B., Zhang Y.M., Liu J. Activation of 5-HT1A receptors in the medial subdivision of the central nucleus of the amygdala produces anxiolytic effects in a rat model of Parkinson’s disease. Neuropharmacology. 2015;95:181-191.
120. Turner J.H., Gelasco A.K., Raymond J.R. Calmodulin interacts with the third intracellular loop of the serotonin 5-hydroxytryptamine1A receptor at two distinct sites: putative role in receptor phosphorylation by protein kinase C. J. Biol. Chem. 2004;279(17):17027-17037.
121. van den Berg L., Kwant L., Hestand M.S., van Oost B.A., Leegwater P.A. Structure and variation of three canine genes involved in serotonin binding and transport: the serotonin receptor 1A gene (htr1A), serotonin receptor 2A gene (htr2A), and serotonin transporter gene (slc6A4). J. Hered. 2005;96(7):786-796.
122. Woehler A., Wlodarczyk J., Ponimaskin E.G. Specific oligomerization of the 5-HT1A receptor in the plasma membrane. Glycoconj J. 2009; 26(6):749-756.
123. Wissink S., Meijer O., Pearce D., van Der Burg B., van Der Saag P.T. Regulation of the rat serotonin-1A receptor gene by corticosteroids. J. Biol. Chem. 2000;275(2):1321-1326.
124. Zhang Y., D’Souza D., Raap D.K., Garcia F., Battaglia G., Muma N.A., Van de Kar L.D. Characterization of the functional heterologous desensitization of hypothalamic 5-HT(1A) receptors after 5-HT(2A) receptor activation. J. Neurosci. 2001;21(20):7919-7927.
125. Zhuang X., Gross C., Santarelli L., Compan V., Trillat A.C., Hen R. Altered emotional states in knockout mice lacking 5-HT1A or 5-HT1B receptors. Neuropsychopharmacology. 1999;21(2 Suppl):52S-60S.
126. Zifa E., Fillion G. 5-Hydroxytryptamine receptors. Pharmacol. Rev. 1992;44(3):401-458.




