какую функцию выполняет белок тубулин
Тубулин
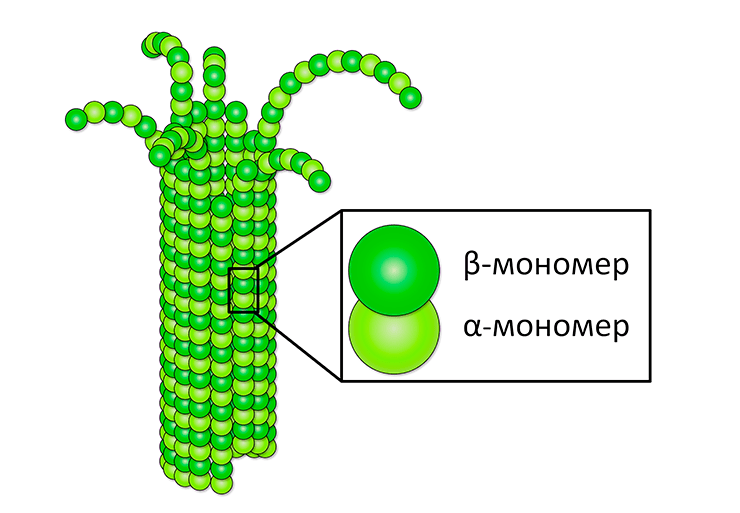
Тубули́н — это белок, из которого построены микротрубочки. В них, а также в цитоплазме клеток он находится в форме димера, состоящего из двух форм — α- и β-тубулина. Одна молекула α-тубулина и одна молекула β-тубулина в цитоплазме клеток объединяются в димер (изображен на рисунке). В составе такого димера к каждой молекуле тубулина присоединено по одной молекуле ГТФ. У каждой из этих субъединиц выделяют три домена. Форма γ-тубулина принимает участие в нуклеации микротрубочек, то есть образовании затравки, с которой начинается рост. Тубулин способен связываться в растворе с молекулами ГТФ. Рост микротрубочек осуществляется только за счет присоединения димеров тубулина, в которых обе субъединицы связаны с молекулами ГТФ. В стенках микротрубочек происходит гидролиз ГТФ, связанной с β-субъединицей, до ГДФ (связанная с α-субъединицей ГТФ стабильна). Связанная с ГДФ форма тубулина легче отделяется от микротрубочек, что определяет динамическую нестабильность микротрубочек — при определенных условиях они быстро распадаются почти полностью.
Долгое время полагалось, что тубулин характерен только для эукариотических клеток. Однако последние исследования обнаружили участвующий в делении прокариотов гомологичный белок FtsZ, который может быть эволюционным предшественником тубулина.
Дельта и эпсилон формы тубулины были найдены в центриолях и, по-видимому, принимают участие в образовании веретена деления.
Молекулярный вес β-тубулина порядка 55 кДа. Продольный размер — 8 нм.
Тубулин является мишенью для противоопухолевых препаратов (таксол, доцетаксел, паклитаксел) и колхицина. Колхицин связывается с тубулином, препятствуя формированию микротрубочек. Это его свойство используется для получения искусственных полиплоидов и в терапии подагры (колхицин снижает подвижности нейтрофилов, тем самым способствуя спаду воспалительного процесса).
Смотрите также
Полезное
Смотреть что такое «Тубулин» в других словарях:
тубулин — Основной белок микротрубочек, обладающий сократительными функциями [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN tubulin … Справочник технического переводчика
тубулин — tubulin тубулин. Oсновной белок микротрубочек, обладающий сократительными функциями; димер, состоящий из α и β цепей с молекулярными массами 55 кД; кодирование Т. имеет олигогенный характер (например, у дрозофил известно 4 неаллельных гена α Т.) … Молекулярная биология и генетика. Толковый словарь.
ацетилированный тубулин — Форма входящего в микротрубочки веретена деления тубулина, обеспечивающая им повышенную стабильность (например, устойчивость к деполимеризующему действию холода) по сравнению с микротрубочками других частей митотического аппарата астера и не… … Справочник технического переводчика
Структурная функция белков — заключается в том, что белки участвуют в образовании практически всех органоидов клеток, во многом определяя их структуру (форму); образуют цитоскелет, придающий форму клеткам и многим органоидам и обеспечивающий механическую форму ряда тканей;… … Википедия
Цитоскелет прокариот — Цитоскелет прокариот это система нитеподобных структур, которые преимущественно являются упорядоченными полимерами белков одного класса, наличествует в клетках бактерий и … Википедия
Цитоскелет — эукариот. Актиновые микрофиламенты окрашены в красный, микротрубочки в зелёный, ядра клеток в голубой цвет. Цитоскелет это клеточный каркас или скелет, находящийся в цитоплазме живой клет … Википедия
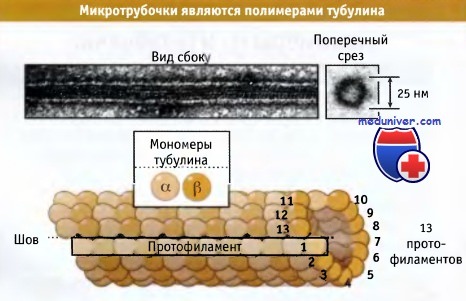
Микротрубочки — Микротрубочки белковые внутриклеточные структуры, входящие в состав цитоскелета. Микротрубочки представляют собой полые внутри цилиндры диаметром 25 нм. Длина их может быть от нескольких микрометров до, вероятно, нескольких миллиметров в… … Википедия
Статмин — stathmin 1/oncoprotein 18 Обозначения Символы STMN1; LAP18 Entrez Gene … Википедия
Клеточный центр — Телофаза митоза (электронная микрофотография). Стрелка указывает на центросому. Четко видны две центриоли, расположенные под прямым углом друг к другу: одна перерезана поперек, другая вдоль. Центросома (от центр и греч. soma тело), центросфера,… … Википедия
Какую функцию выполняет белок тубулин
• Микротрубочки представляют собой полые полимеры гетеродимеров тубулина и обладают полой структурой
• Микротрубочка образована из 13 линейных цепей субъединиц, которые называются протофиламентами и связаны между собой латерально
• Наличие латеральных связей между протофиламентами стабилизирует микротрубочки и ограничивает добавление и удаление субъединиц к концам микротрубочек
• Микротрубочки представляют собой поляризованные полимеры. Их плюс-концы заканчиваются b-тубулином и собираются быстрее. Минус-концы содержат а-тубулин. и они собираются медленнее
Основной структурной единицей микротрубочек является белок тубулин. Он представляет собой гетеродимер, состоящий из двух близких белков, а- и b-тубулина. Эти белки обладают на 40% одинаковой первичной структурой и никогда не обнаруживаются поодиночке. Во всех случаях одна молекула а-тубулина и одна b-тубулина связаны вместе, образуя 100 кДа гетеродимер.
Этот гетеродимер обычно для простоты называется «тубулин», чтобы подчеркнуть факт, что он всегда функционирует как единое целое. Поскольку а- и р-тубулин имеют круглую форму, их гетеродимер похож на плод арахиса. Эта структура исследована при атомном разрешении: а- и b-тубулин имеют близкое строение и в димере расположены «линейно» так, что передняя часть молекулы одного примыкает к задней части молекулы другого.
Каждая молекула а- и b-тубулина связывает молекулу ГТФ. Строение гетеродимера тубулина показывает, что ГТФ, связанный с а-тубулином, расположен поблизости от места его контакта с b-тубулином. Этот ГТФ никогда не гидролизуется и не обменивается с нуклеотидами, находящимися в растворе. Напротив, ГТФ, связанный с р-тубулином, оказывается открытым с другой стороны гетеродимера и может обмениваться с нуклеотидами, находящимися в растворе.
При сборке микротрубочек ГТФ гидролизуется до ГДФ. Этот гидролиз приводит к изменению конформации гетеродимера тубулина, что играет важную роль в динамических превращениях микротрубочек.
Золотистым и медно-красным цветом выделены полипептидные цепи, составляюшие две белковые субъединицы,
а зеленым цветом — две молекулы ГТФ, связанные с каждым гетеродимером.
Можно видеть сходство структур двух субъединиц и их расположение в комплексе как «голова к хвосту».
В самом низу схематически представлен димер тубулина.
Микротрубочки представляют собой белковые полимеры, состоящие из тысяч тубулиновых субъединиц, организованных в полые структуры. Обычно микротрубочка состоит из 13 линейных цепей субъединиц, расположенных по длине параллельно; каждая цепь носит название протофиламент.
Эти протофиламенты, показанные на рисунке ниже, соединяются по бокам, образуя микротрубочку. Хотя возможно образование микротрубочки из 11-15 протофиламентов, большая их часть, присутствующая в клетках, образована из 13 протофиламентов. Такая микротрубочка имеет диаметр 25 нм, т. е. в пять раз превышающий толщину ее стенки.
Гетеродимеры тубулина связаны по типу «голова к хвосту» вдоль длины каждого протофиламента. В большинстве примыкающих протофиламентов а-тубулины располагаются ближе к другим а-тубулинам и b-тубулины к другим b-тубулинам. Поскольку примыкающие протофиламенты по отношению друг к другу выровнены не строго, то наблюдается некоторая прерывистость или шов, в котором а-тубулины одного протофиламента примыкают к b-тубулинам следующего. Возможно, что этот шов играет важную роль в сборке микротрубочек.
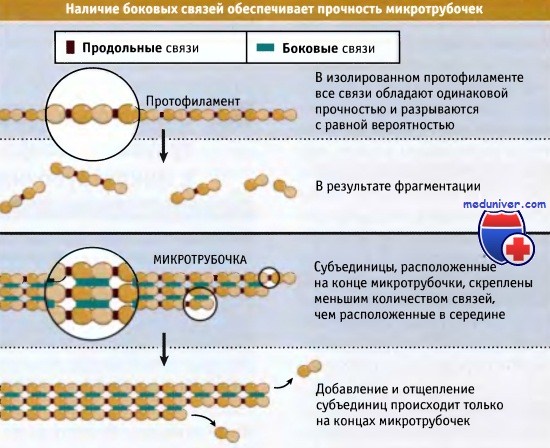
Каждый гетеродимер тубулина в микротрубочке образует прочные нековалентные связи с соседними гетеродимерами. Как схематически изображено на рисунке ниже, эти нековалентные связи возникают в продольном и латеральном направлениях между димерами в протофиламенте. Одна продольная связь оказывается сильнее, чем одна латеральная связь, но наличие многочисленных латеральных связей делает полимер прочным. Легко продемонстрировать, почему это так.
Субъединицы в отдельном протофиламенте соединены только продольными связями. Все связи обладают одинаковой прочностью, так что они характеризуются равной вероятностью разрыва. Это делает один протофиламент способным к фрагментации. В микротрубочке субъединицы в середине полимера также образуют латеральные связи с субъединицами в примыкающих протофиламентах. Для разрыва микротрубочки необходимо, чтобы у всех 13 протофиламентов одновременно в одном и том же месте разорвались продольные связи. Это крайне маловероятное событие, и поэтому микротрубочки рвутся крайне редко.
Наличие латеральных связей между субъединицами также делает маловероятным диссоциацию димеров тубулина в середине микротрубочки, поскольку высвобождение димера в этом случае требует одновременного разрыва нескольких связей.
В протофиламенте отдельные гетеродимеры тубулина расположены друг за другом,
а сами протофиламенты связаны между собой боковыми связями, образуя полую трубочку.
Все гетеродимеры ориентированы одинаковым образом — с одного конца микротрубочки расположены b-субъединицы, а с другого — а-субъединицы.
В верхней части рисунка представлена электронная микрофотография микротрубочки, полимеризованной из очищенного тубулина.
Вместо этого субъединицы добавляются только к концам филаментов, и там же происходит их диссоциация. В этих местах каждая субъединица присоединена к остатку микротрубочки несколькими связями.
Очищенные препараты гетеродимеров тубулина способны спонтанно образовывать боковые и продольные связи, приводящие к образованию микротрубочек. Поэтому сборка микротрубочек представляет собой процесс самосборки, при котором вся информация, необходимая для построения окончательной структуры, содержится в субъединицах. Примерами процессов самосборки является также полимеризация актиновых филаментов и сборка капсид некоторых вирусов.
Характер расположения субъединиц в микротрубочке обусловливает различия структуры ее концов. В каждом протофиламенте все гетеродимеры тубулина ориентированы одинаково, и в пределах микротрубочки все протофиламенты направлены также одинаково. Таким образом, кэп b-тубулина открыт с одной стороны микротрубочки (который называется плюс-конец), в то время как а-тубулин открыт с другого конца (минус-конец). Такая организация придает микротрубочке два очень важных свойства.
Во-первых, два ее конца становятся структурно различными и ведут себя по-разному. Как мы увидим, клетки часто используют это свойство, например регулируя независимую сборку с двух концов микротрубочки. Во-вторых, каждая микротрубочка представляет собой полярную структуру (т. е. обладает внутренней двунаправленностью), и ее можно рассматривать как направленную определенным образом. Это полярность характерна для всей микротрубочки, а не только для ее концов. Стоит лишь посмотреть на поверхность микротрубочки в любой точке, даже расположенной в середине, и можно определить направление плюс- и минус-концов.
Полярность микротрубочек позволяет им выполнять функцию двунаправленных путей для белковых молекулярных моторов и существенна для выполнения их роли во внутриклеточной организации.
Рисунок ниже иллюстрирует организацию микротрубочек в соответствии с их полярностью. Например, в фибробластах и других клетках с радиальным расположением микротрубочек они организованы так, что их минус-концы направлены к центру клетки, а плюс — к ее периферии. В эпителиальных клетках микротрубочки расположены параллельно друг другу, и идут сверху вниз, причем плюс-концы находятся внизу, а минус — наверху.
Аналогичным образом, все микротрубочки в аксоне ориентированы в одном и том же направлении. Для каждого типа клеток полярность расположения микротрубочек существенна для поддержания их структуры и функционирования.
Одиночные протофиламенты склонны к диссоциации, поскольку все связи обладают одной и той же прочностью и разрываются с равной вероятностью.
Наличие боковых связей в микротрубочке делает маловероятным разрыв полимера в середине.
Субъединицы добавляются или диссоциируют только на концах микротрубочек, где каждая удерживается меньшим количеством связей, чем в середине.
Для простоты показаны только три протофиламента. 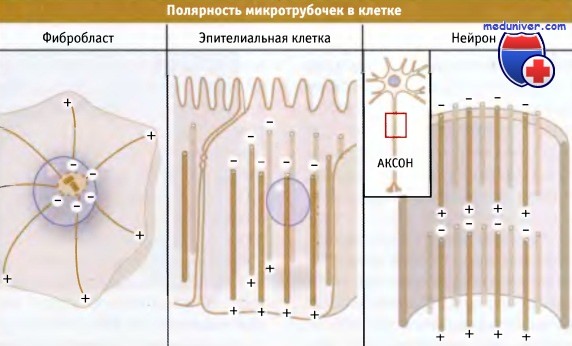
Это позволяет использовать полярность микротрубочки как чувствительный индикатор направления в цитоплазме.
Например, в эпителиальной клетке направление от «+» к «-» означает «вверх».
Форма клетки и ее способность различать специализированные области на поверхности или внутри зависят от полярности микротрубочек.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
«Зоопарк» ингибиторов тубулина
Примерно такие события происходят под микроскопом, когда изучается поведение внутриклеточных микротрубочек в присутствии разных ингибиторов тубулина. Некоторые из этих веществ стремятся стабилизировать микротрубочки, а другие, наоборот, дестабилизировать. В конечном счете, обоими способами ингибиторы тубулина подавляют динамическое поведение микротрубочек — способность спонтанно переключаться между фазами полимеризации и деполимеризации.
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: Микротрубочки — каркасные внутриклеточные структуры из белка тубулина. Эти динамичные нити обладают необычными механическими свойствами и уникальной способностью спонтанно переключаться между фазами удлинения и укорочения, что позволяет им вместе с другими внутриклеточными полимерами обеспечивать «домашнее хозяйство» клетки и правильное разделение хромосом во время ее деления. Ключевая роль динамики микротрубочек в клеточном делении делает тубулин одной из самых успешных мишеней для противоопухолевых препаратов, разнообразие которых сейчас очень велико. Представленный здесь «зоопарк» ингибиторов динамики микротрубочек отражает разновидности существующих молекул, способных влиять на свойства тубулина, приводя к остановке деления клеток. Предлагаем познакомиться с основными представителями ингибиторов тубулина, каждый из которых обладает уникальными свойствами. Несмотря на десятки лет исследований, механизм действия большинства ингибиторов всё еще неизвестен. В нашем обзоре мы рассмотрим некоторые современные методы, которые позволяют изучать особенности взаимодействия ингибиторов и микротрубочек, и расскажем об актуальных загадках и нерешенных проблемах в этой области биофизики.
Конкурс «Био/Мол/Текст»-2020/2021

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Полимеры белка тубулина (микротрубочки) вместе с другими элементами цитоскелета обеспечивают множество внутриклеточных процессов. С одной стороны, это — почти «несгибаемые» белковые нити, которые пронизывают всю клетку и исполняют роль «рельсов» для внутриклеточного транспорта, с другой — очень динамичные структуры [1]. За считанные минуты они могут вырасти в длину на десятки, а то и сотни микрометров, и всего за несколько секунд — полностью разобраться. Причем фазы роста и укорочения спонтанно сменяют друг друга. Это уникальное свойство, называемое динамической нестабильностью, не характерно для других белков клеточного скелета — актиновых и промежуточных филаментов, вместе с которыми микротрубочки придают клетке механическую жесткость, позволяют двигаться и делиться.
В статье [2] было подробно рассмотрено строение микротрубочки и ее свойства, разобраны экспериментальные и теоретические подходы к изучению этих особенных белковых нитей. Теперь же больше внимания уделим различным веществам, способным кардинальным образом влиять на сложное поведение микротрубочек. Эти разнообразные органические молекулы, многие из которых успешно используются в медицине, называются ингибиторами тубулина.
Рисунок 1. Строение микротрубочки. Микротрубочка, как правило, состоит из 13 более тонких нитей так называемых протофиламентов [3]. Они соединяются друг с другом вдоль оси микротрубочки, замыкаясь в полый цилиндр. Протофиламенты построены из наиболее элементарных структурных единиц — димеров белка тубулина. Они называются так, потому что состоят из двух частей — α- и β-мономеров.
Строение микротрубочки показано на рисунке 1. На всех структурных уровнях организации микротрубочки связи между протофиламентами и димерами могут образовываться и разрываться, что позволяет ей расти или укорачиваться. Как именно будет изменяться длина микротрубочки, зависит от того, имеется ли на ее конце достаточно β-мономеров, связанных с молекулой гуанозинтрифосфата (ГТФ). Эта молекула-нуклеотид имеет множество крайне важных функций, среди которых, например, вхождение в алфавит генетического кода в качестве одной из четырех букв; перенос энергии в клетке, наряду с другой похожей молекулой (АТФ), а также регуляция работы различных ферментов. Молекулы ГТФ влияют на свойства тубулинов, придавая им способность полимеризоваться [4]. Вместе с этими молекулами в своем составе тубулины присоединяются к концу микротрубочки. Впоследствии происходит химическая реакция, в результате которой ГТФ превращается в гуанозиндифосфат (ГДФ). Если критическое количество молекул ГТФ превращается в ГДФ, конец микротрубочки начинает разбираться [5].
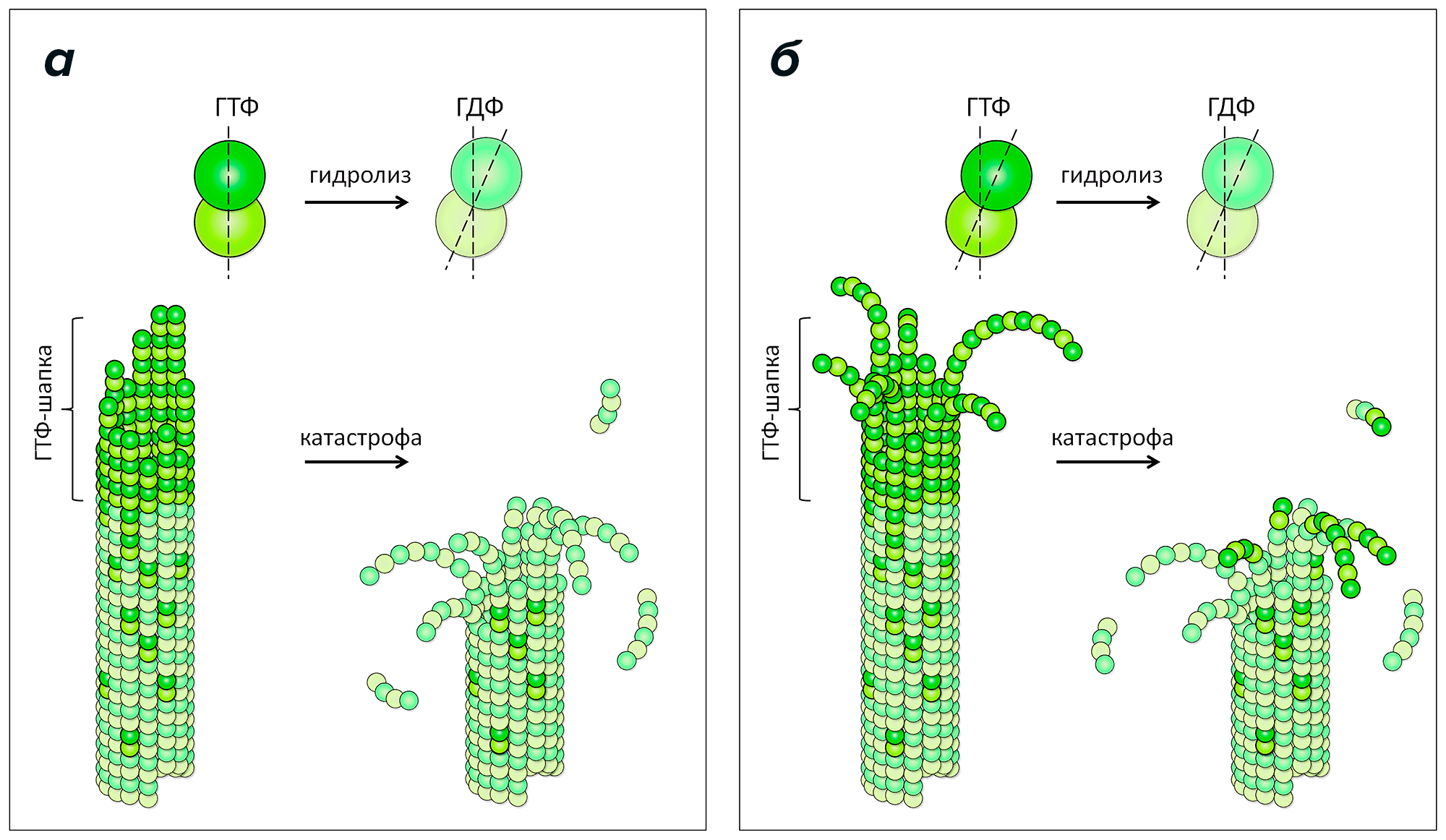
Раньше предполагалось, что это происходит потому, что тубулин меняет свою кривизну в результате этой реакции: молекула ГТФ придает тубулину прямую форму, которая хорошо подходит для строительства микротрубочки, но превратившись в ГДФ, она, наоборот, заставляет его закручиваться (рис. 2а). В результате ГДФ-тубулины стремятся «выломаться» из тела микротрубочки наружу, приводя к ее разборке. Однако недавно, вопреки этим взглядам, используя методы криоэлектронной томографии [6], [7] и компьютерного моделирования, мы и наши коллеги из США показали, что протофиламенты микротрубочки стремятся закручиваться, даже когда они связаны с молекулами ГТФ на конце микротрубочки (рис. 2б) [8], [9]. Для этого нам потребовалось обработать тысячи микротрубочек в замороженных образцах делящихся клеток разных организмов и в замороженных образцах, содержащих микротрубочки, собранные из очищенного тубулина вне клеток. Компьютерное моделирование роста и разборки микротрубочек, представленных в виде взаимодействующих сферических частиц, в свою очередь потребовало очень существенных вычислительных затрат. В итоге нам удалось создать новую теорию сборки микротрубочки, в которой нуклеотид лишь влияет на гибкость протофиламентов или силу связей между ними, но не на кривизну, как считалось долгие годы. На наш взгляд, эта детальная информация о том, как именно происходит сборка микротрубочки, может существенно улучшить понимание работы ингибиторов тубулина, которым посвящен этот обзор.
Рисунок 2. Классическая и новая модели динамики микротрубочек. а — Согласно классической модели, ГТФ-тубулины (изображены яркими тонами зеленого) имеют прямую форму, а ГДФ-тубулины (изображены бледными тонами зеленого) — закручены. Прямые строительные блоки ГТФ-тубулинов эффективно встраиваются в конец микротрубочки и удлиняют ее. Попадая таким образом в тело микротрубочки, молекула ГТФ вскоре претерпевает гидролиз и превращается в ГДФ. Поэтому, когда стабилизирующий слой из ГТФ-тубулинов (называемый иногда ГТФ-шапкой, или ГТФ-колпачком) исчезает, микротрубочка переходит к разборке. б — Новая модель роста микротрубочек на основе последних данных криоэлектронной томографии и компьютерного моделирования. В этой модели и ГТФ-, и ГДФ-тубулины имеют одинаковую закрученную форму. Такие изогнутые строительные блоки присоединяются к концам закрученных ГТФ-протофиламентов на конце микротрубочки. При этом энергии тепловых колебаний вполне достаточно, чтобы иногда (и как показывают наши расчеты, довольно часто!) протофиламенты выпрямлялись и смыкались, образуя связи, в результате чего микротрубочка удлинялась. Далее, аналогично классической модели, в результате реакции гидролиза ГТФ или случайного отсоединения ГТФ-тубулинов от конца микротрубочки, слой из ГТФ-тубулинов может исчезнуть или разломиться на отдельные протофиламенты. В этом случае из-за более слабых связей между ГДФ-тубулиновыми протофиламентами или из-за большей жесткости этих протофиламентов микротрубочка начинает быстро разбираться, растрескиваясь на отдельные закрученные протофиламенты на конце.
Важно также отметить, что оба конца микротрубочки не эквивалентны. Микротрубочка обладает полярностью: конец, образованный α-мономерами, принято называть «минус»-концом, а представленный β-мономерами — «плюс»-концом. «Минус»-конец в клетке обычно закреплен в специальной структуре, называемой центром организации микротрубочек, в то время как «плюс»-конец обращен к границе клетки и участвует во множестве процессов. Например, вдоль микротрубочки по направлению к «плюс»-концу или от него могут перемещаться различные «грузы» с помощью моторных белков [10]. Во время деления клетки именно «плюс»-концы прикрепляются к хромосомам с помощью других вспомогательных белков и способны развивать силы [11], необходимые для разнесения хромосом по двум дочерним клеткам.
Одной из самых успешных стратегий химиотерапии опухолей служит использование ингибиторов тубулина для подавления ключевого свойства микротрубочек — динамической нестабильности [12]. Это позволяет остановить деление раковых клеток за счет нарушения одной из основных функций микротрубочек — разделения хромосом во время митоза. Каждое из этих веществ по-своему уникально и обладает особенными характеристиками воздействия на микротрубочки. Не запутаться в таком разнообразии помогает классификация ингибиторов тубулина по двум основным параметрам: место связывания с этим белком и характер воздействия на динамику всей микротрубочки.
В многочисленных работах в данной области отмечается, что существует связь между тем, в каком месте тубулина присоединяется ингибитор и как этот ингибитор влияет на динамику микротрубочки. По самым последним экспериментальным данным, для кардинального изменения ее динамики достаточно всего нескольких молекул (или даже одной молекулы!).
Колхицин — известный старожил
Особое место в нашем «зоопарке» ингибиторов динамики микротрубочек занимает вещество, с которым неразрывно связана история открытия тубулина, — колхицин. Одно время сам тубулин даже назывался колхицин-связывающим белком [18].
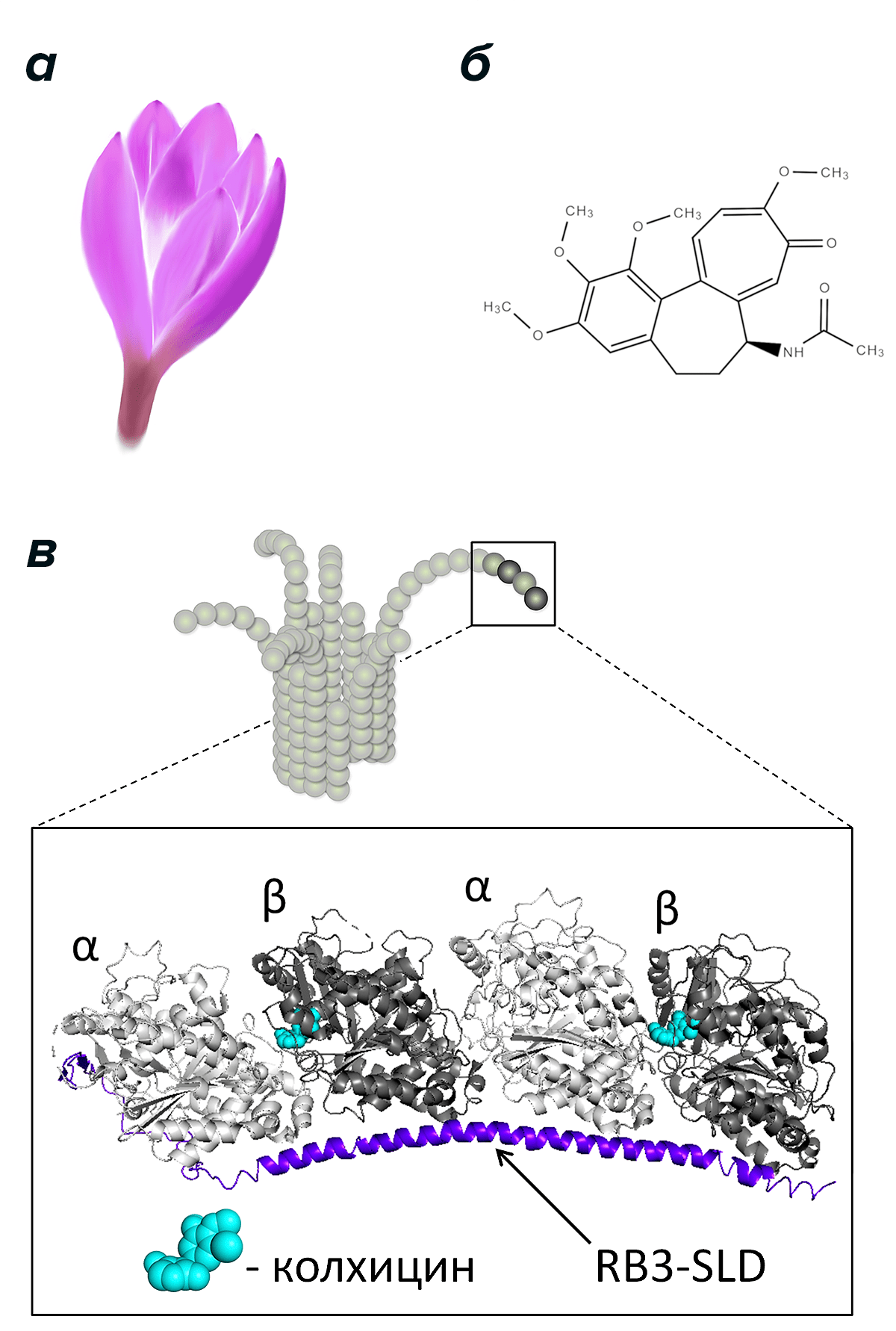
Колхицин известен медицине с давних пор. Впервые его выделили из растения безвременника осеннего (Colchicum autumnale; рис. 3а) и использовали для лечения подагры. Свойства колхицина как ингибитора тубулина и вещества, останавливающего клеточное деление, стали известны относительно недавно — на заре изучения тубулина и одновременно с первыми исследованиями микротрубочек. С тех пор интерес к этой небольшой молекуле (рис. 3б) не угасает, поскольку колхицин обладает ярко выраженной способностью подавлять динамическую нестабильность микротрубочек и деление клеток, в том числе раковых, причем в небольших концентрациях (порядка десятков или сотен наномоль/литр). Колхицин мог бы оказаться очень полезным в химиотерапии, если бы не его слишком высокая токсичность. Достаточно сказать, что потребление даже менее одного грамма колхицина может привести к печальным последствиям, так как его летальная доза для человека около 1 мг/кг, а какого-либо противоядия в настоящий момент не существует [19]. Это обстоятельство заставляет искать другие столь же эффективные, но менее токсичные ингибиторы, а для этого необходимо понять, в чем заключается уникальный механизм воздействия колхицина на микротрубочки.
Рисунок 3. Безвременник осенний (а), молекула колхицина (б) и схема его взаимодействия с «закрученными» димерами тубулина (в). Изображен конец микротрубочки с изогнутыми протофиламентами и детальное строение фрагмента протофиламента на основе кристаллической структуры комплекса из двух димеров тубулина, белка RB3-SLD и колхицина [20]. Получение такого комплекса необходимо для проведения рентгеноструктурного анализа, разрешающая способность которого позволяет различить положение отдельных атомов. Согласно последним экспериментальным данным [8], [9], тубулин имеет аналогичную «закрученную» конформацию не только, когда он свободен или связан с белком RB3-SLD в растворе, но и когда находится на концах изогнутых протофиламентов микротрубочек во время их сборки и разборки. Колхицин, как считается [20], выступает в роли «клина», встающего между мономерам одного димера тубулина. Этот «клин» не позволяет димерам выпрямляться и образовывать решетку тела микротрубочки, что приводит к ее дестабилизации.
Сейчас, благодаря многочисленным исследованиям в этой области, ответ на данный вопрос уже близок. Это стало возможно благодаря получению кристаллизованного комплекса, в котором тубулин связан с колхицином таким же образом, как это происходит в растворе. Здесь важно напомнить, что в растворе димер тубулина имеет так называемую «закрученную» конформацию. Похожую форму димеров удается получить с помощью дополнительного белка RB3-SLD, который позволяет им образовать кристалл.
В теле микротрубочки, то есть вдали от ее концов, димеры тубулина обладают «прямой» конформацией. Исследователи сравнили положение каждого атома «закрученного» димера тубулина, связанного с колхицином, с положением атомов «прямого» димера тубулина [20]. Оказалось, что, связавшись с растворенным тубулином в «закрученной» конформации, колхицин препятствует «выпрямлению» этого димера и, соответственно, его встраиванию в тело микротрубочки. Благодаря этому факту, «кузен» колхицина, ингибитор из семейства колхицин-подобных соединений под названием аллоколхицин, даже помог показать, что обмен нуклеотидов (ГТФ на ГДФ) в составе тубулина не сопровождается изменением степени его «закрученности». Для этого авторы статьи [21] воспользовались уникальным свойством аллоколхицина интенсивно флуоресцировать в результате связывания с «закрученным» димером тубулина и благодаря этому сумели определить аффинность связывания. Выяснилось, что, независимо от того, какой из нуклеотидов находится в димере, аффинность его связывания с аллоколхицином одинаковая, поэтому можно считать, что свободные димеры тубулина обладают «закрученной» конформацией независимо от нуклеотида в своем составе. Эта работа — яркий пример того, какую важную роль занимают ингибиторы тубулина не только в прикладном отношении, но и в решении фундаментальных проблем.
Таксол не перестает удивлять
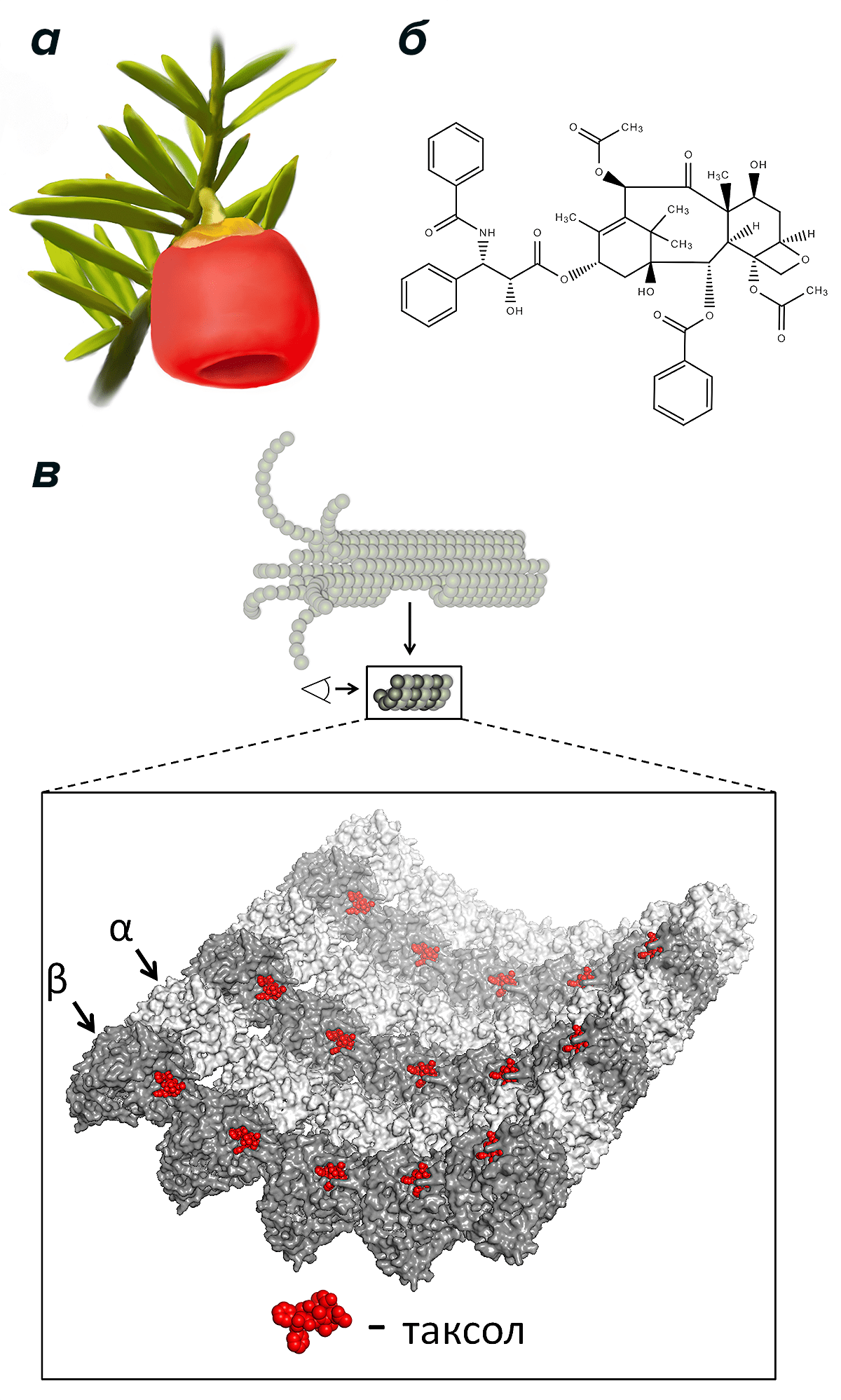
Хотя в чистом виде это вещество получено и исследовано не так давно, с ним уже связано значительное количество неожиданных фактов. Работа о первом выделении таксола из коры тиса коротколиственного (Taxus brevifolia) появилась в 1967 г., и тогда же описаны свойства таксола как противоопухолевого соединения (рис. 4а, б) [22]. Спустя некоторое время выяснился первый удивительный факт, связанный с тем, что таксол производит значительный стабилизирующий эффект на микротрубочки [23]. Тогда это было неожиданным явлением, так как другие известные в то время ингибиторы, такие как колхицин и винбластин (о котором речь пойдет ниже), обладают явным свойством разрушать микротрубочки при больших концентрациях. Таксол же, наоборот, способствует росту микротрубочки, причем этот эффект усиливается при увеличении его концентрации.
Рисунок 4. Плод тиса коротколиственного (а), молекула таксола (б) и схема связывания таксола с внутренней поверхностью микротрубочки (в). Изображено тело микротрубочки; крупнее показаны «прямые» димеры тубулина с молекулами таксола на внутренней поверхности микротрубочки [27].
Таксол хорошо связывается с самими микротрубочками, прикрепляясь к димерам тубулина в их составе, причем со свободным тубулином в растворе он связывается плохо (рис. 4в) [24]. Если учесть, что место связывания таксола находится на внутренней поверхности микротрубочки, то есть в ее просвете, стоит задаться вопросом — как таксол туда попадает снаружи? Можно предположить, что таксол оказывается в просвете микротрубочки через ее открытые концы и за счет диффузии распределяется по внутренней поверхности. Однако он взаимодействует с микротрубочкой так быстро, что такая диффузия не смогла бы это обеспечить [25]. Возможно, таксол проникает внутрь микротрубочки каким-то образом прямо через ее стенку, но как именно это происходит, пока неизвестно. Кроме того, недавно было выявлено очередное удивительное свойство таксола: молекулы этого вещества каким-то образом могут влиять на присущее микротрубочке свойство спонтанно сменять фазы роста и укорочения [26]. Оказывается, всего несколько молекул таксола способны увеличить частоту переключений фазы укорочения на фазу роста. Этот результат проливает свет на таинственные свойства таксола стабилизировать микротрубочку и способствовать ее росту.
Несмотря на большое количество фундаментальных проблем, связанных с механизмом взаимодействия таксола и микротрубочки, это вещество широко используется в прикладных целях. Помимо очень успешного применения таксола в химиотерапии, его, как и колхицин, часто используют для изучения самих микротрубочек или, например, их взаимодействия с другими белками [28].
Двуликий винбластин
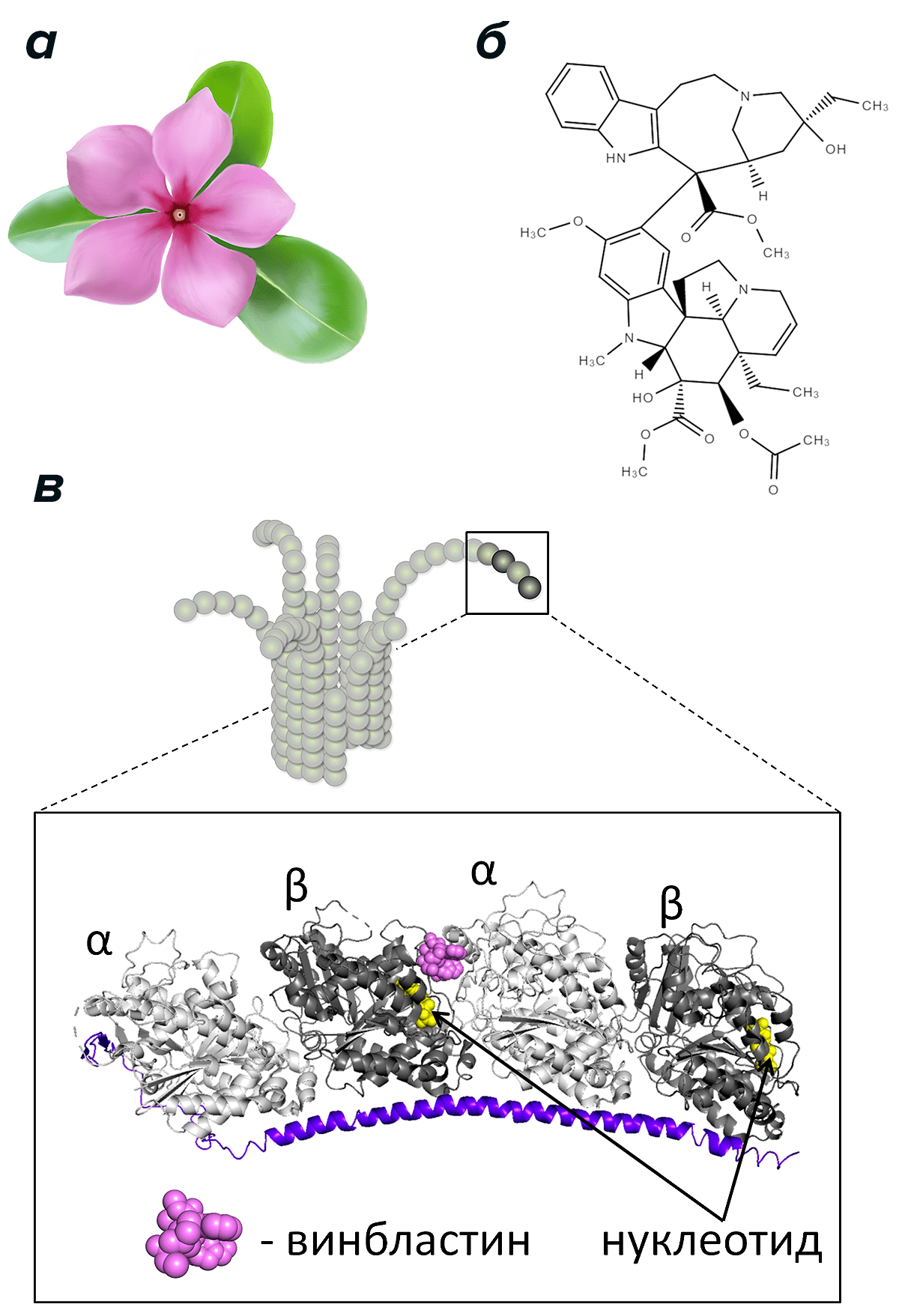
С этим веществом связаны многие успехи химиотерапии с тех пор, когда обнаружилось его свойство останавливать клеточное деление. Это произошло 60 лет назад и описано в двух работах, в которых впервые изучено на тот момент новое противоопухолевое вещество винбластин [29], [30]. Впервые его выделили из вечнозеленого многолетнего травянистого растения (рис. 5а) — барвинка розового (Catharanthus roseus). Впоследствии в клиническую практику ввели и многие другие аналогичные вещества, связывающиеся с тубулином в том же месте, что и винбластин. К ним относятся, например, виндезин, винкристин, винорелбин и винфлунин.
Винбластин может связываться не только с растворенным тубулином, но и с самими микротрубочками, при этом он присоединяется преимущественно к самому их концу [31]. Место его связывания располагается между димерами тубулина вблизи молекулы ГТФ (рис. 5в) [32]. В концентрации нескольких микромоль/литр винбластин способствует деполимеризации микротрубочек и разрушает веретено деления. Как ни парадоксально, но при очень малых концентрациях (несколько наномоль/литр) винбластина, наоборот, складывается ситуация, когда микротрубочка не растет и не укорачивается [33]. Такая «стабилизация» напоминает эффект, оказываемый таксолом, но, как считается, в ее основе лежит другой механизм [34]. Таким образом, винбластин, в зависимости от его концентрации, можно рассматривать как стабилизатор, так и дестабилизатор микротрубочек.
Рисунок 5. Цветок барвинка розового (а), молекула винбластина (б) и схема взаимодействия винбластина с концом микротрубочки (в). Изображен конец микротрубочки с изогнутыми протофиламентами и детальное строение фрагмента протофиламента на основе кристаллической структуры комплекса из двух димеров тубулина, белка RB3-SLD и винбластина [35]. Видно близкое расположение молекулы винбластина и нуклеотида в составе β-мономера.
Детальный механизм воздействия винбластина до сих пор неясен. С одной стороны, он (как колхицин) может препятствовать образованию связей между димерами в теле микротрубочки, с другой, — способствовать (подобно таксолу) образованию продольных связей между димерами тубулина [31]. Наконец, близость винбластина к нуклеотиду ГТФ гипотетически могла бы позволить ему влиять на скорость превращения этого нуклеотида в ГДФ в результате гидролиза. Так как принято считать, что гидролиз ГТФ в составе димера тубулина играет ключевую роль в стабильности микротрубочки, у винбластина есть еще один возможный механизм воздействия на динамическую нестабильность микротрубочки.
Малые концентрации, но сильные эффекты!
Мы уже упоминали, что ингибиторы тубулина — колхицин, таксол и винбластин — могут давать значительный эффект на динамику всей микротрубочки (вплоть до ее полного подавления), присутствуя в растворе даже в концентрациях меньше 1 мкМ. Попробуем представить себе механизм воздействия, например, колхицина. Пусть он заключается в том, что, связавшись с растворенным тубулином, колхицин не позволяет ему участвовать в росте микротрубочки. Этот простой и понятный механизм ингибирования характерен для белка RB3-SLD. Он помогает получить кристаллическую структуру тубулина, связывая вместе два димера. Известно, что добавление RB3-SLD в концентрации 4 мкМ к раствору свободного тубулина с концентрацией 20 мкМ приводит к тому, что характер роста микротрубочек соответствует случаю, когда в растворе только 12 мкМ тубулина [36]. Показано, что недостающие 8 мкМ свободного тубулина связаны белком RB3-SLD, причем на одну молекулу белка, как и следовало ожидать, приходится два димера тубулина.
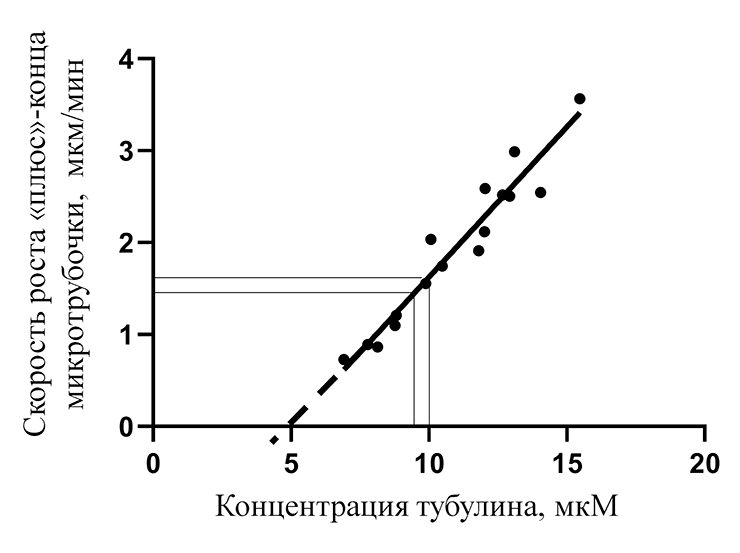
Но в случае с колхицином и другими ингибиторами дело обстоит не так просто. Если бы колхицин действовал так же, то мы бы пришли к очевидному противоречию. Действительно, скорость роста микротрубочки линейно увеличивается при повышении концентрации свободного тубулина (рис. 6). Причем характерные значения концентрации свободного тубулина в растворе — микромолярные — на два порядка больше тех концентраций, в которых колхицин может значительно влиять на динамику всей микротрубочки. Допустим, что концентрация свободного тубулина 10 мкМ, а концентрация колхицина 400 нМ. Хорошо известно, что в таких условиях почти весь свободный колхицин может связаться с растворенным тубулином, причем на один димер тубулина будет приходиться одна молекула колхицина. Концентрация тубулина, связанного с колхицином, в данном растворе будет примерно равна начальной концентрации колхицина. В таком случае концентрация тубулина, участвующего в росте микротрубочки, упадет на 400 нМ, то есть всего на 4%.
Взглянув на рисунок 6, можно понять, что такое незначительное изменение в концентрации свободного тубулина почти никак не повлияет на величину скорости роста микротрубочки. Однако результаты многочисленных экспериментов говорят о том, что в этих условиях поведение микротрубочки меняется драматически — она перестает расти полностью [37]. Это действительно интригующий результат, так как получается, что воздействие этих ингибиторов в малых концентрациях основано на более сложном, до сих пор неизвестном механизме. Сегодня можно с уверенностью утверждать, что ингибиторы тубулина значительно изменяют динамику микротрубочки, только когда окажутся непосредственно на ней. В случае с колхицином это может произойти, например, если димер тубулина сначала свяжется с ним, а затем присоединится к концу микротрубочки. Однако детальный механизм воздействия на данном уровне до сих пор неизвестен. В этом контексте только начинают появляться экспериментальные данные, основанные на попытках наблюдать отдельные молекулы ингибиторов в составе микротрубочки.
Рисунок 6. Зависимость скорости роста «плюс»-конца микротрубочки от концентрации свободного тубулина (точки — эксперимент [38], линия — аппроксимация)
Знакомимся с каждой молекулой лично
Исследование фундаментальных механизмов, лежащих в основе столь значительного воздействия ингибиторов тубулина на микротрубочки, возможно благодаря развитию передовых техник световой микроскопии и созданию высокочувствительных фотодетекторов. Одна из таких техник позволяет взглянуть на отдельные молекулы и основана на флуоресцентной микроскопии. Это с первого взгляда кажется нереальным, потому что хорошо известно, что разрешающая способность световой (в том числе флуоресцентной) микроскопии, то есть минимальный размер объекта, который мы способны с ее помощью разглядеть, существенно ограничена. Законы оптики позволяют нам в данном случае различить частицу размером несколько сотен нанометров, в то время как размеры большинства молекул, в том числе перечисленных ингибиторов, гораздо меньше. Но барьеры нужны для того, чтобы их кто-то преодолевал, и ученые в последние годы смогли оказаться «по ту сторону дифракционного барьера» [39], [40].
В нашем случае преодоление этого барьера также основано на флуоресцентных свойствах веществ. В самом общем понимании флуоресценция представляет собой физическое явление, при котором вещество испускает собственное излучение при воздействии на него другим источником света [41]. Флуоресцентными свойствами обладают некоторые вещества, в числе которых есть известные белки (например GFP) и другие органические или неорганические молекулы и кристаллы. Одна из основных особенностей флуоресценции этих молекул заключается в том, что с течением времени по разным причинам всегда происходит так называемое фотообесцвечивание — явление, при котором собственное излучение вещества необратимо «угасает», причем за достаточно продолжительное время угасание происходит полностью. Причиной тому может служить химическая модификация флуоресцентных молекул в результате взаимодействия с радикалами кислорода, образующимися под воздействием света [42]. Здесь важно отметить, что «угасание» происходит подобно тому, как перегорает лампочка, то есть резко и в самый неожиданный момент.
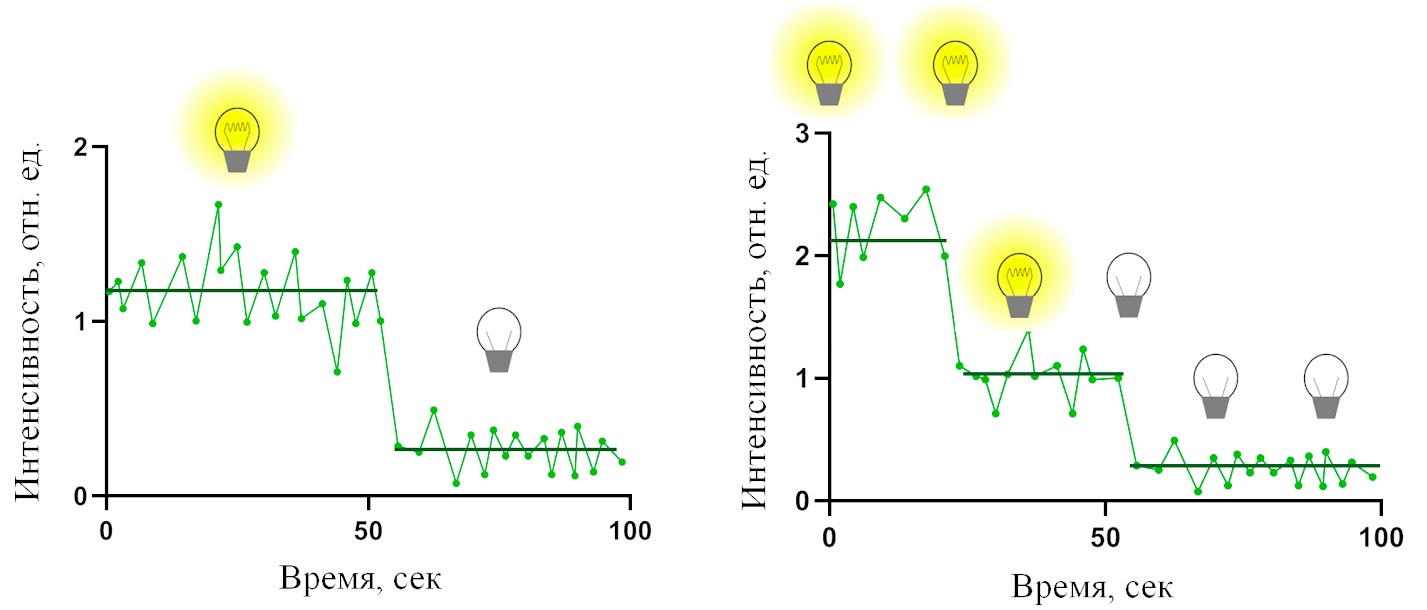
Такая, казалось бы, бесполезная и даже вредная особенность флуоресценции лежит в основе одного из методов детектирования отдельных молекул. Он заключается в том, что сначала на поверхность стекла прикрепляют как можно более тонким слоем исследуемые молекулы. Для этого используют очень небольшие концентрации вещества — всего десятки наномоль/литр или даже меньше. После этого включают возбуждающее излучение, заставляя эти молекулы светиться, и ждут, пока не произойдет полное фотообесцвечивание светящихся частичек на стекле в исследуемой области. Далее следует обработка полученных экспериментальных данных — именно с ее помощью мы узнаем, удалось ли нам наблюдать флуоресценцию отдельной молекулы, и как она выглядит (то есть измерим ее интенсивность). Обработка заключается в том, чтобы построить зависимость интенсивности флуоресценции отдельной светящейся частички от времени (рис. 7) [43], [44].
Рисунок 7. Зависимость интенсивности флуоресценции нескольких молекул от времени. Примеры слева и справа соответствуют фотообесцвечиванию одной и двух флуоресцентных молекул соответственно. В приведенных примерах видно, что «угасание» флуоресценции этих частичек происходит в виде «ступенек», то есть довольно быстро и только в определенные моменты времени. Эти графики достаточно просто интерпретировать, зная свойства фотообесцвечивания флуоресцентного вещества: каждая такая частичка может состоять из одной или нескольких молекул, и ее «угасание» в таком случае происходит вследствие «угасания» одной молекулы (если ступенька одна) или последовательного «угасания» нескольких молекул (в таком случае наблюдается соответствующее число ступенек). Благодаря этим графикам мы знаем интенсивность флуоресценции отдельной молекулы по высоте одной ступеньки и можем сделать вывод, удалось ли нам все-таки наблюдать отдельные молекулы в качестве светящихся частичек на стекле.
Применительно к исследованию отдельных молекул ингибиторов на микротрубочке это позволяет, например, определить их количество. В данном методе существенным считается наличие у исследуемых частиц ярко выраженных флуоресцентных свойств. К сожалению, колхицин, таксол, винбластин и некоторые другие ингибиторы тубулина сами по себе ими не обладают. Тем не менее существует возможность модифицировать эти молекулы, добавив к ним флуоресцирующий кусочек — другую молекулу. Естественно, такая модификация может повлиять на их свойства, поэтому необходимо сначала убедиться, что свойства модифицированных молекул (нас интересуют, в первую очередь, характеристики воздействия на тубулин и микротрубочки) такие же, как и у немодифицированных. Затем, зная интенсивность флуоресценции отдельной молекулы при одних условиях, можно определить количество этих молекул, например на микротрубочке, в другом эксперименте с теми же условиями наблюдения.
Таким образом удалось определить, что молекулы химически модифицированного эрибулина, сайт связывания которого находится рядом с местом прикрепления винбластина, располагаются только на самом «плюс»-конце микротрубочки [45]. При больших концентрациях растворенного вещества на «плюс»-конце обнаруживается примерно 13 этих молекул, что соответствует количеству протофиламентов в микротрубочке. Это наблюдение подтверждает данные рентгеноструктурного анализа, проведенного в этой же работе, о том, что эрибулин связывается с β-мономером тубулина на его стыке с соседним α-мономером вдоль одного протофиламента. Таким образом, единственное место на микротрубочке, где может возникать незакрытый α-мономером сайт связывания эрибулина, располагается на β-мономерах тубулина в самом последнем ряду тубулинов «плюс»-конца микротрубочки, поэтому в микротрубочке есть ровно 13 таких мест, где мог бы связаться эрибулин. Кроме того, выяснилось, что всего одной молекулы флуоресцирующего эрибулина достаточно для нарушения структуры растущего конца микротрубочки и даже для переключения фазы роста на фазу укорочения! Аналогичным образом удалось исследовать присоединение отдельных молекул флуоресцирующего «кузена» таксола к микротрубочкам [26]. Именно такие «одномолекулярные» эксперименты позволили пролить свет на стабилизирующий эффект таксола, о котором мы упоминали.
Что нам предстоит еще изучить?
Знакомя читателя с важнейшими представителями «зоопарка» ингибиторов тубулина, мы описали только три основных класса ингибиторов в зависимости от их сайта связывания. До недавнего времени считалось, что сайты связывания колхицина, таксола и винбластина исчерпывают все разнообразие вариантов присоединения различных молекул ингибиторов к тубулину. Однако сейчас становится ясно, что это далеко не так. Речь идет о результатах недавно опубликованной статьи [13], где приводятся структуры закристаллизованных комплексов, аналогичных тому, что мы рассматривали, когда говорили про колхицин и винбластин. В эти комплексы удалось поместить другие ингибиторы, и оказалось, что количество различных мест, в которых они могут связываться с белком тубулином, больше трех — по меньшей мере шесть. Очевидно, разнообразие рассматриваемого «зоопарка» еще богаче.
Ясно, что мы только начинаем понимать какие-то основные характеристики воздействия различных ингибиторов на микротрубочки в системах с очищенным тубулином. Такие системы позволяют нам проводить эксперимент в более простых условиях по сравнению с невероятно биохимически сложной средой живой клетки, для того чтобы прицельно решить конкретную задачу. Но чтобы понять, как эти ингибиторы воздействуют на клетки и организм в целом, как их можно использовать в медицине, необходимо учитывать кроме тубулина наличие других внутриклеточных белков. Такие белки, ассоциированные с микротрубочками, — гораздо более сложные и разнообразные молекулы по сравнению с относительно простыми молекулами ингибиторов. К ним относится упомянутый белок семейства статминов RB3-SLD. Другой пример — белки семейства EB (аббревиатура от англ. End Binding), название которого отражает их уникальную способность распознавать растущие концы микротрубочек и следовать за ними [46]. Эти молекулы тоже влияют на динамическую нестабильность микротрубочки [47]. Естественно ожидать, что разнообразие эффектов от всех этих молекул на микротрубочки очень велико — настолько, что даже сложно себе представить. Природа, действительно, богаче нашего воображения. Уже показано, что EB-белки увеличивают чувствительность микротрубочек к ингибиторам, то есть в некотором смысле усиливают их воздействие [48]. Более того, одновременное воздействие ингибиторов тубулина и различных белков, ассоциированных с микротрубочками, может быть сложнее, чем простая сумма эффектов от этих веществ. Подобные синергетические свойства поведения характерны для всего живого, и в случае с микротрубочками обнаруживаются по драматическому изменению их динамики. Например, выяснилось, что стабилизирующий эффект таксола многократно усиливается в присутствии еще одного специального белка XMAP215, который сам по себе ускоряет рост микротрубочек, но не столь сильно [49].
Всё это бесконечное разнообразие молекул ингибиторов тубулина и их эффектов служит не только увлекательной головоломкой для ученых, но и «стратегическим» запасом в химиотерапии. К сожалению, раковые клетки способны привыкать к используемым препаратам. За счет возможности избавляться от чужеродных ядов, таких как ингибиторы тубулина, а также благодаря способности нейтрализовать их действие с помощью разных белков, у клетки есть шанс избежать гибели, которым она может воспользоваться [50]. Однако среди запаса новых веществ из представленного «зоопарка» часто удается найти подходящую молекулу, которая становится перспективным противоопухолевым препаратом.
Первоначальная версия данной статьи была опубликована в журнале «Природа» [51].