хронический гранулематоз что это
Хронический гранулематоз что это
При хронической гранулематозной болезни нейтрофилы и моноциты сохраняют способность поглощать каталазаположительные микроорганизмы, но из-за отсутствия метаболитов кислорода не уничтожают их. Это заболевание встречается редко (4-5:1 000 000) и наследуется рецессивно. Причиной служат мутации генов, кодирующих компоненты НАДФ-оксидазы (одного на Х-хромосоме и трех аутосомных генов).
Генетика и патогенез хронической гранулематозной болезни. Активация НАДФ-оксидазы в нейтрофилах требует сборки в клеточной мембране отдельных субъединиц фермента. Вначале происходит фосфорилирование катионного цитоплазматического белка p47phox (белок «оксидазы фагоцитов» с молекулярной массой 47 кДа). Фосфорилированный p47phox вместе с двумя другими цитоплазматическими компонентами оксидазы — р67phox и низкомолекулярной гуанозинтрифосфатазой (Rac-2) — транслоцируется в клеточную мембрану, где все эти белки взаимодействуют с цитоплазматическими доменами трансмембранного флавоцитохрома b558, образуя активную оксидазу.
Флавоцитохром представляет собой гетеродимер, состоящий из двух пептидов — p22phox и богатого углеводными остатками gp91phox. Согласно современной модели, три трансмембранных домена N-концевой части флавопротеида содержат остатки гистидина, определяющие связывание гема. Пептид р22phoxстабилизирует gp91phox. Роль p40phox в активации оксидазы остается неясной. Пептид gp91phox необходим для транспорта электронов с участием НАДФ-, флавин- и гемсвязывающего доменов. Пептид р22phox не только стабилизирует gp91phox, но и содержит сайты связывания цитоплазматических субъединиц фермента. Цитоплазматические р47phox, р67phox и Rac-2, по-видимому, играют регуляторную роль, активируя цитохром b558.
Примерно 2/3 больных с хронической гранулематозной болезнью — это мужчины, наследующие мутации расположенного на Х-хромосоме гена, который кодирует gp91phox, а 1/3 больных аутосомно-рецессивно наследуют мутацию гена, кодирующего р47phox (хромосома 7). Около 5% больных аутосомно-рецессивно наследуют дефекты генов р67phox (хромосома 1) и р22phox (хромосома 16).
Нормальная фагоцитарная функция нейтрофилов требует активации НАДФ-оксидазы. Электроны переносятся с НАДФ-Н на флавин, затем на гемовую простетическую группу цитохрома b558 и, наконец, на молекулярный кислород, приводя к образованию О2-. При неэффективном функционировании этой системы О2- не образуется.
Нарушения окислительного обмена в нейтрофилах при хронической гранулематозной болезни создают условия для выживания микробов. Среда в вакуолях фагоцитов остается кислой, и бактерии не перевариваются. Окраска макрофагов больных гематоксилин-эозином выявляет золотистый пигмент, отражающий накопление в клетках поглощенного материала, что и лежит в основе диффузного гранулематоза, давшего название этой патологии.
Клинические проявления хронической гранулематозной болезни
Подозревать хроническую гранулематозную болезнь следует у любого больного с повторными или необычными лимфаденитами, печеночными абсцессами, множественным остеомиелитом, частыми инфекциями в семейном анамнезе или инфекциями, вызываемыми каталазаположительными микробами (например, S. aureus).
Клинические признаки и симптомы хронической гранулематозной болезни могут возникать как в грудном, так и в раннем зрелом возрасте. Частота возникновения и тяжесть инфекционных заболеваний крайне непостоянны. Возбудителем обычно является S. aureus, хотя возможно инфицирование любыми другими каталазаположительнымим микроорганизмами. К частым возбудителям инфекций относятся Serratia marcescens, Burkhoderia cepacia, Aspergillus, Candida albicans и Salmonella. Обычно возникают пневмонии, лимфадениты и поражения кожи.
Осложнения хронических инфекций включают анемию, лимфаденопатию, гепатоспленомегалию, хронический гнойный дерматит, рестриктивные нарушения, гингивит, гидронефроз и стеноз привратника. На возможность хронической гранулематозной болезни указывают также парапроктиты и повторные кожные инфекции, в том числе фолликулиты, гранулемы и дискоидная красная волчанка. Гранулемы и воспалительные процессы, если они вызывают стеноз привратника, сужение мочеиспускательного канала или свищи прямой кишки, напоминающие болезнь Крона, требуют безотлагательного подтверждения диагноза.
Хроническая гранулематозная болезнь (ХГБ)
, MD, PhD, Cleveland Clinic Lerner College of Medicine at Case Western Reserve University
Клинические проявления
Множественные гранулематозные поражения отмечаются в легких, печени, лимфоузлах, желудочно-кишечном и мочеполовом трактах (вызывая обструкцию). Часто встречаются гнойные лимфадениты, гепатоспленомегалия, пневмония, имеются гематологические признаки хронических инфекций. Имеют место также абсцессы кожи, лимфоузлов, легких, печени, перианальные абсцессы; стоматиты, остеомиелиты.
Рост может замедляться.
Хроническое гранулематозное заболевание у Х-сцепленных носителей гена gp91 phox может протекать бессимптомно или проявляться различными, обычно менее тяжелыми, симптомами, включая боль в суставах с волчаночноподобным синдромом, афтозными язвами, хориоретинальными поражениями и светочувствительностью (1 Справочные материалы по симптоматике Хроническая гранулематозная болезнь характеризуется неспособностью БКТ продуцировать активные формы кислорода и фагоцитировать микроорганизмы. Проявления включают рецидивирующие инфекции; множественные. Прочитайте дополнительные сведения ).
Справочные материалы по симптоматике
1. Battersby AC, Braggins H, Pearce MS, et al: Inflammatory and autoimmune manifestations in X-linked carriers of chronic granulomatous disease in the United Kingdom. J Allergy Clin Immunol 140:628–630, 2017.
Диагностика
Метод проточной цитометрии респираторных смывов
Постановка диагноза хронической гранулематозной болезни осуществляется путем определения продукции радикалов кислорода с помощью проведения оксидантной реакции (респираторного смыва) методом проточной цитометрии с использованием дигидрородамина 123 (ДГР) или нитросинего тетразолия (НСТ). Этот тест также помогает определить женщин-носительниц Х-сцепленных и рецессивных форм заболевания. При этих формах анализ с использованием DHR показывает 2 популяции фагоцитов, нормальные и пораженные.
Генетическое тестирование проводят для подтверждения дефекта генов и не является обязательным при постановке диагноза. В скором времени после постановки диагноза обычно проводят скрининг родственных доноров, как правило, с использованием ДГР.
Могут возникать гипергаммаглобулинемия и анемия; повышаться скорость оседания эритроцитов (СОЭ).
Лечение
Профилактическая терапия антибиотиками и противогрибковыми препаратами
Обычно используют интерферон-гамма
При тяжелых инфекциях применяют трансфузию гранулоцитов
Трансплантация гемопоэтических стволовых клеток
Терапия хронической гранулематозной болезни представляет собой неперывный профилактический прием антибиотиков, в частности, триметоприма/сульфаметоксазола 160/800 мг перорально 2 раза в день. Пероральные противогрибковые средства назначены в качестве первичной профилактики или добавлены, если грибковые инфекции встречаются даже единожды; наиболее полезными являются:
Итраконазол перорально каждые 12 часов (100 мг для пациентов 50 кг)
Вориконазол перорально каждые 12 часов (100 мг для пациентов весом
Позаконазол (400 мг перорально 2 раза в день)
Интерферон гамма может уменьшить тяжесть и частоту инфекций и обычно включен в схемы лечения. Препарат обычно назначают в дозе 50 мкг/м 2 подкожно 3 раза/неделю.
Трансфузия гранулоцитов будет спасительной при тяжелых инфекционных процессах.
Генная терапия еще изучается.
Основные положения
Следует подозревать хроническую гранулематозную болезнь (ХГБ) в случаях, если у пациентов в детском возрасте наблюдались периодические абсцессы (иногда не позже подросткового возрасте), особенно если патоген являлся каталаза-продуцирующим микроорганизмом (например, Staphylococcus aureus, Escherichia coli, представители родов Serratia, Klebsiella или Pseudomonas, грибки).
Для диагностики ХГБ и идентификации носителей проводят оксидантную реакцию методом проточной цитометрии.
Для большинства пациентов применяют терапию профилактическими антибиотиками, противогрибковыми препаратами и гамма-интерфероном.
При серьезных инфекциях применяют трансфузию гранулоцитов.
Рассматривают возможность пересадки гемопоэтических стволовых клеток
Что такое гранулематоз Вегенера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Беляевой Е. А., ревматолога со стажем в 26 лет.
Определение болезни. Причины заболевания
Данный васкулит относится к группе АНЦА-ассоциированных, так как при нём выявляются специфические антитела к цитоплазме нейтрофилов (АНЦА) со специфичностью к таким ферментам, как миелопероксидаза и протеиназа-3.
Гранулематоз с полиангиитом одинаково часто встречается как среди мужчин, так и среди женщин. Обычно он развивается в возрасте около 40 лет. Тяжесть заболевания значительно варьирует.
Симптомы гранулематоза Вегенера
В начале заболевания могут преобладать неспецифические симптомы: боли в мышцах и суставах, потеря массы тела, лихорадка, слабость. В отдельных случаях заболевание распространяется только через несколько лет после его первых нетяжёлых проявлений.
В целом гранулематоз с полиангиитом поражает:
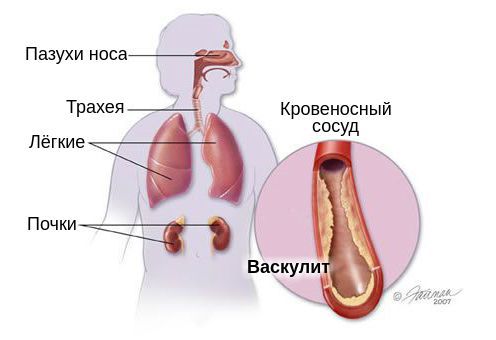
Поражение верхних дыхательных путей является самым частым симптомом ГПА. Типично появление насморка с гнойно-кровянистым отделяемым, изъязвление полости носа, развитие синуситов (воспаление пазух носа).
Гранулематозный синусит встречается примерно в 90 % случаев. От других синуситов он отличается наличием гранулём — скоплением и отграничением клеток в очагах воспаления. Внешне гранулёмы выглядят как небольшие узелки до 3 см в диаметре. Их развитие заканчивается распадом и изъязвлением. В связи с этим гранулематозные синуситы часто осложняются гнойной инфекцией, что может потребовать назначения дополнительной активной антибактериальной терапии.
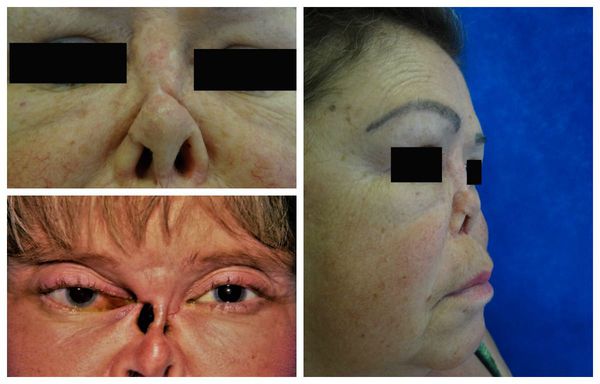
Распад гранулём в полости носа способен привести к перфорации носовой перегородки, западению спинки носа (седловидной деформации), разрушению верхнечелюстной пазухи и орбиты.
Помимо носа изъязвления могут возникать в полости рта и глотки, в трахее и гортани. В гортани возможно формирование подскладочной гранулёмы. Самостоятельно больной её не увидит — это может сделать только врач во время ларингоскопии (обследования гортани). При этой патологии может наблюдаться огрубение голоса и даже обструкция (сужение) верхних дыхательных путей.
Другим признаком болезни может стать рецидивирующий серозный или гнойный средний отит. Он возникает из-за воспаления слизистой глотки и обструкции слухового канала. Если острый средний отит у взрослого пациента возник впервые, то ему обязательно нужно обследоваться, чтобы исключить ГПА.
Типичным симптомом ГПА является поражение лёгких. Оно чаще всего возникает на поздних этапах болезни, но иногда возможно и в начале заболевания. Больной жалуется на кашель, боль в грудной клетке, одышку. При выслушивании лёгких наблюдается ослабленное дыхание, сухие и/или влажные хрипы. Эти проявления вызваны образованием в лёгких множественных двусторонних инфильтратов, которые распадаются и формируют полости с жидкостью. Данные изменения напоминают признаки абсцедирующей пневмонии или туберкулёза — такие диагнозы нередко ошибочно ставят больным с васкулитом.
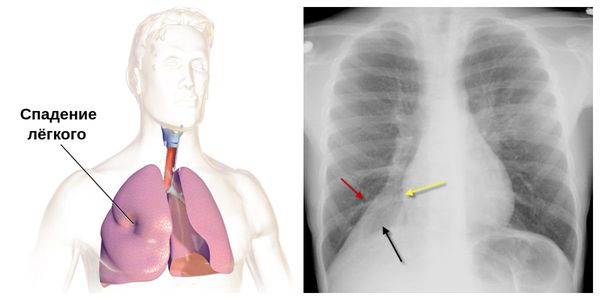
В результате распада ткани и разрушения сосудов может возникнуть кровохарканье и лёгочное кровотечение. У небольшой части больных образование инфильтратов протекает бессимптомно. Иногда возникает плеврит, увеличиваются лимфоузлы средостения. Возможны очаговые ателектазы (спадение лёгочной ткани) и пневмоторакс (воздух в плевральной полости).
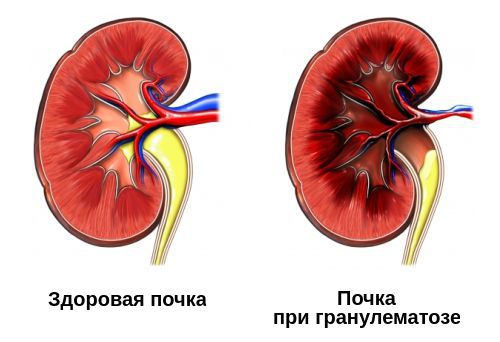
На поражение почек — гломерулонефрит — будут указывать:
Большинство перечисленных проявлений гломерулонефрита можно выявить только при лабораторной диагностике. Самостоятельно пациент может обратить внимание только на отёки и повышение артериального давления. Иногда пациент может заметить изменение цвета мочи и уменьшение её количества.
Большое клиническое значение имеет поражение глаз. Возможно развитие следующих патологий:
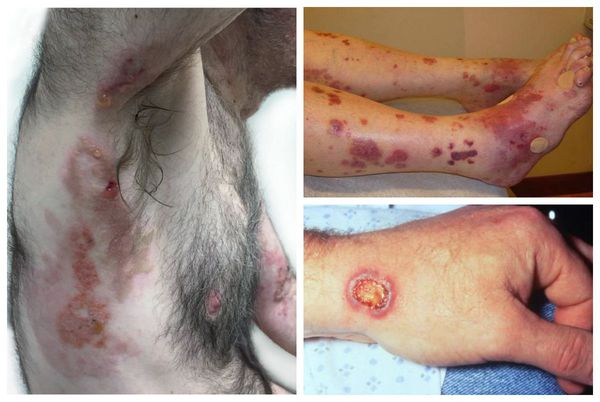
Кожа при ГПА поражается в 40-50 % случаев. На ней появляются специфические высыпания: узелки, папулы, пузырьки, язвы. Одним из вариантов поражения кожи может быть гангренозная пиодермия. Она начинается с образования мелких гнойничков и пузырьков, сливающихся между собой. В дальнейшем наблюдается омертвение тканей и образование глубоких болезненных дефектов на коже, покрытых гнойным отделяемым.
Поражения суставов разнообразны: могут возникать как артралгии (боли в суставах), так и артриты, несимметричные и симметричные, напоминающие ревматоидный артрит. Они не сопровождаются костными эрозиями и деформациями суставов, в отличие от истинного ревматоидного артрита. При этом в крови у 50 % больных присутствует ревматоидный фактор. Он может привести к ошибочной постановке диагноза «ревматоидный артрит».
Со стороны нервной системы при ГПА могут возникать множественные мононевриты, невриты черепных нервов, полинейропатия, церебральная ишемия. Проявлениями полинейропатии являются парестезии — ощущения «ползания мурашек», «ударов током», онемения, жжения, жара или холода. При мононевритах возможна потеря чувствительности, нарушение движений и атрофия мышц в зонах иннервации поражённого нерва. К симптомам церебральной ишемии относятся: частые головные боли, головокружение, шум в голове и/или ушах, нарушение памяти и внимания, слабость, повышенная утомляемость, нарушение сна, раздражительность, депрессивное настроение.
Сердечно-сосудистая система поражается крайне редко: возможен перикардит, коронариит (воспаление коронарных сосудов), гранулематозный миокардит с нарушением ритма и проводимости. При этих поражениях у больного может появляться клиника стенокардии: приступы загрудинных болей давящего и сжимающего характера, одышка, усиливающаяся при физической нагрузке, слабость, ощущение «перебоев» в работе сердца, головокружения.
Поражение пищеварительного тракта сопровождается болями в животе, диареей, кровотечениями из-за изъязвлений кишечника.
Патогенез гранулематоза Вегенера
Патогенез васкулитов не до конца расшифрован. Не исключено, что пусковым механизмом их развития может быть перенесённая инфекция.
Повреждение сосудов возникает после активации нескольких иммунных и неиммунных механизмов. При ГПА в поражении сосудов участвуют антитела против лизосомных ферментов нейтрофилов (АНЦА), также имеет место нарушение клеточного иммунного ответа и образование гранулём.
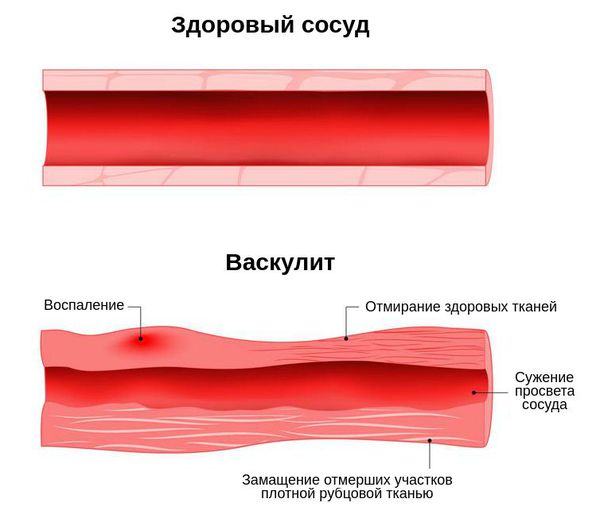
Для заболевания характерен процесс некроза. В основном он наблюдается в сосудах микроциркуляторного русла, т. е. в самых мелких сосудах. Поражаются все три оболочки сосуда. Формируются некротизирующие гигантоклеточные гранулёмы, склонные к распаду. Воспалительный процесс заканчивается склерозом артерий — они становятся менее эластичными, их просвет уменьшается.
Некротизирующие гранулёмы располагаются в основном в органах, контактирующих с внешней средой, — дыхательные пути, желудочно-кишечный тракт. Такие гранулёмы склонны к быстрому распространению, охвату большой площади поражения и распаду. Гранулёмы в почках и печени (органах, не имеющих прямого контакта с внешней средой) содержат много фибробластов и склонны к рубцеванию.
Классификация и стадии развития гранулематоза Вегенера
Существуют классификационные критерии гранулематоза с полиангиитом:
Для оценки активности васкулита применяют Бирмингемский индекс активности (BVAS) и индекс повреждения органов и систем (VDI). Бирмингемский индекс активности включает в себя девять групп симптомов в зависимости от локализации поражения, каждому симптому в группе присваивается свой балл. По сумме баллов врач определяет активность заболевания на момент визита больного. Индекс повреждения оценивает тяжесть необратимых повреждений органов и систем.
Выделяют два типа ГПА:
Осложнения гранулематоза Вегенера
Гранулематозное воспаление верхних дыхательных путей может осложняться стенозом гортани и трахеи (т. е. их сужением), которое требует наложения трахеостомы. Она позволяет пациенту свободно дышать.
При распаде гранулём тяжёлым осложнением становится перфорация трахеи с угрозой развития медиастинита — бактериального воспаления органов средостения. Медиастинит является потенциально смертельным осложнением.
Средний отит может осложниться парезом лицевого нерва — слабостью мимических мышц, которое возникает из-за поражения нерва и нарушения проведения нервных импульсов. Также осложнением среднего отита может быть разрушение височных костей, развитие облитерирующего или осиффицирующего лабиринтита (воспаления среднего уха с последующим разрастанием костной ткани и развитием тугоухости) и потеря слуха.
Следствием поражения лёгких становится лёгочный фиброз. Он становится причиной дыхательной недостаточности и предрасполагает к развитию инфекционных процессов. Дыхательная недостаточность может развиваться по трём типам:
Поражение лёгких также может привести к коллапсу бронхов (ограничению воздушного потока из-за сужения просвета бронхов более чем на 50 %), постобструктивной пневмонии, вызванной как типичными, так и нетипичными возбудителями — пневмоцистами, грибами, микоплазмами и др.
Присоединение пневмонии всегда очень опасно. Она может стать причиной смерти. Также возможны инфаркты лёгкого. Они возникают в результате нарушения локального кровотока и приводят к некрозу (гибели) лёгочной ткани и замещению её соединительной.
Из-за обструкции крупных бронхов возможен ателектаз (потеря воздушности) сегмента или доли лёгкого. Возможны случаи развития острой дыхательной недостаточности из-за пневмоторакса и ателектазов. Редко могут возникать лёгочные кровотечения из-за эрозии и разрушения лёгочной ткани.
Диагностика гранулематоза Вегенера
Ранняя диагностика васкулита необходима. Она позволяет своевременно начать терапию и предотвратить развитие необратимых изменений в организме больного. Для постановки диагноза используются:
При типичном течении с одновременным поражением ЛОР-органов, лёгких и почек постановка диагноза обычно не вызывает затруднений.
К характерным лабораторным признакам гранулематоза с полиангиитом относятся: наличие лейкоцитоза, тромбоцитоза, ускоренной СОЭ (скорости оседания эритроцитов) в общем анализе крови. Может обнаруживаться ревматоидный фактор. Повышается уровень СРБ (С-реактивного белка) — важнейшего маркера воспаления. Примерно в 70-80 % случаев выявляются АНЦА к миелопероксидазе и протеиназе-3 в повышенном или нарастающем титре.
В анализах мочи преимущественно выявляют протеинурию (повышенное содержание белка), цилиндурию (белковые слепки канальцев) и гематурию (наличие эритроцитов в моче). О нарушении функции почек свидетельствует нарастание уровня креатинина и мочевины в сыворотке крови.
При риноскопии в полости носа можно выявить истончённую слизистую оболочку, множественные эрозии, язвы, перфорацию носовой перегородки; в области раковин можно обнаружить бугристую гранулематозную ткань. При пункции верхнечелюстной пазухи гной обычно не получают.
Для диагностики изменений в лёгких используют рентгенографию и компьютерную томографию (последний метод предпочтительней). На полученных снимках выявляют инфильтративные изменения, полости с жидкостью, плеврит, ателектазы, фиброз и др. КТ высокого разрешения позволяет обнаружить изменения, которые невозможно выявить при рентгенографии: утолщение стенки бронхов, сужение гортани, трахеи и бронхов, признаки поражения лёгочных сосудов.
При бронхоскопии можно обнаружить эрозивный бронхит, сужение и рубцовую деформацию бронхов. В бронхо-альвеолярном лаваже (смывах) преобладают такие клетки крови, как нейтрофильные лейкоциты, макрофаги, эозинофилы.
Лечение гранулематоза Вегенера
Все больные с первично выявленным заболеванием подлежат госпитализации. Другими показаниями для стационарного лечения являются:
Лечение включает в себя три этапа:
Для индукции ремиссии при поражении жизненно важных органов назначаются глюкокортикостероиды (преднизолон, метилпреднизолон) в сочетании с циклофосфамидом (вводится внутривенно) или генно-инженерный биологический анти-В-клеточный препарат — ритуксимаб.
Лечение циклофосфамидом может продолжаться от 3 до 12 месяцев. Для профилактики пневмоцистной пневмонии на длительный период назначают ко-тримоксазол (бисептол).
Глюкокортикоиды сначала применяют внутривенно в виде пульс-терапии. Она предполагает введение высоких доз метилпреднизолона — 0,5-1 мг/кг массы тела — в течение трёх дней. После этого переходят на таблетированную форму препарата.
Ритуксимаб назначают при непрерывно рецидивирующем течении васкулита, при неэффективности циклофосфамида или противопоказаниях к его применению. В период лечения до введения циклофосфамида и через семь дней после этого необходимо исследовать общий анализ крови и мочи, выяснить уровень креатинина и ферментов печени — АСТ, АЛТ.
Для индукции ремиссии у больных без поражения жизненно важных органов может использоваться метотрексат (при отсутствии поражения почек) в дозе 20-25 мг в неделю и мофетила микофенолат в дозе 1-2 г в день в сочетании с таблетированными глюкокортикостероидами.
При тяжёлом поражении почек для сохранения их функции в дальнейшем может быть применён плазмаферез. В случае необходимости трансплантация почки проводится в период ремиссии при низком титре АНЦА. В дальнейшем этим больным назначают циклоспорин А и микофенолат мофетил.
Для поддержания ремиссии используются низкие дозы глюкокортикостероидов в сочетании с одним из препаратов: азатиоприном, ритуксимабом, микофенолата мофетилом, метотрексатом. Метотрексат может применяться у пациентов без тяжёлого поражения почек и лёгких. При противопоказаниях к назначению азатиоприна может быть применён лефлуномид.
Самостоятельное лечение заболевания недопустимо. Оно должно осуществляться только врачом, имеющим опыт лечения больных с системными васкулитами.
Прогноз. Профилактика
ГПА — это хроническое заболевание, оно остаётся с человеком на всю жизнь. Поэтому на протяжении болезни могут наблюдаться периоды с различной выраженностью клинических проявлений.
Профилактика осложнений лекарственной терапии:
Современные представления о хронической гранулематозной болезни (ХГБ)
Хроническая гранулематозная болезнь (ХГБ) — достаточно неплохо изученное на сегодняшний день наследственное заболевание, связанное с недостаточностью фагоцитарной системы, следствием которой является иммунодефицит. Впервые ХГБ была описана в 1959 году у детей, для которых болезнь оказалась смертельной [1]. Болезнь не поддавалась лечению; на аутопсии выявляли генерализованное гранулематозное воспаление, отличающееся по своей специфике от известных на тот момент инфекционных и неинфекционных заболеваний.
Сегодня нам известно намного больше. Заболевание в большинстве случаев более не является смертельным, выявляется в основном у детей (врожденный иммунодефицит проявляется достаточно быстро), неплохо купируется. Однако до сих пор ХГБ относится к заболеваниям неизлечимым.
Этиология и патогенез
Сущность хронической гранулематозной болезни — в недостаточности фермента НАДФ-оксидазы, который представляет собой комплекс каталитических протеинов. Этот фермент, находясь в фагоцитирующих клетках, обеспечивает перенос электрона с НАДФ на молекулярный кислород: происходит т. н. «респираторный взрыв» (см. Рис. 1). Строго говоря, данный фермент есть не только у фагоцитов: единственным специфичным для них белком является трансмембранный gp91, остальные же компоненты встречаются в самых разных клетках [2].
Обратимся к рисунку 1. Белки gp91 и p22 объединяют в цитохром b558 — мембраносвязанную часть фермента НАДФ-оксидазы, остальные протеины называют цитозольными. При активации фагоцита различными медиаторами цитозольные p47 и p67 фосфорилируются и связываются вместе. Комплекс приобретает сродство к белкам p47 и rac2 — таким образом, присоединяясь к ним, данные протеины вызывают конформационные изменения в мембранном цитохроме b558, — и комплекс приобретает оксидазную активность [2, 5]. НАДФ-оксидаза переносит электрон от своего кофермента НАДФ на кислород с формированием активных форм кислорода (АФК) — O 2- и H2O2. Вот здесь и начинается самое интересное.
Классически считается, что фагоцит убивает микробы, образуя фаголизосому с бактерией или грибом, воздействуя на них большими дозами высокотоксичных АФК; однако в последнее время приобретает актуальность иная точка зрения. В 2002 году в Nature была опубликована статья, авторы которой пересмотрели всю парадигму деактивации поглощенных микробов.
Ученые обнаружили, что если в фагоцитах мышей определяется нормальный уровень активных форм кислорода, но имеется недостаточность лизосомальных ферментов — животные будут беззащитны против стафилококковых и кандидозных инфекций. То есть, несмотря на наличие нормального респираторного взрыва, иммунодефицит все равно присутствует. Стало быть, эффекторами в инактивации микроба являются не сами АФК [6].
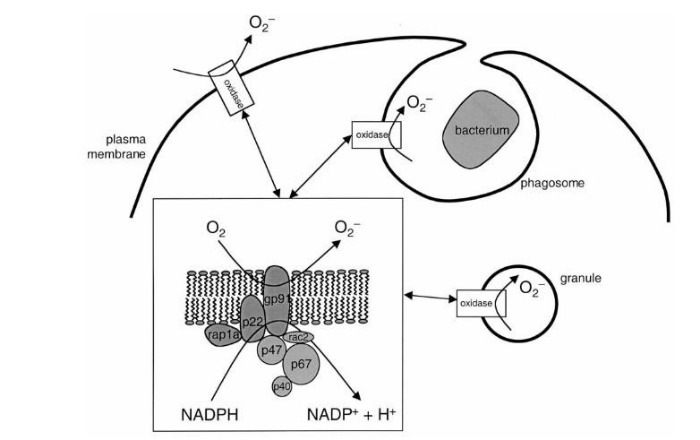
Согласно новой модели, АФК являются медиаторами в уничтожении микроба, а непосредственные «убийцы» — ферменты лизосом, обладающие протеолитической активностью. Как известно, при захвате фагоцитом микроба формируется вакуоль — (фагосома), с которой впоследствии сливается лизосома макрофага [7]. На мембране этой вакуоли и функционирует НАДФ-оксидаза, постоянно увеличивая концентрацию АФК. Однако как уже было сказано, данный процесс — не конечный эффекторный механизм.
Наследование и генетика
Хроническая гранулематозная болезнь имеет наследственную природу. Приблизительно данной патологией страдает 1 на 250 000 [9], что делает заболевание достаточно редким и потому трудным в диагностическом отношении. Заболевание вызывает мутация любого из четырех генов, кодирующих субъединицы ключевого фермента фагоцитоза НАДФ-оксидазы. Более двух третей случаев связаны с X-сцепленным наследованием (дефект гена CYBB, кодирующего белок p-91); остальные случаи связаны с аутосомно-рецессивным наследованием генов CYBA, NCF-1 и NCF-2, кодирующих белки p22, p47 и p67 соответственно. Исходя из этого болезнь обозначают как ХГБ X91, A22, A47 и A67 (в зависимости от типа наследования и локуса гена) [10].
Примечательно, что в литературе нет (или крайне мало) доказанных случаев наследственного дефекта других субъединиц. Однако в последнее время обнаруживаются все новые мутации генов, следствием которых становится ХГБ: например, в 2009 году выделили еще один подвид ХГБ, связанный с аутосомно-рецессивной мутацией гена p-40 [11], имеются также сведения о единственном пациенте с недостаточностью белка Rac2 — [10]. Вполне вероятно, что могут существовать и другие генетические патологии, вызывающие данное заболевание.
Диагностика
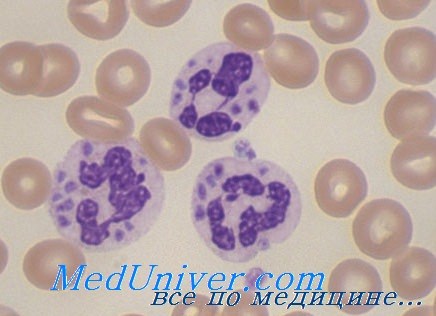
Диагностика ХГБ основана на выявлении клинических признаков, кроме того, важно выявить наличие или отсутствие респираторного взрыва. Последнее можно осуществить несколькими гистологическими и иммунологическими методами, например, окрашивание нитросиним тетразолием (НТЗ) позволяет определить, вырабатывают ли клетки АФК — НТЗ будет утилизироваться активными формами кислорода, в результате чего из бледно-желтого тетразолия образуется голубой формазан [12].
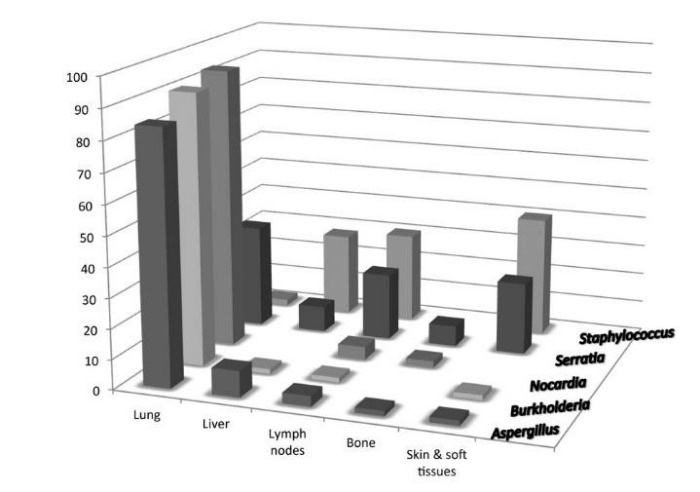
Среди наиболее ярких клинических симптомов можно выделить: пиодермию, пневмонию, воспалительные процессы желудочно-кишечного тракта, лимфаденит, абсцесс печени и остеомиелит [13] на фоне рецидивирующих бактериальных и грибных инфекций.
В крови выявляется гипергаммаглобулинемия и анемия. В местах дренажей — хроническое воспаление с образованием гранулем. Также гранулемы могут формироваться в различных тканях и органах: например, в желудке гранулематозное воспаление способно привести к обструкции желудочного канала, в урогенитальном тракте — к циститу. Также следует упомянуть, что почти 20 % больных ХГБ страдает от гранулематозного колита, который легко перепутать с болезнью Крона [14].
Также следует упомянуть о недавно открытой бактерии, выявленной у пациентов с ХГБ, которую исследователи предложили назвать Granulobacter bethesdensis. Это грамотрицательная палочка, которая на данный момент не может быть отнесена ни к одной из существующих таксономических групп; бактерия поражает лимфоузлы, кроме того, резистентна к антибиотикам in vitro и, скорее всего, — in vivo [18, 19]. Предполагается, что это — лишь первая из подобных бактерий, возникшая в эру антибиотиков. На данный момент Granulobacter bethesdensis не слишком распространена, однако имеет к этому весьма опасную тенденцию.
Лечение
В настоящее время активно разрабатываются методики, которые смогут не просто позволить больным с ХГБ жить полноценно, но и в перспективе совершенно избавить их от бремени заболевания. Поскольку болезнь наследственная, крайне трудно придумать что-то существенное, однако такие попытки предпринимаются, и некоторые из них обнадеживают.
Одна из них — лечение хронической гранулематозной болезни с помощью генной инженерии [20]. В 2006 году в Nature Medicine была опубликована статья, авторы которой сообщили об успешной коррекции генома двух пациентов с X-сцепленной формой ХГБ. После лечения у пациентов определяли активность нейтрофилов с помощью позитронно-эмиссионной томографии, а также других инструментальных методов. Исследование показало, что в обоих случаях фагоциты после проведенного лечения смогли оказать сопротивление инфекции. На данный момент это — одна из самых многообещающих методик.
Еще одним способом терапии является пересадка гемопоэтических клеток [21]. Двадцати семи пациентам после миелоаблативного режима кондиционирования (подготовка пациента к трансплантации с помощью лучевой или цитостатической терапии — прим. автора) пересадили гемопоэтические стволовые клетки от наиболее подходящих доноров (по белкам HLA — главного комплекса гистосовместимости). Двадцать три пациента вполне успешно перенесли операцию, а дальнейшее наблюдение позволило говорить об излечении этих пациентов от хронической гранулематозной болезни. Однако еще 4 пациента умерли от последующих инфекций (15 %).
В остальном же современная медицина может предложить крайне немного. Это — патогенетическая и симптоматическая терапия с использованием антибиотиков, дренажей и прочего. Излишне говорить, что подобное лечение не способно избавлять пациентов от ХГБ.
Профилактика инфекций.
Крайне важно предотвращение развития инфекционного процесса. Пациенты с ХГБ испытывают невероятные трудности в повседневной жизни, например, некачественная чистка зубов спокойно может окончиться гингивитом, а царапина — тяжелой бактериемией. Потому больным необходимо тщательным образом следить за гигиеной, выполнять профессиональную чистку зубов, обрабатывать все царапины антисептиком. И, разумеется, такие пациенты должны быть привиты по всем правилам [14]. В противном же случае даже достаточно простая инфекция может окончиться летально.
Источники: