холангиокарцинома что за болезнь
Холангиокарцинома
Злокачественная опухоль, исходящая из мелких клеток эпителия внутрипеченочных билиарных протоков.
Что провоцирует / Причины Холангиокарциномы:
Паразитарные заболевания и глистные инвазии способствуют развитию данной опухоли.
Патогенез (что происходит?) во время Холангиокарциномы:
Значительную распространенность карциномы печени на Дальнем Востоке связывают с часто встречающимися у местного населения дизентерией и описторхозом. При тотальных поражениях толстой кишки риск заболевания повышается на 10 %. Циррозы печени не предрасполагают к холангиокарциноме, но вторичный билиарный цирроз может развиться на фоне обструкции опухолью.
Симптомы Холангиокарциномы:
Особенности клинических проявлений. В клинике доминирует желтуха. Клиническая картина характеризуется болью в верхних отделах живота, анорексией, слабостью, похудением при периферическом росте опухоли. При холангиокарциноме, расположенной в области ворот печени, одним из первых симптомов служит желтуха, гепатомегалия.
Диагностика Холангиокарциномы:
Особенности диагностики. При лабораторном исследовании выявляют гипербилирубинемию, резкое повышение активности ЩФ и других ферментов холестаза. афетопротеин обычно не обнаруживают. Сцинтиграфия с технецием, золотом и фитоном указывает на наличие дефектов наполнения. Обструкцию билиарного дерева выявляют при чрескожной чреспеченочной холангиографии и ретроградной холангиопанкреатографии. Морфологически холангиоцеллюлярный рак печени имеет слаборазвитую капиллярную сеть и богатую строму (см. рис. XXXV цветной вклейки).
Дифференциальная диагностика проводится с первичным билиарным циррозом, метастазами в ворота печени из опухолей другой локализации.
Лечение Холангиокарциномы:
Лечение холангиокарциномы:
Лечебная тактика аналогична предыдущей форме заболевания.
Прогноз:
К каким докторам следует обращаться если у Вас Холангиокарцинома:
Холангиокарцинома что за болезнь
Рак билиарного тракта – это группа опухолей, развивающихся из эпителия внутри- и внепеченочных желчных протоков (холангиокарциномы), а также желчного пузыря [1]. Термин холангиокарцинома подразумевает 3 типа опухолей с различными факторами риска, свойствами и лечебными подходами – это внутри- и внепеченочные опухоли, а также поражение желчных протоков ворот печени, относящееся к опухолям внепеченочной локализации (опухоль Клацкина). Считается, что на опухоли билиарного тракта приходится около 3% от всех опухолей желудочно-кишечного тракта (ЖКТ), внутрипеченочные холангиокарциномы составляют около 10% случаев первичного рака печени, среди холангиокарцином на опухоль Клацкина приходится 50% случаев, из них на опухоли дистальной локализации – 40%, внутрипеченочное поражение встречается в 10% случаев [1]. В среднем заболеваемость холангиокарциномой в США составляет 1,26 случая на 100 000 населения [1,2].
Холангиокарцинома исконно считалась опухолью с печальным прогнозом. Хирургическое лечение до настоящего времени было единственным возможным более-менее эффективным подходом. Тем не менее, даже оно является вариантом лечения только 35% пациентов [3], из которых еще 35% впоследствии имеют рецидив в течение 2 лет [4]. На протяжении 10 лет стандартом первой линии терапии у больных местно-распространенной или метастатической холангиокарциномой остается химиотерапия на основе комбинации гемцитабина и цисплатина, что приводит к медиане общей выживаемости в 11,7 мес. [5]. При прогрессировании болезни на первой линии эффективных опций ранее не существовало. Попытки использовать различные химиотерапевтические режимы как в монотерапии, так и в комбинациях не увенчались успехом 6. Чтобы не оставить пациента без лечения, в качестве последующей терапии эмпирически назначаются фторпиримидины, их комбинации с оксалиплатином или иринотеканом [1].
Изменения FGFR встречаются в среднем у 7,1% всех онкологических пациентов [10], являются мишенью терапии некоторых опухолей ЖКТ, например, рака желудка [11,12]. Холангиокарцинома относится к опухолям с наиболее частыми альтерациями FGFR. Так, перестройки и слияния в генах FGFR, особенно FGFR2, были выявлены у 6,1-16% больных [10,13,14]. Следовательно, закономерным было разработать и изучить ингибиторы FGFR2 у этих пациентов.
17 апреля 2020 года Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA) в ускоренном порядке одобрило первый ингибитор FGFR1-3 пемигатиниб для лечения больных метастатической холангиокарциномой, имеющих слияние или перестройки в гене FGFR2 и получивших стандартную химиотерапию [15]. Решение FDA было основано на результатах многоцентрового, открытого исследования 2 фазы FIGHT-202 [16]. В нем исследователи скринировали 1206 пациентов, из которых у 107 больных были выявлены слияния или перестройки в гене FGFR2, определяемые тестом Foundation One. Пемигатиниб назначался в дозе 13,5 мг перорально, ежедневно в течение 21-дневного цикла (2 недели лечения, 1 неделя перерыва). Первичной конечной точкой была частота объективных ответов у больных с молекулярными изменениями FGFR2.
Имея такие результаты, несомненно, можно согласиться с решением FDA одобрить пемигатиниб для лечения столь агрессивной опухоли, продолжительность жизни больных которой, не ответивших на первые линии терапии, не превышала ранее 6,5-13,4 мес. Пемигатиниб увеличивает эту цифру не менее чем в 2 раза. В настоящее время анонсировано и продолжается исследование 3 фазы FIGHT-302 [17]. В нем пемигатиниб сравнивается с комбинацией гемцитабина и цисплатина в первой линии терапии метастатической холангиокарциномы с перестройками в гене FGFR2.
Результаты исследования эффективности второго ингибитора FGFR1-3 инфигратиниба были представлены в виде значимого устного доклада (late-breaking abstract) на конгрессе ESMO 2018 [18]. Пациенты с холангиокарциномой, резистентной к стандартной терапии, получали инфигратиниб в дозе 125 мг перорально ежедневно в течение 21 дня 28-дневного цикла до неприемлемой токсичности, прогрессирования заболевания или отзыва согласия. Первичной конечной точкой была подтвержденная общая частота ответов по оценке исследователей. Вторичные конечные точки включали выживаемость без прогрессирования, частоту контроля над болезнью, общую выживаемость и безопасность.
В исследование был включен 71 пациент (62% женщин; медиана возраста 53 года) со слиянием/транслокацией FGFR2. При предварительном анализе медиана продолжительности лечения составляла 5,5 месяца, а продолжительности наблюдения – 8,4 месяца, при этом 62 пациента прекратили лечение. Частота всех объективных ответов (подтвержденных и неподтвержденных) была 31,0%, частота подтвержденных ответов – 26,9%. У пациентов, получивших ≤1 предыдущую линию терапии, частота была выше – 39,3% по сравнению с пациентами, получившими ≥2 линии, – 17,9%. Контроль над болезнью был достигнут в 83,6% случаев. Ответ на лечение продолжался в среднем 5,4 месяца. Медиана выживаемости без прогрессирования составила 6,8 месяца. Медиана общей выживаемости была 12,5 месяца. Наиболее частыми нежелательными явлениями любой степени тяжести были гиперфосфатемия (73,2%), утомляемость (49,3%), стоматит (45,1%), алопеция (38,0%), запор (35,2%). Токсичность 3-4 степени имела место у 47 пациентов (66,2%), включая гипофосфатемию (14,1%), гиперфосфатемию (12,7%) и гипонатриемию (11,3%). На основании этих результатов FDA выдало разрешение на ускоренное проведение клинического исследования 3 фазы (PROOF 301), в котором инфигратиниб изучается в первой линии терапии FGFR2-позитивной холангиокарциномы [19]. В исследованиях 1 и 1/2 фаз находится еще ряд FGFR-ингибиторов, в том числе футибатиниб, деразантиниб, Debio1347 и эрдафениб.
Другим направлением в таргетной терапии метастатической холангиокарциномы является ингибирование IDH. Мутация IDH встречается в клетках внутрипеченочных холангиокарцином в 10-20% случаев [20,21]. IDH имеет 3 изоформы, из которых в канцерогенезе наибольшую роль играют IDH1 и IDH2. Чаще встречаются мутации IDH1, чем IDH2. Соматические мутации IDH1/2 появляются на ранних этапах развития опухоли. Повышение активности IDH1/2 приводит к изменениям клеточного метаболизма и последующей аккумуляции метаболита 2-гидроксиглютарата как в опухолевых клетках, так и в крови, который блокирует клеточную дифференцировку и индуцирует туморогенез. Прогностического интереса мутации IDH1/2 не представляют, однако являются отличной мишенью для блокирования.
Низкомолекулярный ингибитор ивосидениб блокирует IDH1 в клетках холангиокарциномы, несущих данную мутацию. Его эффективность была изучена в международном, многоцентровом, рандомизированном исследовании 3 фазы (ClarIDHy) [22]. 230 пациентов с IHD1-позитивной метастатической холангиокарциномой, резистентной к стандартной химиотерапии, были распределены в соотношении 2:1 в группу ивосидениба (500 мг перорально, ежедневно, в течение 28-дневного цикла; N=124) или в группу плацебо (N=61). В исследовании допускался кроссовер. Выживаемость без прогрессирования была главным критерием эффективности.
При медиане наблюдения 6,9 мес. пациенты, получавшие ивосидениб, имели достоверно лучшую выживаемость без прогрессирования по сравнению с группой плацебо (HR=0,37; P
Опухоль Клацкина
Опухоль Клацкина (синонимы: рак в области ворот печени, воротная, хилярная, перихилярная холангиокарцинома) — разновидность холангиокарциномы, злокачественной опухоли, которая развивается из клеток, выстилающих изнутри стенки желчных протоков. Это агрессивное новообразование длительно протекает бессимптомно, зачастую диагностируется на поздних стадиях и сопровождаются неблагоприятным прогнозом. Единственный способ избавиться от опухоли Клацкина — радикальное хирургическое вмешательство, но на момент установления диагноза более чем у половины больных его уже невозможно выполнить. Чаще всего этот тип холангиокарциномы обнаруживают у людей старше 60 лет.
Холангиоцеллюлярный рак — злокачественные опухоли желчного пузыря и желчных протоков — составляет 3% от всех онкологических заболеваний. В России ежегодно диагностируются 3–4 тысячи новых случаев. В зависимости от того, в каких желчных протоках развивается злокачественная опухоль, выделяют три разновидности холангиокарцином:
Факторы риска
К факторам риска развития холангиокарцином и, в частности, опухоли Клацкина относят:
Симптомы опухоли Клацкина
Наиболее распространенное проявление хилярной холангиокарциномы — желтуха, состояние, при котором кожа и белки глаз окрашиваются в желтый цвет. Это происходит того, что злокачественная опухоль нарушает отток желчи, то есть в данном случае это механическая желтуха. Обычно она свидетельствует о запущенном заболевании. Помимо изменения цвета кожи, таких пациентов беспокоит зуд, их моча становится темной, а стул светлым. Причина этих симптомов в том, что билирубин — соединение, которое образуется при распаде гемоглобина — не выделяется с желчью в кишечник, а поступает в кровь.
Чаще всего сначала возникает желтуха, а спустя некоторое время начинает беспокоить зуд. Иногда, наоборот, зуд становится первым симптомом.
На момент диагностики заболевания примерно треть пациентов отмечают, что в последнее время сильно потеряли в весе. На поздних стадиях опухоль Клацкина вызывает тупые боли под ребрами справа.
Закажите обратный звонок. Мы работаем круглосуточно
Методы диагностики
Обычно при подозрении на поражение печени и желчных протоков обследование начинают с УЗИ, потому что этот метод диагностики самый простой, быстрый и доступный. Он может выявить расширение желчных протоков, но плохо визуализирует саму опухоль, не дает возможности оценить ее размеры, степень распространения в окружающие ткани, лимфатические узлы, брюшину.
Намного более информативна компьютерная томография с внутривенным введением контраста. КТ позволяет оценить размеры и локализацию злокачественной опухоли, в 60–90% случаев точно разобраться, возможна ли радикальная операция, выявить поражение соседних структур в воротах печени, лимфатических узлах.
Холангиография — процедура, во время которой в желчные протоки вводят рентгеноконтрастное вещество и выполняют рентгенографию. Чаще всего проводят эндоскопическую ретроградную холангиопанкреатографию (ЭРХПГ): контраст вводят во время эндоскопии двенадцатиперстной кишки с помощью тонкого катетера. Если ее проведение невозможно, выполняют чрескожную чреспеченочную холангиографию с помощью иглы, введенной через кожу. В настоящее время холангиография при подозрении на рак желчных протоков считается менее предпочтительной по сравнению с КТ и МРТ. Тем не менее, она, в отличие от двух этих процедур, позволяет провести другие важные манипуляции:
Главный вопрос, на который должен ответить врач по результатам обследования пациента с холангиокарциномой: можно ли выполнить операцию в достаточном объеме, чтобы удалить злокачественную опухоль?
Стадии, классификация
Стадию опухоли Клацкина определяют в соответствии с общепринятой системой TNM, которая предусматривает оценку размера и других характеристик первичной опухоли (T), поражения регионарных лимфатических узлов (N), наличия отдаленных метастазов (M).
Выделяют следующие стадии заболевания:
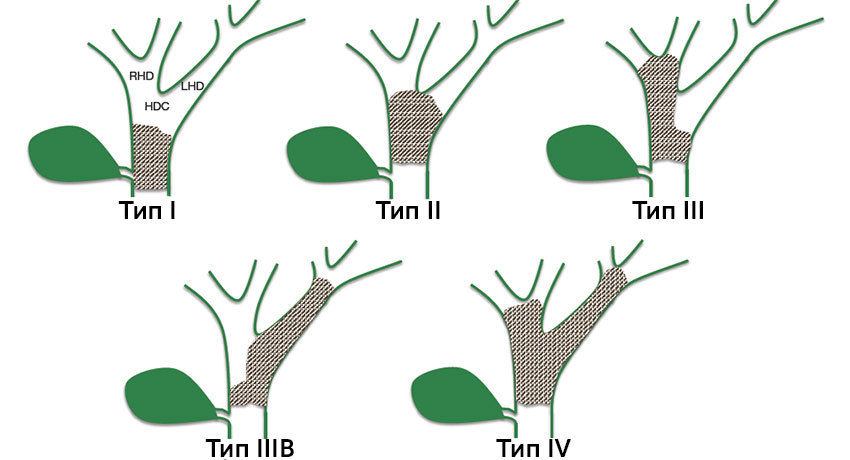
Кроме того, чтобы обозначить расположение злокачественной опухоли, при хилярных холангиокарциномах используют специальную классификацию по Висмуту — Корлетту:
В зависимости от характера роста, опухоли Клацкина делят на три типа: склерозирующие, узелковые и папиллярные. Чаще всего встречаются склерозирующие — они растут в толщу стенки желчных протоков. Узелковые и папиллярные растут в просвет. Наиболее благоприятными считаются папиллярные, они чаще всего являются резектабельными.
Методы лечения
Единственный метод лечения, который позволяет полностью избавиться от опухоли Клацкина и значительно повысить выживаемость — радикальная операция. К ней прибегают при стадиях заболевания. Выполняют резекцию печени, удаляют желчные протоки и регионарные лимфатические узлы.
При механической желтухе операция сопряжена с высоким риском осложнений, поэтому предварительно нужно восстановить отток желчи. В настоящее время для этого зачастую прибегают к стентированию. В заблокированный участок желчных протоков устанавливают стент — небольшую трубку с сетчатой стенкой из металла. Для этого не нужно делать разрезов или проколов на брюшной стенке — манипуляцию проводят во время эндоскопии двенадцатиперстной кишки. Спустя 4–6 недель можно выполнить хирургическое вмешательство.
При резекции печени важно, чтобы осталась достаточно большая часть органа, которая могла бы справляться с его функциями. Если ожидается, что объем оставшейся печеночной ткани будет менее 25%, за 3–5 недель до хирургического вмешательства целесообразно провести эмболизацию ветвей воротной вены. За счет этого происходит гипертрофия ткани печени, и после операции удается сохранить ее больший объем. Это помогает предотвратить печеночную недостаточность.
Некоторым пациентам с неоперабельной опухолью Клацкина может быть предложена трансплантация печени.
При неоперабельном раке в области ворот печени применяют химиотерапию (обычно сочетание гемцитабина с препаратами платины), лучевую терапию.
В ряде случаев применяется фотодинамическая терапия (ФДТ). Пациенту внутривенно вводят особое соединение — фотосенсебилизирующий агент, который накапливается в раковых клетках, и затем активируют его с помощью света. В итоге образуются свободные радикалы, которые уничтожают опухолевые клетки.
Рак желчных протоков
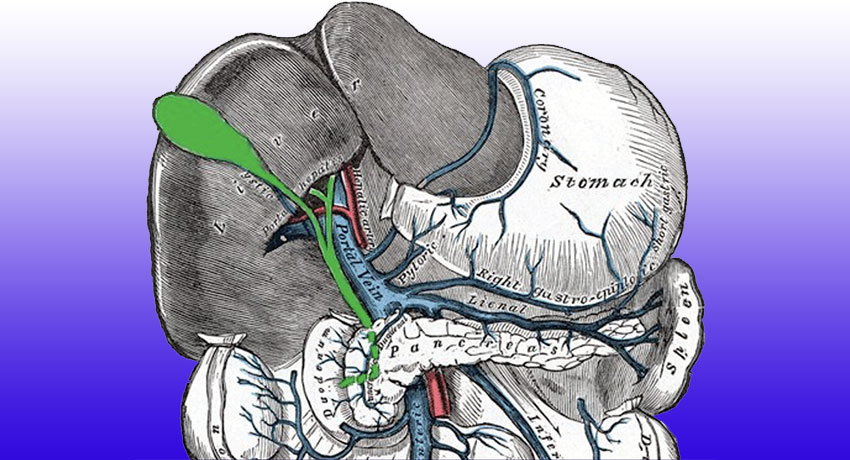
Рак желчных протоков (холангиокарцинома, ХК) встречается довольно редко, из-за поздней диагностики и особенностей расположения внутри тела сложно поддается лечению. Из печени желчь поступает в желчный пузырь, а оттуда — в кишечник по древовидной системе протоков — тонким трубкам, которые объединяются в сегментарные, потом в долевые протоки и наконец — в общий (холедох). Первичный очаг может располагаться на любом участке этого пути.
Причины мутаций в клетках до сих пор не изучены, к факторам риска относятся воспалительные процессы, кисты и другие аномалии развития, описторхоз и прочие заболевания, вызываемые паразитами, вирусные гепатиты В и С, цирроз, язвенный колит, желчнокаменная болезнь. Чаще ХК диагностируется у мужчин, чем у женщин, в возрасте старше 65 лет.
Нам доверяют 9500 пациентов ежегодно.
Классификация
По гистологическому признаку, то есть типу клеток, из которых развилась опухоль, разделяют аденокарциномы (около 90% всех случаев), лимфомы, саркомы, плоскоклеточную форму. По месту локализации:
В развитии холангиокарцином выделяют, как для большинства злокачественных опухолей, 4 стадии — от первой, когда не затрагиваются соседние ткани, до четвертой, на которой процесс распространился на отдаленные органы и лимфоузлы.
Рак желчных протоков: симптомы и диагностика
В начале развития болезни симптоматика может отсутствовать. Из-за нарушения оттока желчи появляются:
По мере развития раковой интоксикации отмечаются слабость, утомляемость, тошнота и рвота, потеря аппетита.
Все эти признаки не говорят однозначно о раке протоков желчного пузыря или другой этиологии, но при появлении каких-либо из них необходимо как можно скорее обратиться к врачу. Для установления диагноза используются трансабдоминальное или эндоскопическое УЗИ, холангиография с вводом контрастного вещества, биопсия, МРТ и КТ, лапароскопия. При этом по возможности уточняется локализация — из-за расположения довольно сложно разграничить рак желчных протоков головки поджелудочной железы или печени от онкологии самих этих органов.
Медицинский директор, врач онколог-хирург, к.м.н
Лечение
В зависимости от специфики опухоли, состояния пациента и анамнеза определяется лечебная тактика. При раке желчных протоков операция является основным методом, однако зачастую опухоль оказывается неоперабельной. В некоторых случаях после удаления требуется трансплантация. Оперативные манипуляции могут носить и паллиативный характер. Радио- и химиотерапия дополняют традиционную хирургию, а на поздних стадиях лучевые методики часто выступают как альтернатива скальпелю для облегчения состояния пациента.
При подозрении или подтвержденном онкологическом диагнозе обратитесь в клинику НАКФФ. Опыт специалистов онкоцентра и современная техническая база позволяют эффективно бороться с болезнью. Записаться на предварительную консультацию можно по тел. +7 (495) 259-44-44 или через форму на сайте.
Последние новости
Последние статьи
Рейтинг: 4.8/5 Голосов: 125
Холангиокарцинома что за болезнь
В настоящей статье представлена актуальность и краткое понимание основных факторов, ответственных за клеточную пролиферацию и механизмы развития внутрипеченочного холангиоцеллюлярного рака. Освещены современные вопросы диагностики и лечения этого заболевания.
В настоящей статье представлена актуальность и краткое понимание основных факторов, ответственных за клеточную пролиферацию и механизмы развития внутрипеченочного холангиоцеллюлярного рака. Освещены современные вопросы диагностики и лечения этого заболевания.
В патогенезе нарушения клеточной пролиферации при ХЦР играют роль следующие молекулярные факторы: рецептор эпидермального фактора роста (epidermal growth factor receptor (EGFR)), RAS/митоген-активированная протеинкиназа (RAS/mitogen-activated protein kinase (MAPK)), интерлейкин-6 (IL-6) и рекомбинантный белок человека met proto-oncogene (hepatocyte growth factor receptor, MET). В процессе развития ХЦР важную роль играют генетические механизмы, вызывающие безграничную репликационную активность (активация теломеразы обратной транскриптазы (telomerase reverse transcriptase (TERT)), уклонение от апоптоза (циклооксигеназа-2 (COX-2), белки BCL-2), неоангиогенез (сосудистый эндотелиальный фактор роста (VEGF) и ангиопоэтин-2), инвазию и метастазирование (гиперэкспрессия матричных металлопротеиназ и подавление белка E-cadherin) [23].
По макроскопическим характеристикам различают узловую, перипротоковую инфильтративную, внутрипротоковую и смешанную узловую с перипротоковой инфильтрацией формы (Рис. 1). Узловая форма характеризуется образованием узла, хорошо отграниченного от окружающей паренхимы, чаще всего при этой форме ХЦР возникают внутрипеченочные метастазы. Перипротоковая инфильтративная ХЦК растет в паренхиме печени по ходу портальных триад, часто метастазирует в лимфатические узлы ворот печени. Внутрипротоковая инфильтративная форма имеет хороший прогноз, однако встречается редко. Узловую с перипротоковой инфильтрацией (смешанный тип роста) относят к агрессивным формам ХЦК, сопровождающуюся низкой продолжительностью жизни, эта форма редко встречается в Европе [29].
Специфических симптомов при внутрипеченочной холангиокарциноме нет. В большинстве случаев клинические проявления отмечаются при запущенных стадиях опухоли, когда в процесс вовлекаются желчные протоки, при этом появляются боли в правом подреберье, кожный зуд, желтуха, а также общая симптоматика (общая слабость, снижение веса, ухудшение аппетита) [29].
К симптомам внутрипеченочного ХЦР, выявляемым при КТ и УЗИ, можно отнести расширение периферических желчных протоков, а также слабое накопление стромой опухоли контрастного препарата в отсроченную фазу. Специфических серологических маркеров ХЦР в настоящее время не существует. Диагноз устанавливается на основании исключения ГЦР и метастатических опухолей (анамнез, данные лучевых методов обследования). В серологической диагностике на вероятный диагноз ХЦР указывает повышение СЕА и СА 19-9. Окончательной является гистологическая диагностика, как правило, с применением иммуногистохимии (ИГХ). Основная панель ИГХ-маркеров включает CK7, CK20, CDX-2, TTF-1, ER, PR, BRST-2 и PSA, которая позволяет исключить метастазы первичного рака толстой кишки, легких, молочных желез и простаты. Внутрипеченочный ХЦР проявляет наиболее сильное окрашивание на CK7 и СK19, отрицателен или слабо положителен на CK20 и практически всегда отрицателен на другие маркеры [20]. Определение уровня CA 19-9 может помочь в диагностике ХЦР, однако чувствительность и специфичность метода составляют 62% и 63%, соответственно. Повышенный уровень CA 19-9 также выявляется у пациентов с доброкачественными заболеваниями, такими как бактериальный холангит или холедохолитиаз. Тем не менее, очень высокие уровни CA 19-9 (более 1000 Ед/мл) в ряде исследований связаны с метастазами ХЦР. Таким образом, этот анализ может быть использован при определении стадии заболевания [19].
Лечебная тактика зависит от стадии заболевания по TNM. Стадирование ХЦР основано на таких прогностических характеристиках, как количество узлов, наличие сосудистой инвазии, прорастание опухоли за пределы печени и вовлечение желчных протоков NCCN Guidelines (Version2.2016) (Табл. 1–5).
Таблица 1. Количество узлов (T)
Таблица 2. Региональные лимфатические узлы (N)
| Nx | Региональные лимфатические узлы не поддаются оценке |
| N0 | Нет метастазов в региональные лимфатические узлы |
| N1 | Имеются метастазы в региональные лимфатические узлы |
Таблица 3. Отдаленные метастазы (M)
Таблица 4. Распределение ХЦР по стадиям
| 0 | Tis | N0 | M0 |
| I | T1 | N0 | M0 |
| II | T2 | N0 | M0 |
| III | T3 | N0 | M0 |
| IVA | T4 Любое T | N0 N1 | M0 M0 |
| IVB | Любое T | Любое N | M1 |
Таблица 5. Степень дифференцировки (G)
| G1 | Высоко дифференцированная |
| G2 | Средняя степень дифференцировки |
| G3 | Низкая степень дифференцировки |
| G4 | Недифференцированная |
Стандарты ведения пациентов с внутрипеченочным ХЦР со степенью доказательности 2A также отражены в NCCNGuidelines (Version2. 2016). Резекция печени показана при резектабельных формах [5, 9]. При малом объеме остатка печени или ее функциональной недостаточности проводится портоэмболизация [18, 28].
Обширные резекции печени желательно выполнять при снижении уровня билирубина ниже 34 мкмоль/л (