хлорид натрия что это такое в моющих средствах
Журнал «Сырье и Упаковка»
Текущий номер
Ближайшие выставки
Партнеры
Гипохлориты и их применение в средствах бытовой химии
30.03.2020
| Д. А. Меркулов, к.х.н., зав. кафедрой фундаментальной и прикладной химии, ФГБОУ ВПО «Удмуртский государственный университет», г. Ижевск |
Введение
Гипохлоритами называют соли хлорноватистой кислоты HClO. Наиболее распространенными из них являются гипохлорит натрия, гипохлорит кальция и гипохлорит калия. Гипохлориты широко применяются для обеззараживания питьевой воды, отбеливания, дегазации и дезинфекции. Гипохлориты являются одними из самых важных химических соединений.
| Систематическое наименование | Традиционное название | Хим. формула | CAS № | М, г/моль |
|---|---|---|---|---|
| Гипохлорит натрия | Хлорноватистокислый натрий, лабарракова вода (гипохлорит натрия в смеси с хлоридом натрия и гидроксидом натрия) | NaClO | 7681–52–9 | 74,44 |
| Гипохлорит калия | Хлорноватистокислый калий, жавелевая вода (гипохлорит калия в смеси с гидрокарбонатом калия и хлоридом калия) | KClO | 7778–66–7 | 90,55 |
| Гипохлорит кальция | Хлорноватистокислый кальций, хлорная известь (гипохлорит кальция в смеси с хлоридом кальция, оксихлоридом кальция и гидроксидом кальция) | Ca(ClO) 2 | 7778–54–3 | 142,98 |
История открытия
В 1774 г. шведский химик Карл Вильгельм Шееле получил хлор (Cl 2 ) в результате взаимодействия оксида марганца(IV) MnO 2 и соляной кислоты (HCl). Позже, в 1785 г. французский химик Клод Луи Бертолле обнаружил, что водный раствор газообразного хлора («хлорная вода»), содержащий хлорноватистую и хлороводородную кислоты, может отбелить белье, и сообщил о своих выводах Французской академии наук.
Cl 2 + H 2 O = HClO + HCl
Знания об отбеливающих свойствах хлора были незамедлительно использованы Джеймсом Уаттом на текстильной фабрике в Глазго. Несмотря на то, что отбеливание с использованием хлора был значительно эффективнее традиционных способов отбеливания солнечным светом, слабыми растворами кислот и щелочей, применение хлора ограничивалось его токсичностью и разрушающим действием на ткани. Для стабилизации раствора газообразного хлора в воде и безопасности его применения, в 1787 г. на Парижском предприятии Societe Javel хлор стали пропускать через водный раствор карбоната калия (поташа)
Cl 2 + K 2 СO 3 = 2KHCO 3 + KClO + KCl.
Глава предприятия Леонард Альбан назвал новый продукт «Eau de Javel» («жавелевая вода»), и вскоре белильная жидкость стала популярной во Франции и Англии.
В 1820 г. француз Антуан Лабаррак усовершенствовал способ получения отбеливателя, заменив поташ на более дешевый гидроксид натрия (каустическую соду). Полученный раствор гипохлорита и хлорида натрия получил название «Eau de Labarraque» («лабарракова вода»).
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Широкое применение гипохлоритов для обеззараживания питьевой воды и дезинфекции стало возможным гораздо позже, в начале XX века, благодаря развитию промышленного производства хлора электролизом поваренной соли.
Физические свойства
Гипохлориты встречаются нам преимущественно в виде водных растворов, хотя некоторые из них можно выделить в твердом виде. Так, известен безводный гипохлорит натрия, который представляет собой неустойчивое бесцветное кристаллическое вещество. Из кристаллогидратов наиболее устойчивой формой является NaClO×5H 2 O. Это соединение представляет собой белые или бледно-зеленые ромбические кристаллы, расплывающиеся на воздухе. При нагревании пентагидрата гипохлорита натрия до температуры 24,4°С, он плавится. Кристаллогидрат NaClO×2,5H 2 O плавится при температуре 57,5°С. Моногидрат крайне неустойчив и разлагается выше 60°С, при более высоких температурах разложение протекает со взрывом.
Таблица 2. Плотности и температуры замерзания водных растворов гипохлорита натрия.
В отличие от гипохлорита калия, известного только в растворах, гипохлорит кальция можно выделить в форме бесцветных кристаллов, устойчивых в сухой атмосфере без углекислого газа. Из водных растворов гипохлорит кальция можно выделить в виде кристаллогидратов Ca(ClO) 2 ×2H 2 O, Ca(ClO) 2 ×3H 2 O, Ca(ClO) 2 ×4H 2 O.
Кислотно-основное равновесие между хлорноватистой кислотой и гипохлорит-ионом описывается обратимой реакцией с константой равновесия Ka = 2,63×10 –8 при 20°С.
Используя константу равновесия Ka, можно рассчитать мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от рН (рис.1).
Данные свидетельствуют, что при подкислении растворов гипохлоритов увеличивается доля неустойчивой хлорноватистой кислоты. При рН 7,58 существуют преимущественно гипохлорит-ионы.
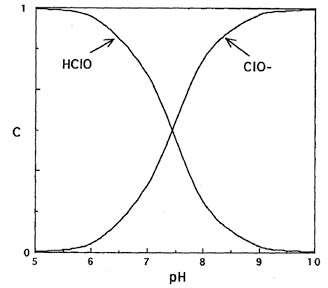
Рис. 1. Мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от кислотности среды.
Химические свойства
Гипохлориты являются неустойчивыми соединениями, легко разлагающимися с выделением кислорода. Разложение твердых гипохлоритов натрия и кальция можно представить уравнениями
2NaClO = 2NaCl + O 2 ↑ и 2Сa(ClO) 2 = СaCl 2 + O 2 ↑.
Процессы при комнатной температуре происходят медленно, а при нагревании могут протекать со взрывом. Параллельно реакциям, сопровождающимся образованием хлоридов и свободного кислорода, могут протекать реакции диспропорционирования
Разложение гипохлоритов в водных растворах зависит от кислотности раствора и его температуры. В сильнокислых средах при рН ≤ 3 хлорноватистая кислота при комнатной температуре разлагается до хлора и кислорода
4HClO = 2Cl 2 ↑ + O 2 ↑ + 2H 2 O.
Если при подкислении используется соляная кислота или в растворе присутствуют хлориды, образование кислорода не происходит
HClO + HCl = Cl 2 ↑ + H 2 O.
Хлорноватистая кислота очень слабая, поэтому она может быть вытеснена из раствора ее солей действием углекислого газа
ClO – + CO 2 + H 2 O = HCO 3 – + HClO.
В слабокислых и нейтральных средах при 3 2 ↑.
В нейтральных и щелочных растворах имеет место конкурирующая реакция образования хлоридов и хлоратов
При комнатной температуре реакция диспропорционирования протекает медленно, но при температурах выше 70°С эта реакция становится преобладающей.
В щелочных средах при рН > 7,5 в растворах преобладают гипохлорит-ионы, разлагающиеся следующим образом:
Около 95% от общего количества гипохлорит-ионов разлагается в результате последовательных реакций (1) и (2), причем реакция (1) является самой медленной (лимитирующей) и определяет общую скорость процесса. Реакция (3) не является основной, но отвечает за выделение кислорода, количество которого может быть значительным.
В присутствии некоторых ионов металлов, например, меди, никеля, кобальта наблюдается каталитическое разложение гипохлорит-ионов. Ионы железа обладают слабым каталитическим действием и являются сокатализаторами в сочетании с другими ионами металлов. В простейшем случае, при содержании ионов меди(II) в растворе в концентрации 1мг/кг порядки гомогенной реакции по гипохлориту и по меди(II) равны единице.
Гетерогенный катализ металлами и их нерастворимыми соединениями, является сложным и плохо воспроизводимым. Из нерастворимых катализаторов наибольшее мешающее влияние оказывает никель и его оксиды, которые попадают в растворы гипохлоритов при их контакте с легированными никелевыми сталями, используемыми для изготовления трубопроводов и резервуаров.
На константы скорости реакций (1)-(3) большое влияние оказывает ионная сила растворов. Высокие концентрации электролитов уменьшают константы скорости реакций и обеспечивают разумную стабильность при хранении растворов электролитов. Увеличение концентрации гипохлорит-ионов, напротив, уменьшает их стабильность в водных растворах. На рис. 2 показан феномен «кривой пересечения». Растворы гипохлорита натрия с концентрацией 9% и 5% при хранении разлагаются настолько, что через 50 недель показывают одинаковую концентрацию вещества, а через 100 недель первоначально более концентрированный раствор содержит гипохлорит-ионов меньше, чем разбавленный.
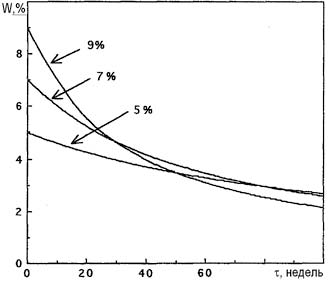
Рис. 2. Разложение гипохлорита натрия различных концентраций при 30°С.
Повышение температуры способствует ускорению процессов разложения гипохлоритов, поэтому целесообразно хранить растворы гипохлоритов в прохладном месте для обеспечения срока годности (рис. 3).

Рис. 3. Влияние температуры на разложение 5%-ного раствора NaClO.
Для стабилизации водных растворов гипохлоритов, а так же продуктов на их основе, каждый производитель применяет собственные методы, которые редко публикуются в виде статей. Однако известны некоторые запатентованные методы, которые, не претендуя на полноту, можно представить следующим списком:
Направление окислительно-восстановительных процессов с участием гипохлорит-ионов и хлорноватистой кислоты обусловлены значениями стандартных электродных потенциалов полуреакций в водной среде:
2HClO + 2H + + 2e – = Cl 2 ↑ + 2H 2 O, E° = 1,630 В,
HClO + H + + 2e – = Cl – + H 2 O, E° = 1,500 В.
в нейтральной и щелочной среде
Таким образом, гипохлорит-ионы и хлорноватистая кислота обладают выраженными окислительными свойствами, причем их окисляющая способность в кислой среде значительно выше, чем в нейтральной и щелочной средах.
Дезинфицирующее действие
Гипохлориты являются одними из лучших антибактериальных средств. Они убивают микроорганизмы очень быстро даже при очень низких концентрациях.
Наивысшее бактерицидное действие гипохлоритов проявляется в нейтральной среде, когда концентрации хлорноватистой кислоты и гипохлорит-ионов приблизительно равны (рис. 1). Образующиеся при разложении гипохлоритов активные частицы (атомарный кислород и хлор) обладают высоким биоцидным действием. Они уничтожают микроорганизмы, взаимодействуя с биополимерами в их структуре, способными к окислению. Аналогичным образом, например, действуют клетки человека нейтрофилы, гепатоциты и др., которые синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Бактерицидная активность гипохлоритов настолько велика, что они способны привести к гибели дрожжеподобных грибов, вызывающих кандидоз, Candida albicans, в течение 30 секунд при действии 5,0 – 0,5%-го гипохлоритного раствора. Патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25%-ым раствором и через 30 минут после обработки 0,5%-ым раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0 – 0,5%-м раствором гипохлорит-ионов.
Несмотря на высокую биоцидную активность гипохлоритов, некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза, к сожалению, устойчивы к его действию.
При помощи гипохлорит-ионов можно успешно обезвреживать различные токсины (табл. 3).
Таблица 3. Результаты инактивации токсинов при 30-минутной экспозиции различных концентраций гипохлорита натрия («+» – токсин инактивирован; «–» – токсин остался активен).
| Токсин | 2,5% NaClO + 0,25 н. NaOH | 2,5% NaClO | 1,0% NaClO | 0,1% NaClO |
|---|---|---|---|---|
| Т-2 токсин | + | – | – | – |
| Бреветоксин | + | + | – | – |
| Микроцистин | + | + | + | – |
| Тетродотоксин | + | + | + | – |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
Методы анализа
Качественными реакциями на гипохлорит-ион могут служить:
Наиболее распространенным методом количественного анализа гипохлорит-иона является титриметрический метод с использованием йодида калия. Для проведения испытания водный раствор или водную суспензию, содержащие гипохлорит-ион, смешивают с избытком раствора йодида калия в сернокислой среде. Выдерживают герметично закрытую смесь в течение 5 минут в темном месте. Выделившийся йод титруют стандартизированным раствором тиосульфата натрия. В качестве индикатора вблизи точки эквивалентности используют крахмальный раствор.
При количественном определении гипохлорит-иона косвенным йодометрическим методом результаты анализа пересчитывают на концентрацию «активного хлора» в ыделившегося при реакции
2H + + ClO – + Cl – = Cl 2 ↑ + H 2 O.
Альтернативным методом количественного определения гипохлорит-иона является потенциометрический анализ с использованием бром-ионселективного электрода. Концентрацию гипохлорит-иона находят методом добавок анализируемого раствора к стандартному раствору или методом уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору.
Способы получения наиболее важных товарных продуктов
Крупнотоннажными гипохлоритсодержащими продуктами являются гипохлорит натрия и гипохлорит кальция. Их глобальный объем производства превышает 1 млн тонн/год. При этом почти половина этого объема используется в быту, а другая половина в промышленности. Гипохлорит калия, являющийся исторически первым гипохлоритом, нашедшим промышленное применение, производится в ограниченном количестве.
Для промышленного производства гипохлорита натрия используются химический и электрохимический методы. При химическом методе производится хлорирование водных растворов гидроксида натрия. Суть химического превращения не изменилась со времен его открытия и применения Лабарраком
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Существуют две производственные схемы данного метода:
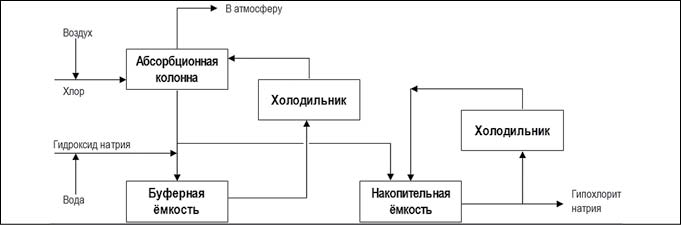
Рис. 4. Химический метод получения гипохлорита натрия основным процессом (рис. с сайта https://ru.wikipedia.org)
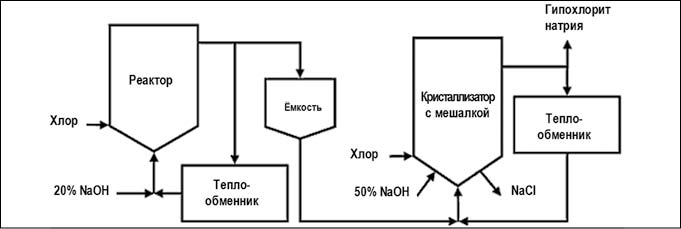
Рис. 5. Химический метод получения гипохлорита натрия концентрированным процессом (рис. с сайта https://ru.wikipedia.org)
При электрохимическом методе получения гипохлорита натрия водный раствор хлорида натрия подвергается электролизу в электролизере с открытыми электродными зонами (бездиафрагменный способ). Гидроксид натрия, образующийся на катоде, и хлор, выделяющийся на аноде, беспрепятственно смешиваются в ходе электрохимического процесса
NaCl + H 2 O = NaClO + H 2 ↑(суммарная реакция).
Гипохлорит кальция производится в виде хлорной извести, представляющей собой смесь целевого продукта с хлоридом кальция и гидроксидом кальция. В качества сырья для получения хлорной извести используется порошкообразный гидроксид кальция (пушенка), содержащий менее 1% свободной влаги и разбавленный влажным воздухом хлор. Небольшая влажность исходных веществ обеспечивает начало реакции гидролиза хлора, сопровождающейся нейтрализацией образующихся кислот известью. Затем реакция продолжается за счет воды, выделяющейся из гидроксида кальция при хлорировании
2Сa(OH) 2 + 2Cl 2 = Сa(ClO) 2 + СaCl 2 + 2H 2 O (суммарно).
Хлорирование пушенки осуществляется в аппаратах непрерывного действия – механических полочных камерах Бакмана.
Таблица 4. Производители гипохлорита натрия в России.
| Название предприятия | Сайт предприятия |
|---|---|
| «Каустик» ЗАО, г. Стерлитамак | www.kaus.ru/ |
| «Каустик» ОАО, г. Волгоград | www.kaustik.ru/ |
| «Новомосковский хлор» ООО, г. Новомосковск | www.hlor.biz/ |
| «Сода-хлорат» ООО, г. Березняки | www.soda.perm.ru/ |
Характеристика товарных гипохлоритов, обращение, хранение и транспортировка
В Российской Федерации гипохлориты производятся в соответствии с ГОСТ 11086–76 «Гипохлорит натрия. Технические условия» и ГОСТ 1692–85 «Известь хлорная. Технические условия». Гипохлорит натрия по назначению и показателям выпускается двух марок «А» и «Б» (табл. 5).
Таблица 5. Физико-химические показатели и назначение гипохлорита натрия по ГОСТ 11086–76
Чего не должно быть в составе моющего средства для дома? Эколог раскрывает секреты
Как правильно выбрать стиральный порошок для себя, чтобы не навредить и малышу? Что такое органические и неорганические средства для мытья посуды? Чем можно заменить чистящее средство для пола, чтобы вообще не использовать химию? На эти и другие вопросы отвечает специалист.
Средство для мытья пола
— Особенно актуально выбирать безопасное средство для мытья пола тем, у кого есть дети. Ведь, ползая по полу, руками малыши собирают остатки этого средства и затем тянут руки в рот. Поэтому чем безопаснее и экологичнее будет выбранная упаковка, тем лучше.
Чего в составе быть не должно:
— Этоксилированных поверхностно-активных веществ. Они могут скрываться под обозначениями: А-ПАВ (анионные ПАВ или — другое название — А-тензиды), неионогенные ПАВ. Большинство этих веществ получены в ходе нефтехимических цепочек реакций. Они агрессивные и опасные для здоровья.
Что, наоборот, приветствуется
Если нет уточнения по конкретным ингредиентам и процентному содержанию, скорее всего, используются синтетические токсичные.
Что можно выбрать вместо специального средства
Например, мыльные орехи (натуральное моющее средство, которое продается в эко-магазинах, — прим. И.Р.), натуральное хозяйственное мыло (обычное весьма агрессивное, плохо пахнет, зато обладает натуральным составом), соду. Можно добавлять в воду для мытья полов и масло чайного дерева. Оно имеет отличные бактерицидные свойства.
Средство для мытья посуды
Неорганические
Основной ингредиент таких моющих средств — ПАВы (поверхностно-активные вещества), которые обеспечивают удаление загрязнений с поверхности. Однако они негативно воздействуют на организм человека. Способствуют преждевременному старению кожи, повышают риск инфарктов и инсультов, вызывают аллергию.
ПАВы существуют в четырех видах:
анионные — дешевые и эффективные, но самые опасные для здоровья. Они могут накапливаться в организме и вызывать различные заболевания, например, печени, сердца, почек;
катионные — менее ядовиты и обладают бактерицидными качествами, но хуже справляются с загрязнениями;
неионогенные (неионные) — более безопасные вещества, поскольку полностью разлагаются во время мытья посуды. Но также могут быть этоксидированные.
Чтобы снизить негативное воздействие ПАВов (прежде всего, анионных), лучше выбирать средства, в которых их содержание не превышает 5%.
Пенообразование напрямую зависит от количества в нем ПАВов: чем лучше пенится моющее средство, тем больше в нем этих веществ.
Натуральные экологичные
Основу этих моющих средств составляют вещества растительного происхождения, полностью разлагающиеся в процессе мытья посуды. Такие средства безопасны для здоровья: они не разъедают кожу, полностью смываются с поверхности посуды, не вызывают аллергию.
Чего в составе быть не должно
— Средства для мытья посуды не должны содержать этоксилированные поверхностно-активные вещества, опасные консерванты (феноксиэтанол, катон), синтетические азокрасители.
Что, наоборот, приветствуется
Натуральные красители могут быть обозначены в составе так: Сl 77….
Средство для мытья унитаза (иногда ванны)
Лучше не выбирать универсальное средство, которое подойдет и для ванной, и для унитаза. Каждая из этих комнат в идеале чистится своим препаратом.
В большинстве средств для чистки унитаза есть:
Чего в составе быть не должно
Что, наоборот, приветствуется
К счастью, уже давно изобрели безопасные средства для дезинфекции на натуральных эфирных маслах.
Что можно выбрать вместо специального средства
Порошок или гель для стирки
— Частая ошибка родителей — это мнение о том, что лучшее и эко нужно только детям. Мы забываем, что малыши контактируют с нашей одеждой, например, во время объятий, игры… Если наш порошок состоит из критичных ингредиентов, большинство которых не выполаскивается водой, а накапливается в тканях, то повредит это не только нашему здоровью, но и здоровью детей. Особенно опасно, если речь идет об аллергиках.
Чего в составе быть не должно
Нежелательно содержание А-ПАВ выше 15%,. В составе также должны отсутствовать энзимы, цеолиты, так как они могут быть низкого качества и тогда приносить вред здоровью. Допускаются такие вещества только в том случае, если у средства есть высшей строгости эко-сертификат, например, Ecogarantie.
Не должно быть фосфатов, фосфонатов, оптических отбеливателей.
Что, наоборот, приветствуется
Лучше, если ПАВ будут растительными или сахарными. Кислородные отбеливатели также безопасны.
Средство для чистки кафеля
Чего в составе быть не должно
При использовании таких средства лучше использовать перчатки и выбирать содержание А-ПАВ менее 15%.
Что можно выбрать вместо специального средства
Специалист добавляет: высокая цена и популярность товара не всегда говорят о его безопасности. Если средство имеет строгий международный эко-сертификат, то обычно стоит дороже. Это объясняется тем, что сертификация — довольно дорогая штука, к тому же в таком средстве, как правило, используются лучшие и дорогие ингредиенты, часто органического происхождения. вместо дешевых синтетических.
— Если вы выбираете безопасную эко-натуральную химию, то средства защиты необязательны. Однако в случае использования агрессивных средств с полок масс-маркета защита необходима по всем фронтам. Например, маска (если средство в спрее или содержит хлор) и перчатки.
Контрактное производство
Косметических средств, БАД к пище, фасовка пищевой продукции.
Методы определения содержания хлоридов в моющих средствах
Организм человека не способен вырабатывать натрий самостоятельно. Хлориды необходимы человеческому организму для обеспечения нормального дыхания и для усвоения пищи. Натрий, без которого был бы невозможен перенос кислорода, многих питательных веществ, а так же передача нервных импульсов и соответственно движение всех мышц. Хлориды от всей массы тела человека составляют около 250 гр. Однако, при физиологических процессах происходящих в организме человека, соль расходуется постоянно, и поэтому возмещать её потерю для организма является жизненной необходимостью
В организме человека, в крови, в лимфе и в моче хлор связан главным образом с Na, поэтому содержание хлоридов принято указывать формулой NaCl. Хлористый натрий это важнейшая составляющая часть соков и крови организма человека. Количество хлористого натрия в плазме является определяющим фактором в создании и поддержании осмотического давления, в котором находятся клетки организма.
Поступление хлоридов в организм человека обеспечивается с пищей. Выделение происходит главным образом почками (за сутки около 10—15 г.), частично кишечником и частично с потом.
При назначении диеты, в которой преобладает растительная пища, происходит усиленное выделение хлоридов. При доминировании мясной пищи содержание хлоридов. в моче является минимальным. Поэтому потребность в хлоридах при доминирующей растительной диете значительно выше, чем при мясной.
В древности соли приписывали различные священные свойства. У многих народов до настоящего времени сохраняется традиция подавать соль, которая символизирует дружбу и гостеприимство. И сейчас многие, просыпая соль, считают, что это к несчастью.
Еще в XIX веке, в Эфиопии эквивалентом денег были стандартизированные бруски из каменной соли и принимались к оплате. В Китае изготавливались монеты из соли и на эти монеты ставили клеймо богдыхана. Солью, очень часто платили жалование римским солдатам и крестоносцам.
Применение хлоридов в контрактном производство шампуня:
Соль является традиционным компонентом при производстве шампуней для мытья волос, гелей для душа. Так зачем она в шампуне?
Шампунь представляет собой многокомпонентную смесь поверхностно-активных веществ, добавок, отдушек, консерванта и прочих косметических ингредиентов. Шампунь представляет собой густую однородную массу, которая легко превращается в пену.
Хлорид натрия или поваренная соль в производстве шампуня играет немаловажную роль, а именно при добавлении соли шампунь приобретает густую гелеобразную структуру.
Но так ли это хорошо для потребителя? С одной стороны — шампунь не растекается по ладони при применении, легко распределяется, не вытекает из флакона. С другой стороны — соль в больших дозах может оказывать негативное влияние на кожу головы, за счет гидратирующего действия (поглощения воды) соль высушивает кожу, волосы становятся жесткими, поэтому при контрактном производстве шампуня и пеномоющих средств жёстко контролируются все гигиенические моющие средства по данному показателю.
Содержание хлоридов регламентируется в соответствии с ГОСТ 31696-2012 Продукция косметическая гигиеническая моющая. Общие Технические Условия