хфу что это такое
Хлорфторуглероды
Хлорфторуглероды — органические соединения, состоящие иcключительно из атомов хлора (Cl), фтора (F) и углерода (С). Различают низшие хлорфторуглероды (CFC) — низкокипящие органические соединения на основе метанового, этанового и пропанового рядов, а также высшие хлорфторуглероды, являющиеся высокомолекулярными соединениями.
Хлорфторуглероды — нетоксичны, не образуют взрывоопасных смесей с воздухом, флегматизируют горение углеводородов, чрезывчайно стабильны.
Считается, что толчком в промышленном использовании хлорфторуглеродов послужило предложение Томаса Мидгли, американского химика и инженера-механика по их применению в холодильниках вместо используемых ранее токсичных и взрывоопасных хладагентов (аммиака и сернистого газа). Впоследствии низшие хлорфторуглероды (CFC) стали широко использоваться в качестве пропеллентов в аэрозольных баллонах, вспенивающих агентов, взрывобезопасных растворителей.
Высшие хлорфторуглероды нашли широкое применение в качестве манометрических и запорных жидкостей, находящихся в контакте с агрессивными средами (концентрированные кислоты, галогены, жидкий кислород и другие окислители), в качестве жидких негорючих диэлектриков, в качестве смазочных материалов.
Низшие хлорфторуглероды (CFC) [1]
| Хлорфторуглерод (CFC) | Химическая формула | Техническое обозначение | |
|---|---|---|---|
| Трифторхлорметан | CF3Cl | R13 | -81,5 |
| Дифтордихлорметан | CF2Cl2 | R12 | -29,74 |
| Фтортрихлорметан | CFCl3 | R11 | 23,65 |
| Пентафторхлорэтан | CF3CF2Cl | R115 | -38,97 |
| 1,1,2,2-тетрафтордихлорэтан | CF2ClCF2Cl | R114 | 3,5 |
| 1,1,1-трифтортрихлорэтан | CF3CCl3 | R113a | 45,9 |
| 1,1,2-трифтортрихлорэтан | CF2ClCFCl2 | R113 | 47,5 |
| 1,2-дифтортетрахлорэтан | CFCl2CFCl2 | R112 | 92,8 |
| 1,2-дихлоргексафторпропан | CF3CFClCF2Cl | R216 | 35,7 |
Высшие хлорфторуглероды — хлорфторуглеродные жидкости, масла и смазки [1]
| Наименование | Химическая формула | Средняя относительная |
| жидкость 11ф | 1-4 | 339 |
| жидкость 11ф Д | 1-4 | 364 |
| жидкость 12ф | 3-7 | 383 |
| жидкость 13ф | 3-7 | 518 |
| жидкость 13фм | 4-8 | 625 |
| масло 4лф | 5-10 | 715 |
| масло 4ф | 5-10 | 985 |
| Масло 4ф с добавкой 3-5% политрифторхлорэтилена в качестве загустителя | ||
Основным методом получения хлорфторуглеродов является реакция обмена атомов хлора в исходном соединении на фтор действием фтористого водорода в присутствии хлорида сурьмы (V) — реакция Свартса [2] [3] :
Гексахлорэтан может быть заменён перхлорэтиленом и хлором [4] :
Хлорфторуглероды возможно получить фторированием перхлоролефинов [5] :
И хлорированием перфторолефинов или фторуглеводородов [1] :
Содержание
Химические свойства хлорфторуглеродов
Гидрирование хлорфторуглеродов идёт при высокой температуре с образованием фторуглеводородов [1] :
При повышенной температуре на катализаторе имеет место диспропроционарование хлорфторуглеродов [1] :
В присутствии катализатора – хлорида алюминия хлорфторуглероды алкилируют галогенолефины [1] :
Хлорфторуглероды этанового и пропанового ряда подвергаются дегалогенированию цинком в среде полярного растворителя:
Воздействие на окружающую среду
Практически бесконтрольное использование низших хлорфторуглеродов в качестве пропеллентов аэрозольных упаковок, вспенивателей, растворителей и хладагентов привело к накоплению хлорфторуглеродов в атмосфере. С помощью электронного детектора Лавлока обнаружено присутствие хлорфторуглеродов в верхних слоях атмосферы.
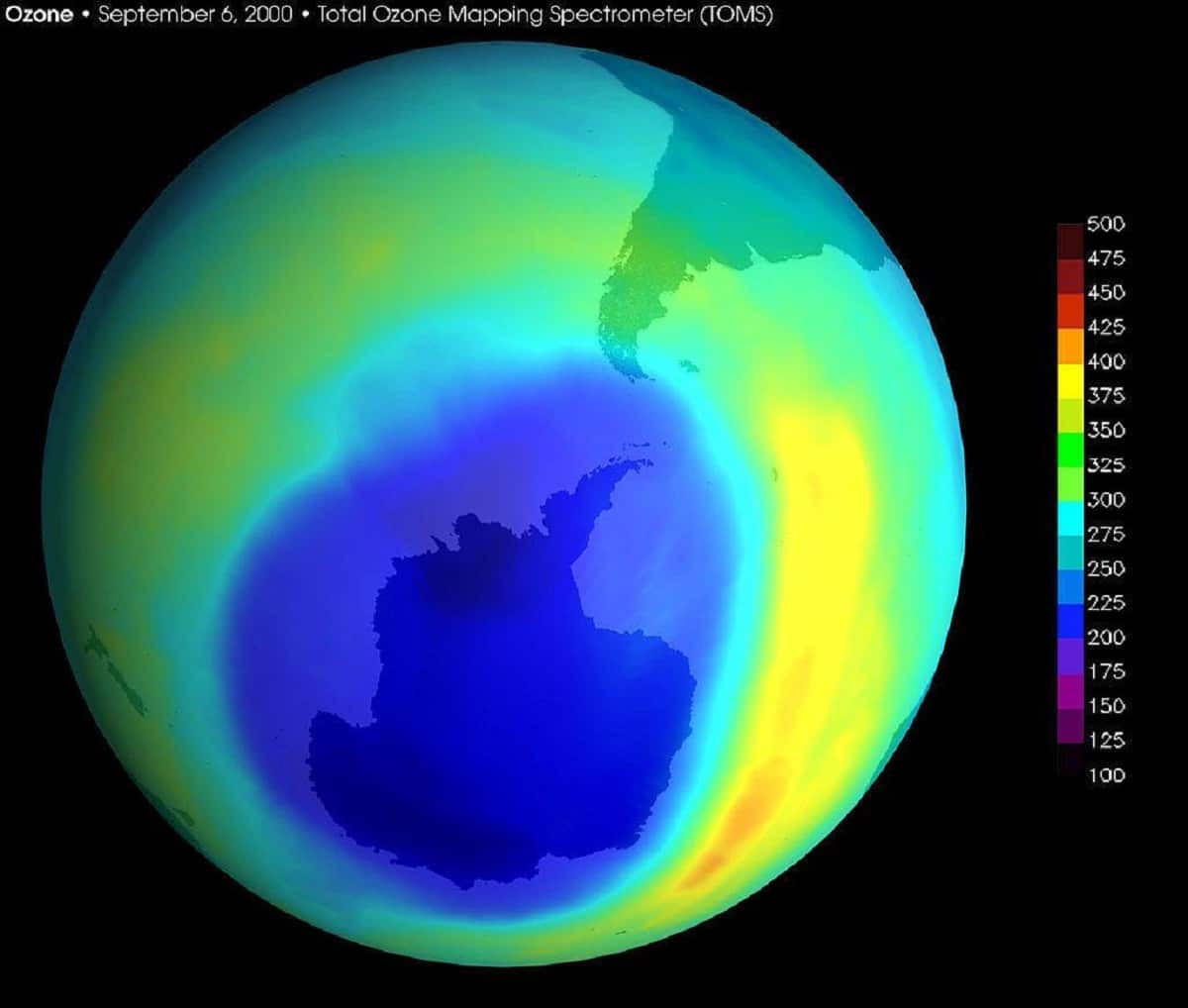
Шервуд Роуланд предсказал, что хлорфторуглероды, произведённые человеком, под действием солнечной радиации разлагаются в атмосфере, образуя хлор и монокись хлора, которые способны эффективно разрушать молекулы озона
Марио Молина и Пауль Крутцен показали истощающий эффект галогеналканов на озоновый слой стратосферы, являющийся природным защитным экраном Земли от губительного жёсткого ультрафиолетового излучения Солнца.
Венской конвенцией 1985 г. и Монреальским протоколом 1987 г. по защите озонового слоя были запрещены производства низших хлорфторуглеродов.
В 1985 году Паулю Джозефу Крутцену Шервурду Роланду и Марио Молине присуждена Нобелевская премия по химии с формулировкой «За работу в атмосферной химии, особенно в части процессов образования и разрушения озонового слоя».
Примечания
См.также
Полезное
Смотреть что такое «Хлорфторуглероды» в других словарях:
ХЛОРФТОРУГЛЕРОДЫ — ХЛОРФТОРУГЛЕРОДЫ, см. ГАЛОГЕНУГЛЕРОДЫ … Научно-технический энциклопедический словарь
ХЛОРФТОРУГЛЕРОДЫ — (ХФУ) (chlorofluorocarbons, CFCs) Химические соединения, широко используемые в холодильных установках, кондиционерах и системах отвода тепла. ХФУ получили широкое распространение благодаря своей нетоксичности и, как предполагалось, безвредности.… … Экономический словарь
хлорфторуглероды — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN chlorofluorocarbon Gases formed of chlorine, fluorine, and carbon whose molecules normally do not react with other substances; they are therefore used as spray can propellants… … Справочник технического переводчика
запрет на хлорфторуглероды и галон — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN CFC and halons prohibition An interdiction on the manufacture or use of products that discharge chlorofluorocarbons and bromine containing compounds into the atmosphere,… … Справочник технического переводчика
частично галогенизированные хлорфторуглероды — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN partially halogenated chlorofluorohydrocarbon Hydrocarbons whose hydrogen atoms have been partially substituted with chlorine and fluorine. They are used in refrigeration, air… … Справочник технического переводчика
Фреоны — (хладоны) техническое название группы насыщенных алифатических фторсодержащих углеводородов, применяемых в качестве хладагентов, пропеллентов, вспенивателей, растворителей. Кроме атомов фтора фреоны могут содержать атомы хлора или брома[1].… … Википедия
ПАРНИКОВЫЕ ГАЗЫ — газы (двуокись углерода, водяной пар, окислы азота и серы, хлорфторуглероды или фреоны и другие), производящие эффект парниковый. На сегодняшний день человек в результате своей деятельности уже выбросил в атмосферу такое количество парниковых… … Экологический словарь
Мидгли, Томас — Томас Мидгли англ. Thomas Midgley … Википедия
Реакция Свартса — Реакция Свартса это замена одного или нескольких атомов галогена в полигалогенорганических соединениях на фтор или взаимодействием с трифторидом сурьмы или безводным фтористым водородом в присутсви пентахлорида сурьмы при их нагревании… … Википедия
ГАЛЛОГЕНАЛКАНЫ — (алкилгалогениды), органические и химические соединения, в которых у АЛКАНА один или несколько атомов водорода замещены ГАЛОГЕНОМ. Галогеналканы используются как растворители и применяются в органическом синтезе. Примеры: йодметан (метилйодид… … Научно-технический энциклопедический словарь
Хлорфторуглероды
Из Википедии — свободной энциклопедии
Хлорфторуглероды — органические соединения, состоящие исключительно из атомов хлора (Cl), фтора (F) и углерода (С). Различают низшие хлорфторуглероды (CFC) — низкокипящие органические соединения на основе метанового, этанового и пропанового рядов, а также высшие хлорфторуглероды, являющиеся высокомолекулярными соединениями.
Некоторые хлорфторуглероды могут быть токсичными веществами; в высоких дозах поражают сердечно-сосудистую и нервную системы, вызывают развитие спазмов сосудов и нарушение микроциркуляции крови. Поражают печень, а в следствие развития отравления и почки. Разрушают лёгочные мембраны, особенно при наличии примесей органических растворителей и четырёххлористого углерода — развиваются эмфиземы и рубцевание.
Хлорфторуглероды — запрещается образование смесей с воздухом под давлением, стабильность преувеличена. Распадаются при нагревании в смеси с воздухом с образованием галоген-водородов и фосгенов.
Хлорфторуглероды — флегматизируют горение углеводородов.
Считается, что толчком в промышленном использовании хлорфторуглеродов послужило предложение Томаса Миджли, американского химика и инженера-механика по их применению в холодильниках вместо используемых ранее токсичных и взрывоопасных хладагентов (аммиака и сернистого газа). Впоследствии низшие хлорфторуглероды (CFC) стали широко использоваться в качестве пропеллентов в аэрозольных баллонах, вспенивающих агентов, взрывобезопасных растворителей.
Высшие хлорфторуглероды нашли широкое применение в качестве манометрических и запорных жидкостей, находящихся в контакте с агрессивными средами (концентрированные кислоты, галогены, жидкий кислород и другие окислители), в качестве жидких негорючих диэлектриков, в качестве смазочных материалов.
Хлорфторуглероды
Наверняка, когда вы слышите про дыру в озоновом слое, то считайте отвечающие за нее газы. Основным химическим веществом, вызвавшим снижение концентрации атмосферного озона, являются хлорфторуглероды. Это газообразные химические вещества, которые использовались с момента их появления в 1928 году. Они также известны под аббревиатурой CFC. Они были детально исследованы и показали, что их свойства угрожают не только здоровью населения, но и озоновому слою. Поэтому его использование было запрещено.
В этой статье мы расскажем вам, что такое хлорфторуглероды, каковы их характеристики и почему они разрушают озоновый слой.
Что такое хлорфторуглероды
Это химические вещества, состоящие из атомов углерода, фтора и хлора. Отсюда и его название. Эти атомы принадлежат к группе галоидоуглероды, входящие в группу газов, не токсичны и не горючие. Впервые они были созданы в 1928 году как альтернатива различным химическим веществам, которые использовались в холодильниках. Позже они использовались в качестве пропеллентов в инсектицидах, красках, кондиционерах для волос и других продуктах здравоохранения.
Между 50-ми и 60-ми годами они использовались в кондиционерах для домов, автомобилей и офисов. Все это привело к глобальному распространению хлорфторуглеродов. В то время использование этих химикатов увеличилось примерно на миллион метрических тонн, которые производились ежегодно только в Соединенных Штатах. Позже его использование еще больше увеличилось. Он достиг такой степени, что его использовали как аэрозоль, хладагент, пенообразователь для пен, упаковочного материала и в растворителях.
Наиболее распространенные хлорфторуглеродные продукты
Эти химические вещества не имеют естественного источника. Это химические вещества, созданные человеком для многих целей. Они использовались в качестве хладагентов, пропеллентов и промышленных растворителей для производства пен. Он также служил чистящим средством при производстве электронных продуктов. Его использование было таким, что воздействие на озоновый слой за короткое время чрезвычайно возросло. Было известно, что эти газы разрушают стратосферный озон до такой степени, что вредное солнечное ультрафиолетовое излучение может достигать поверхности.
Среди наиболее известных хлорфторуглеродных продуктов можно выделить следующие:
Отрицательные эффекты хлорфторуглеродов в атмосфере
Как упоминалось ранее, известно, что эти химические вещества разрушают озоновый слой. Это означает, что большая часть ультрафиолетового излучения Солнца может проходить через стратосферу и достигать поверхности Земли. Было замечено, что он имеет множество негативных последствий для нашего собственного здоровья. И поскольку это различные химически инертные соединения, считалось, что они будут безвредными в атмосфере. Однако со временем выяснилось, что реагировал с ультрафиолетовым излучением в атмосфере, особенно в стратосфере.
В этом слое атмосферы имеется большая концентрация озона, который помогает нам уменьшить ультрафиолетовое излучение, исходящее от солнца. Эта большая концентрация озона известна как озоновый слой. Когда хлорфторуглероды взаимодействуют с излучением, они подвергаются фотолитическому разложению, которое превращает нас в источники неорганического хлора. Когда хлор выделяется в форме атомов, они способны катализировать превращение молекул озона в кислород. Это означает, что он ускоряет естественную химическую реакцию превращения озона в кислород.
Мы помним, что молекула озона состоит из 3 атомов кислорода. Атмосферный кислород состоит из двух атомов кислорода. Таким образом, хлор действует как катализатор, увеличивая скорость и количество химических реакций, преобразующих озон в кислород. Таким образом до 100.000 молекул озона может быть разрушено на каждый выпущенный атом хлора. Все эти причины объясняют, почему хлорфторуглероды связаны с разрушением озонового слоя.
Дело не в том, что эти химические вещества напрямую разрушают озон в стратосфере, а в том, что для их протекания требуются различные химические реакции. Однако скорость, с которой хлорфторуглероды будут выбрасываться в атмосферу, вызвала исчезновение большого количества стратосферного озона. Исчезновение озонового слоя имеет очень разрушительные последствия и еще больше увеличивает химическое загрязнение. И озон отвечает за поглощают большую часть солнечного ультрафиолетового излучения с длинами волн от 280 до 320 нм и что это, конечно, вредно как для животных, так и для растительных организмов и человека.
Озоновая дыра
Использование этих химикатов в больших количествах привело к образованию дыр в озоновом слое. Дело не в том, что есть сама дыра, в которой нет концентрации озона. Это просто области, в которых концентрация озона намного ниже нормы. Эта концентрация достаточно мала, чтобы ультрафиолетовое излучение не оставалось в этой области и не проникало через поверхность земли.
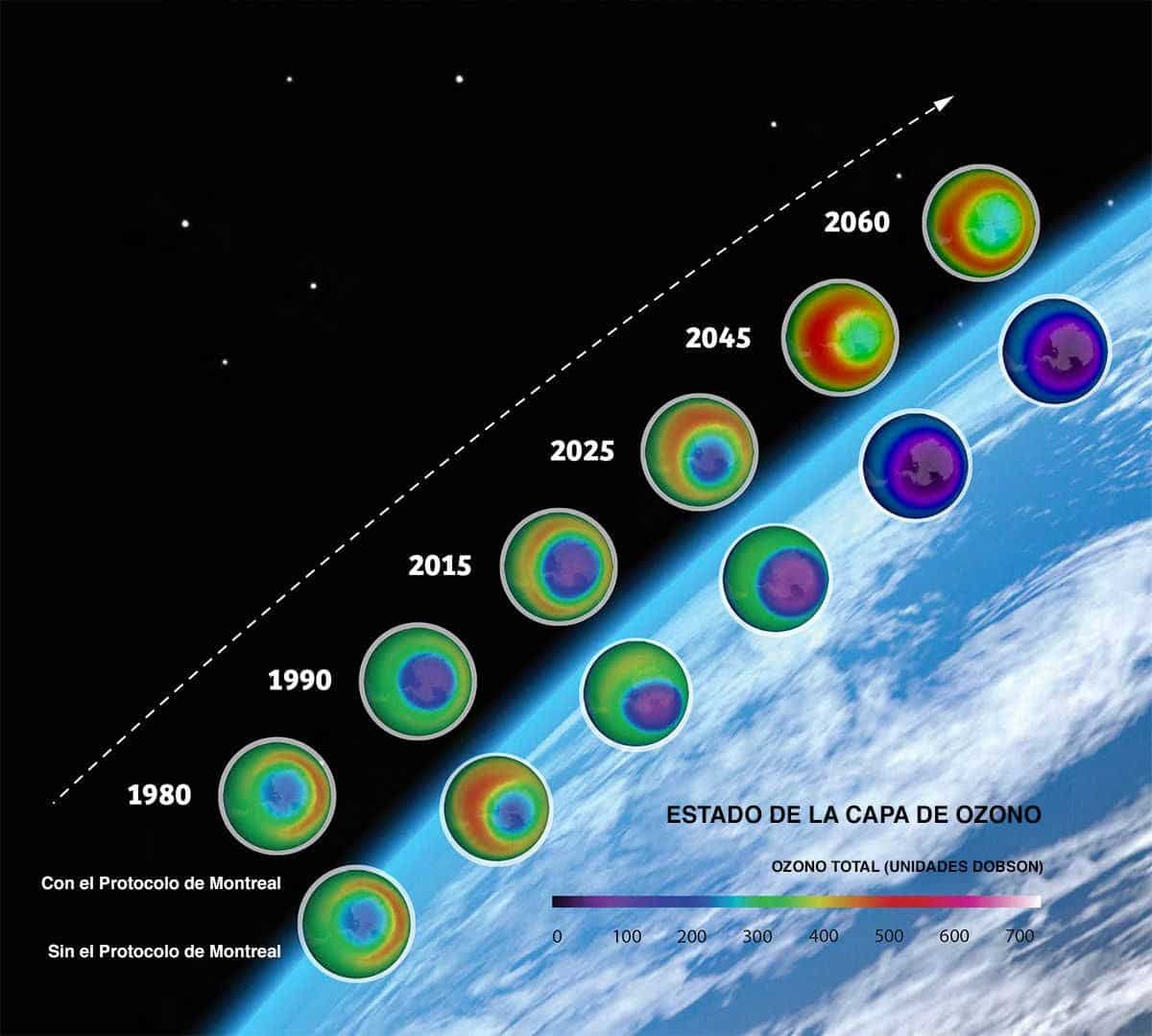
Хотя хлорфторуглероды запрещены, поскольку они обладают большой химической инертностью и нерастворимы, даже сегодня большая часть химических веществ, выделенных в предыдущие годы, все еще присутствует. Это потому, что они имеют долгую продолжительность жизни в атмосфере. С 1987 г. Монреальский протокол признал эти химические соединения вредными были присоединены к другим международным соглашениям, которые привели к запрету этих химикатов, поскольку они также действуют как парниковые газы.
Как видите, хлорфторуглероды оказывают огромное негативное воздействие как на атмосферу, так и на животных, растения и людей. Я надеюсь, что с этой информацией вы сможете больше узнать о хлорфторуглеродах.
Содержание статьи соответствует нашим принципам редакционная этика. Чтобы сообщить об ошибке, нажмите здесь.
Хлорфторуглерод
Плотность CFC выше, чем у их соответствующих алканов. Как правило, плотность этих соединений коррелирует с количеством хлоридов.
ХФУ и ГХФУ обычно производятся путем галогенового обмена, исходя из хлорированных метанов и этанов. Показательным является синтез хлордифторметана из хлороформа :
HCCl 3 + 2 HF → HCF 2 Cl + 2 HCl
Бромированные производные образуются в результате радикальных реакций гидрохлорфторуглеродов, замещающих связи CH связями C-Br. Показательно получение анестетика 2-бром-2-хлор-1,1,1-трифторэтана («галотана»):
Система нумерации
| Основные ХФУ | |||
|---|---|---|---|
| Систематическое название | Обычное / банальное имя (а), код | Точка кипения (° C) | Формула |
| Трихлорфторметан | Фреон-11, R-11, CFC-11 | 23,77 | CCl 3 F |
| Дихлордифторметан | Фреон-12, R-12, CFC-12 | -29,8 | CCl 2 F 2 |
| Хлортрифторметан | Фреон-13, R-13, CFC-13 | −81 | CClF 3 |
| Дихлорфторметан | R-21, ГХФУ-21 | 8.9 | CHCl 2 F |
| Хлордифторметан | R-22, ГХФУ-22 | -40,8 | CHClF 2 |
| Хлорфторметан | Фреон 31, R-31, ГХФУ-31 | −9,1 | CH 2 ClF |
| Бромхлордифторметан | BCF, Галон 1211, H-1211, Фреон 12B1 | −3,7 | CBrClF 2 |
| 1,1,2-трихлор-1,2,2-трифторэтан | Фреон 113, R-113, CFC-113, 1,1,2-Трихлортрифторэтан | 47,7 | Cl 2 FC-CClF 2 |
| 1,1,1-трихлор-2,2,2-трифторэтан | Фреон 113а, R-113а, CFC-113а | 45,9 | Cl 3 C-CF 3 |
| 1,2-дихлор-1,1,2,2-тетрафторэтан | Фреон 114, R-114, CFC-114, дихлортетрафторэтан | 3.8 | ClF 2 C-CClF 2 |
| 1-хлор-1,1,2,2,2-пентафторэтан | Фреон 115, R-115, CFC-115, хлорпентафторэтан | −38 | ClF 2 C-CF 3 |
| 2-хлор-1,1,1,2-тетрафторэтан | R-124, ГХФУ-124 | −12 | CHFClCF 3 |
| 1,1-дихлор-1-фторэтан | R-141b, ГХФУ-141b | 32 | Cl 2 FC-CH 3 |
| 1-хлор-1,1-дифторэтан | R-142b, ГХФУ-142b | −9,2 | ClF 2 C-CH 3 |
| Тетрахлор-1,2-дифторэтан | Фреон 112, R-112, CFC-112 | 91,5 | CCl 2 FCCl 2 F |
| Тетрахлор-1,1-дифторэтан | Фреон 112а, R-112a, CFC-112a | 91,5 | CClF 2 CCl 3 |
| 1,1,2-трихлортрифторэтан | Фреон 113, R-113, CFC-113 | 48 | CCl 2 FCClF 2 |
| 1-бром-2-хлор-1,1,2-трифторэтан | Галон 2311a | 51,7 | CHClFCBrF 2 |
| 2-бром-2-хлор-1,1,1-трифторэтан | Галон 2311 | 50,2 | CF 3 CHBrCl |
| 1,1-дихлор-2,2,3,3,3-пентафторпропан | R-225ca, ГХФУ-225ca | 51 | CF 3 CF 2 CHCl 2 |
| 1,3-дихлор-1,2,2,3,3-пентафторпропан | R-225cb, ГХФУ-225cb | 56 | CClF 2 CF 2 CHClF |
Наиболее важная реакция [ править ] от ХФУ является фото-индуцированной разрезка из связи С-Cl:
Однако атмосферное воздействие ХФУ не ограничивается их ролью как озоноразрушающих химикатов. Инфракрасные полосы поглощения предотвращают утечку тепла на этой длине волны из атмосферы Земли. CFC имеют самые сильные полосы поглощения от связей CF и C-Cl в спектральной области 7,8–15,3 мкм [7], называемые «атмосферным окном» из-за относительной прозрачности атмосферы в этой области. [8]
Группы активно утилизируют устаревшие ХФУ, чтобы уменьшить их воздействие на атмосферу. [13]
По данным НАСА, в 2018 году дыра в озоновом слое начала восстанавливаться в результате запрета на ХФУ. [14]
Бельгийский ученый Фредерик Свартс стал пионером синтеза ХФУ в 1890-х годах. Он разработал эффективный обменный агент для замены хлорида в четыреххлористом углероде фторидом для синтеза CFC-11 (CCl 3 F) и CFC-12 (CCl 2 F 2 ).
Коммерческая разработка и использование
Регулирование
Поскольку для стран, присоединившихся к соглашению, доступны только ХФУ, полученные от вторичной переработки, цены на них значительно выросли. Прекращение производства по всему миру должно положить конец контрабанде этого материала. Однако существуют текущие проблемы контрабанды ХФУ, как это было признано Программой Организации Объединенных Наций по окружающей среде (ЮНЕП) в отчете 2006 года под названием «Незаконная торговля озоноразрушающими веществами». По оценкам ЮНЕП, в середине 1990-х годов через черный рынок прошло от 16 000 до 38 000 тонн ХФУ. Согласно отчету, от 7000 до 14000 тонн ХФУ ежегодно контрабандным путем ввозятся в развивающиеся страны. Азиатские страны являются странами с наибольшим объемом контрабанды; по состоянию на 2007 год было обнаружено, что на Китай, Индию и Южную Корею приходится около 70% мирового производства ХФУ [20], Южная Корея позже запретила производство ХФУ в 2010 году. [21] Также были изучены возможные причины продолжения контрабанды ХФУ: В отчете отмечается, что многие запрещенные продукты, производящие ХФУ, имеют долгий срок службы и продолжают работать. Стоимость замены оборудования этих предметов иногда бывает дешевле, чем установка на них более безопасного для озона прибора. Кроме того, контрабанда ХФУ не считается серьезной проблемой, поэтому предполагаемые штрафы за контрабанду невелики. В 2018 году внимание общественности было обращено на то, что в Восточном Китае с 2012 года производилось примерно 13000 метрических тонн ХФУ в год в нарушение протокола. [22] [23] Хотя возможен постепенный отказ от ХФУ, предпринимаются усилия для решения этих текущих проблем несоблюдения.
Ко времени подписания Монреальского протокола стало понятно, что преднамеренные и случайные сбросы во время испытаний и технического обслуживания системы составляют значительно большие объемы, чем аварийные сбросы, и, следовательно, галоны были включены в договор, хотя и со многими исключениями.
Нормативный пробел
Хотя производство и потребление ХФУ регулируется Монреальским протоколом, выбросы из существующих банков ХФУ этим соглашением не регулируются. По оценкам, в 2002 году в существующих продуктах, таких как холодильники, кондиционеры, аэрозольные баллончики и другие, содержалось около 5791 килотонн ХФУ. [24] Приблизительно одна треть этих ХФУ, по прогнозам, будет выброшена в течение следующего десятилетия, если не будут приняты меры, что создаст угрозу как для озонового слоя, так и для климата. [25] Часть этих ХФУ можно безопасно улавливать и уничтожать.
Регулирование и DuPont
В 1978 году Соединенные Штаты запретили использование ХФУ, таких как фреон, в аэрозольных баллончиках, что положило начало длинной серии нормативных актов против их использования. Срок действия критического патента DuPont на производство фреона («Процесс фторирования галогенуглеводородов», патент США № 3258500) истекал в 1979 году. Вместе с другими промышленными партнерами DuPont сформировала лоббистскую группу «Альянс за ответственную политику в отношении ХФУ» для борьбы с правила использования озоноразрушающих соединений. [26] В 1986 году DuPont, имея в руках новые патенты, изменила свою прежнюю позицию и публично осудила ХФУ. [27] Представители DuPont выступили перед Монреальским протоколом, призывая запретить ХФУ во всем мире, и заявили, что их новые ГХФУ удовлетворят мировой спрос на хладагенты. [27]
Поэтапный отказ от ХФУ
Использование некоторых хлоралканов в качестве растворителей для крупномасштабных применений, таких как химчистка, было прекращено, например, директивой IPPC по парниковым газам в 1994 году и директивой ЕС по летучим органическим соединениям (ЛОС) в 1997 году. Разрешено хлорфторалкан используется только в медицинских целях.
Бромфторалканы были в значительной степени прекращены, и владение оборудованием для их использования запрещено в некоторых странах, таких как Нидерланды и Бельгия, с 1 января 2004 года на основании Монреальского протокола и руководящих принципов Европейского Союза.
Производство новых запасов прекратилось в большинстве (вероятно, во всех) странах в 1994 году. [ Необходима цитата ] Однако многие страны по-прежнему требуют, чтобы самолеты были оснащены системами пожаротушения с использованием галона, потому что для этого применения не было обнаружено никакой безопасной и полностью удовлетворительной альтернативы. Есть также несколько других узкоспециализированных применений. Эти программы рециркулируют галоны через «банки галонов», координируемые Halon Recycling Corporation [28], чтобы гарантировать, что выбросы в атмосферу происходят только в случае реальной чрезвычайной ситуации, и сохранить оставшиеся запасы.
Поэтапный отказ от ГФУ и ГХФУ
Гидрофторуглероды включены в Киотский протокол и регулируются Кигалийской поправкой к Монреальскому протоколу [32] из-за их очень высокого потенциала глобального потепления и признания вклада галогенуглеродов в изменение климата. [33]
Разработка альтернатив ХФУ
Работа над альтернативами хлорфторуглеродам в хладагентах началась в конце 1970-х годов после публикации первых предупреждений об ущербе для стратосферного озона.
Среди природных хладагентов (наряду с аммиаком и диоксидом углерода) углеводороды оказывают незначительное воздействие на окружающую среду и также используются во всем мире в бытовых и коммерческих холодильных установках и становятся доступными в новых кондиционерах сплит-систем. [35] Различные другие растворители и методы заменили использование ХФУ в лабораторной аналитике. [36]
В дозированных ингаляторах (MDI) в качестве пропеллента был разработан не влияющий на озон заменитель, известный как « гидрофторалкан ». [37]
| Приложения и замены для CFC | ||
|---|---|---|
| Заявление | Ранее использованный CFC | Замена |
| Холодильное оборудование и кондиционирование | CFC-12 (CCl 2 F 2 ); CFC-11 (CCl 3 F); CFC-13 (CClF 3 ); ГХФУ-22 (CHClF 2 ); CFC-113 (Cl 2 FCCClF 2 ); CFC-114 (CClF 2 CClF 2 ); CFC-115 (CF 3 CClF 2 ); | ГФУ-23 ( 3 швейцарских франка ) ; ГФУ-134а (CF 3 CFH 2 ); HFC-507 ( азеотропная смесь 1: 1 HFC 125 (CF 3 CHF2) и HFC-143a (CF 3 CH 3 )); HFC 410 (азеотропная смесь 1: 1 HFC-32 (CF 2 H 2 ) и HFC-125 (CF 3 CF 2 H)) |
| Пропелленты в лекарственных аэрозолях | CFC-114 (CClF 2 CClF 2 ) | ГФУ-134а (CF 3 CFH 2 ); ГФУ-227ea (CF 3 CHFCF 3 ) |
| Пенообразователи для пен | CFC-11 (CCl 3 F); CFC 113 (Cl 2 FCCClF 2 ); ГХФУ-141b (CCl 2 FCH 3 ) | ГФУ-245fa (CF 3 CH 2 CHF 2 ); ГФУ-365 mfc (CF 3 CH 2 CF 2 CH 3 ) |
| Растворители, обезжиривающие средства, чистящие средства | CFC-11 (CCl 3 F); CFC-113 (CCl 2 FCClF 2 ) | Никто |
Поскольку временная история концентраций ХФУ в атмосфере относительно хорошо известна, они являются важным ограничителем циркуляции океана. ХФУ растворяются в морской воде на поверхности океана и впоследствии переносятся в глубь океана. Поскольку ХФУ инертны, их концентрация во внутренней части океана просто отражает свертку их атмосферной эволюции во времени и океанической циркуляции и перемешивания.
Возраст океанской воды на основе индикаторов CFC и SF 6
Хлорфторуглероды (ХФУ) представляют собой антропогенные соединения, которые выбрасываются в атмосферу с 1930-х годов в различных областях, таких как кондиционирование воздуха, охлаждение, вспениватели в пенах, изоляционных материалах и упаковочных материалах, пропелленты в аэрозольных баллончиках и в качестве растворителей. [38] Попадание ХФУ в океан делает их чрезвычайно полезными в качестве временных индикаторов для оценки скорости и путей океанической циркуляции и процессов перемешивания. [39] Однако из-за ограничений производства ХФУ в 1980-х годах атмосферные концентрации ХФУ-11 и ХФУ-12 перестали расти, а соотношение ХФУ-11 к ХФУ-12 в атмосфере неуклонно снижалось, что привело к водному датированию. водных масс более проблематично. [39] Между прочим, с 1970-х годов производство и выброс гексафторида серы (SF 6 ) в атмосферу быстро увеличились. [39] Подобно ХФУ, SF 6 также является инертным газом и не подвержен химической или биологической активности океана. [40] Таким образом, использование CFC вместе с SF 6 в качестве индикатора решает проблемы датировки воды из-за снижения концентрации CFC.
Использование ХФУ или SF 6 в качестве индикатора циркуляции океана позволяет вывести скорость океанических процессов из-за зависящей от времени функции источника. Время, прошедшее с тех пор, как подземная водная масса в последний раз контактировала с атмосферой, является возрастом, полученным из индикаторов. [41] Оценки возраста могут быть получены на основе парциального давления отдельного соединения и отношения парциального давления CFC друг к другу (или SF 6 ). [41]
Методы датирования с частичным давлением и соотношением
Возраст участка воды можно оценить по возрасту парциального давления CFC (pCFC) или возрасту парциального давления SF 6 (pSF 6 ). Возраст пробы воды по pCFC определяется как:
Можно отметить, что растворимость CFC увеличивается с понижением температуры примерно на 1% на градус Цельсия. [41]