хеликобактер пилори igg положительный что это значит чем лечить
Бактерия хеликобактер пилори
7 февраля 2018
Многие желают узнать, как передается и лечится хеликобактер пилори – опасная бактерия, живущая в желудке, виновница хронического гастрита, эрозий, язв и даже рака желудка.
Что это за бактерия?
Как же воздействует хеликобактер на желудок? Уничтожает париетальные (пристеночные) клетки слизистой (внутренней) оболочки желудка, выбрасывая ядовитые продукты – токсины. Защитные клетки крови – нейтрофилы, лимфоциты и другие, преследуют вредителя, пытаясь уничтожить и его, и измененные париетальные клетки – возникает воспаление. Количество защитной слизи на участке пребывания бактерии заметно снижается, на измененный участок стремительно воздействует соляная кислота, усугубляя неизменное воспаление слизистой. Это проявляется болью в желудке «под ложечкой», изжогой, отрыжкой, налетом на языке, неприятным запахом изо рта, постоянной тошнотой, то есть симптомами хронического гастрита. Хроническое длительное воспаление слизистой оболочки желудка приводит к изменению ее клеток, вплоть до развития рака желудка.
Так что же теперь и в кафе со своей посудой ходить? К счастью, хеликобактер не устойчивая бактерия и обработки посуды в посудомоечной машине достаточно, чтобы ее уничтожить. Хорошие рестораны и кафе конечно оборудованы такими машинами, и посещать их можно без риска заражения.
Как узнать, есть ли у меня инфекция хеликобактер пилори?
У меня выявлен хеликобактер пилори – что делать?
При выявлении положительного анализа на хеликобактер пилори нужно обратиться за консультацией к гастроэнтерологу или терапевту. В лечении инфекции используются антибиотики, и назначает их только врач.
Можно ли вылечить хеликобактер приемом препарата де-нол, как показывают в рекламе, или народными средствами? Полностью избавиться от инфекции хеликобактер пилори можно только определенными антибиотиками.
Нужно ли мне травить себя антибиотиками, если меня ничего не беспокоит, а результат анализа на хеликобактер положительный? Инфекция может и не беспокоить, в 70% случаев так и происходит, гастрит годами протекает «молча», но через несколько лет вследствие вялотекущего воспаления возникает атрофия слизистой оболочки и нельзя исключить ее переход в рак желудка. В каждом конкретном случае решение о проведении лечения принимает лечащий врач.
Инфекция хеликобактер пилори очень распространена среди населения, есть ли смысл в лечении, если потом можно повторно заразиться? Да, повторное инфицирование возможно, но происходит не часто – примерно 6 человек из 100 пролеченных приобретают инфекцию вновь при несоблюдении правил профилактики. Они очень просты – мыть руки перед едой, не пробовать чужую еду, не есть в сомнительных забегаловках, где нет уверенности в правильной обработке посуды, не целовать не очень близких людей. Важно также при выявлении инфекции хеликобактер пилори проверить на нее всех членов семьи, начиная с подросткового возраста, и в идеале – пролечиться одновременно всем инфицированным. Детей, если ничего не беспокоит, лечат с подросткового возраста – с 12-13 лет. Если ребенок жалуется на боли в животе или тошноту, то обследование и лечение проводят по показаниям в более раннем возрасте.
Люди очень часто жалуются на обострение гастрита. А ведь во многих случаях его можно вылечить, избавившись от бактерии, которая вызвала воспаление желудка. Если инфекцию оставить без внимания, со временем, гастрит перейдет в атрофический. Тогда пациенту нужно будет минимум раз в год брать биопсию в 5-7 местах желудка, чтобы не пропустить рак.
Эрадикационная терапия Helicobacter Pylori
Марина Поздеева о принципах и схемах антихеликобактерной терапии
Колонизация Helicobacter pylori поверхности и складок слизистой оболочки желудка значительно затрудняет антибактериальную терапию. Успешная схема лечения основана на сочетании препаратов, которые предотвращают возникновение резистентности и настигают бактерию в различных участках желудка. Терапия должна гарантировать, что даже небольшая популяция микроорганизмов не останется жизнеспособной.
Эрадикационная терапия Helicobacter pylori включает комплекс нескольких препаратов. Распространенная ошибка, которая зачастую приводит к непредсказуемым результатам, — замена даже одного хорошо изученного препарата из стандартной схемы на другой препарат той же группы.
Ингибиторы протонной помпы (ИПП)
Терапия ИПП доказала эффективность в различных клинических исследованиях. Хотя in vitro ИПП и оказывают прямой антибактериальный эффект на H. pylori, тем не менее они не играют важной роли в эрадикации инфекции.
Механизм синергии ИПП при сочетании с противомикробными препаратами, который повышает клиническую эффективность эрадикационной терапии, полностью не установлен. Предполагается, что антисекреторные препараты группы ИПП могут способствовать повышению концентрации антимикробных средств, в частности метронидазола и кларитромицина, в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается, и концентрация, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильность антимикробных препаратов.
Препараты висмута
Висмут стал одним из первых препаратов для эрадикации H. pylori. Существуют доказательства, что висмут оказывает непосредственное бактерицидное действие, хотя его минимальная ингибирующая концентрация (МИК — наименьшее количество препарата, ингибирующее рост возбудителя) в отношении H. pylori слишком высока. Как и другие тяжелые металлы, такие как цинк и никель, соединения висмута снижают активность фермента уреазы, который принимает участие в жизненном цикле H. pylori. Кроме того, препараты висмута обладают местной антимикробной активностью, действуя непосредственно на клеточную стенку бактерий и нарушая ее целостность.
Метронидазол
H. pylori, как правило, очень чувствительны к метронидазолу, эффективность которого не зависит от pH среды. После перорального или инфузионного применения в желудочном соке достигаются высокие концентрации препарата, что позволяет достичь максимального терапевтического эффекта. Метронидазол — это пролекарство, которое в процессе метаболизма проходит активацию бактериальной нитроредуктазой. Метронидазол приводит к потере спиральной структуры ДНК H. pylori, в результате чего происходит поломка в ДНК и бактерия погибает.
Кларитромицин
Кларитромицин, 14‑членный макролид, представляет собой производное эритромицина с аналогичным спектром активности и показаниями к применению. Однако в отличие от эритромицина он более устойчив к воздействию кислот и имеет более длительный период полувыведения. Результаты исследований, доказывающих, что схема тройной эрадикационной терапии хеликобактер пилори с использованием кларитромицина дает положительный результат в 90 % случаев, привели к широкому использованию антибиотика.
В связи с этим в последние годы было зафиксировано увеличение распространенности устойчивых к кларитромицину штаммов H. pylori. Нет никаких доказательств того, что увеличение дозы кларитромицина позволит преодолеть проблему антибиотикорезистентности к препарату.
Амоксициллин
Антибиотик пенициллинового ряда, амоксициллин и структурно, и по спектру активности очень близок к ампициллину. Амоксициллин стабилен в кислой среде. Препарат ингибирует синтез клеточной стенки бактерий, действует и местно, и системно после абсорбции в кровоток и последующего проникновения в просвет желудка. H. pylori демонстрирует хорошую чувствительность к амоксициллину in vitro, однако для эрадикации бактерии требуется комплексная терапия.
Тетрациклины
Точкой приложения тетрациклинов является бактериальная рибосома. Антибиотик прерывает биосинтез белка и специфически связывается с 30‑S субъединицей рибосомы, исключая добавление аминокислот к растущей пептидной цепи. Тетрациклин доказал in vitro эффективность против H. pylori и сохраняет активность при низком pH.
Показания к эрадикационной терапии
В соответствии с принципами, утвержденными в Маастрихте в 2000 году (the Maastricht 2–2000 Consensus Report), эрадикация H. pylori настоятельно рекомендуется:
Необходимость проведения эрадикационной терапии пациентам с функциональной диспепсией, ГЭРБ, а также лицам, длительно принимающим нестероидные противовоспалительные препараты, пока остается предметом дискуссий. Доказательств того, что эрадикация H. pylori у подобных больных влияет на течение заболевания, нет. Однако хорошо известно, что у лиц с H. pylori, страдающих неязвенной диспепсией и корпус-преобладающим гастритом, повышается риск развития аденокарциномы желудка. Таким образом, эрадикацию H. pylori следует рекомендовать также и пациентам с неязвенной диспепсией, особенно если в гистологии выявляется корпус-преобладающий гастрит.
Аргумент против антихеликобактерной терапии у пациентов, принимающих НПВП, таков: организм защищает слизистую оболочку желудка от повреждающего действия лекарственных препаратов, повышая активность циклооксигеназы и синтез простагландина, а ИПП снижают естественную защиту. Тем не менее ликвидация H. pylori до назначения НПВП достоверно снижает риск язвенной болезни на фоне последующего лечения (исследование американских ученых под руководством Франсиса Чана (Francis K. Chan), опубликованное в The Lancet в 1997 году).
Эрадикационная терапия
Несмотря на применение комбинированных схем лечения, у 10–20 % пациентов, инфицированных H. pylori, не удается достичь элиминации возбудителя. Наилучшей стратегией считается подбор наиболее эффективной схемы лечения, однако не следует исключать возможность использования двух и даже более последовательных схем в случае недостаточной эффективности терапии выбора.
В случае неудачной первой попытки эрадикации H. pylori рекомендуют сразу перейти к терапии второй линии. Посев на чувствительность к антибиотикам и переход на схемы терапии спасения показан только тем пациентам, у которых терапия второй линии также не приведет к эрадикации возбудителя.
Одной из самых эффективных «схем спасения» является комбинация ИПП, рифабутина и амоксициллина (или левофлоксацина по 500 мг) на протяжении 7 дней. Исследование итальянских ученых, проведенное под руководством Фабрицио Перри (Fabrizio Perri) и опубликованное в Alimentary Pharmacology & Therapeutics в 2000 году, подтвердило, что схема с рифабутином эффективна против штаммов H. pylori, резистентных к кларитромицину или метронидазолу. Однако высокая цена рифабутина ограничивает его широкое применение.
Данные исследований подтверждают, что 10‑дневная схема терапии спасения, включающей рабепразол, амоксициллин и левофлоксацин, гораздо эффективнее, чем стандартная эрадикационная терапия второй линии (исследование итальянских ученых под руководством Энрико Ниста (Enrico C Nista), опубликованное в Alimentary Pharmacology & Therapeutics в 2003 году).
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Хеликобактер пилори igg положительный что это значит чем лечить
Выявление иммуноглобулинов класса G (IgG) к Helicobacter pylori в сыворотке крови, используемое для диагностики антрального и фундального гастрита, язвы желудка и двенадцатиперстной кишки, а также для контроля за их лечением.
Хеликобактер, иммуноглобулины класса G, IgG-антитела.
Синонимы английские
Helicobacter pylori Antibody, IgG; Anti-Helicobacter pylori antibody, IgG (quantitative).
Твердофазный хемилюминесцентный иммуноферментный анализ («сэндвич»-метод).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Инфицирование H. pylori сопровождается развитием местного и системного иммунного ответа. Вслед за транзиторным увеличением титра иммуноглобулинов класса М (IgM) следует продолжительное и значительное нарастание IgG-, а также IgA-антител в сыворотке крови. Определение концентрации иммуноглобулинов (серологическое исследование) применяют в диагностике хеликобактериоза. IgG обнаруживаются в 95-100 % случаев инфицирования H. pylori, IgA – в 68-80 %, а IgM – лишь в 15-20 %. Поэтому для подтверждения инфицирования H. pylori определяют концентрацию IgG в сыворотке крови. Этот анализ имеет ряд преимуществ перед другими лабораторными методами выявления хеликобактера.
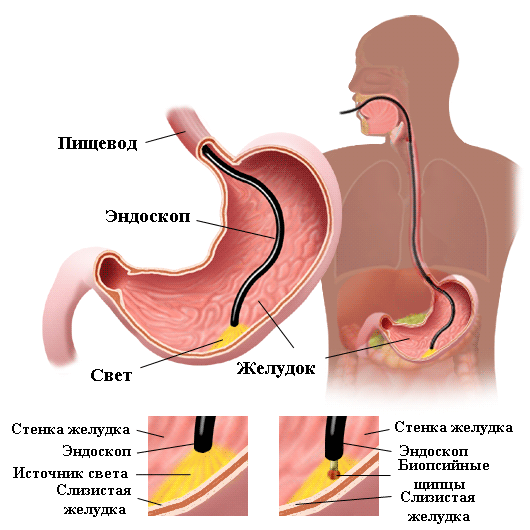
Определение IgG в крови не требует эндоскопического исследования, поэтому является более безопасным способом диагностики. Так как чувствительность теста сопоставима с чувствительностью большинства инвазивных анализов (быстрый уреазный тест, гистологическое исследование), он оказывается особенно полезным, когда выполнение эндоскопии не планируется. Следует, однако, отметить, что тест не выявляет непосредственно микроорганизм и зависит от особенностей иммунного ответа пациента. Так, например, иммунный ответ пожилых людей характеризуется пониженной выработкой специфических антител (любых, в том числе к H. pylori), что необходимо учитывать, если получен отрицательный результат анализа при клинических признаках диспепсии. Кроме того, иммунный ответ подавляется при приеме некоторых цитостатических препаратов.
Анализ на IgG может быть с максимальным успехом применен для диагностики первичного инфицирования H. pylori (например, при обследовании молодого пациента с впервые возникшими признаками диспепсии). В этой ситуации высокий титр IgG позволяет заподозрить активную инфекцию. Также положительный результат анализа у пациента (с признаками диспепсии в анамнезе или без них), не получавшего терапию, будет указывать на хеликобактериоз.
Интерпретация положительного результата анализа в случае, если была проведена терапия (или если антибиотики, обладающие активностью против H. pylori, были применены в других целях), имеет некоторые особенности. Уровень IgG остается высоким в течение длительного времени после полной гибели микроорганизма (около половины пациентов, вылечившихся от H. pylori, будут иметь высокие титры IgG еще 1-1,5 года). В результате положительный результат анализа у пациента, принимавшего антибиотики, не позволяет дифференцировать активную инфекцию и инфекцию в анамнезе и требует проведения дополнительных лабораторных исследований.
По этой же причине исследование на IgG не является основным тестом для диагностики эффективности терапии. Однако оно может быть применено с этой целью, если титр антител на момент начала болезни сравнивается с титром после окончания лечения. Считается, что снижение концентрации IgG на 20-25 % в течение 6 месяцев косвенно указывает на гибель микроорганизма. В то же время, если эта концентрация не снижается, это не означает неэффективность терапии. Отсутствие IgG-антител при повторном анализе свидетельствует об успешности лечения и избавлении от микроорганизма.
Количество IgG к H. pylori также является одним из компонентов, по которому судят о состоянии слизистой оболочки желудка (это так называемая серологическая биопсия).
Для чего используется исследование?
Для диагностики заболеваний, вызванных H. pylori, и контроля за их лечением:
Когда назначается исследование?
Что означают результаты?
Причины положительного результата
a) снижение титра антител на 20-25 % в течение 6 месяцев после окончания антибактериальной терапии косвенно указывает на гибель микроорганизма;
b) отсутствие тенденции к снижению IgG не говорит о неэффективности терапии.
Причины отрицательного результата:
Что может влиять на результат?
Иммунный ответ пожилых людей, а также пациентов, получающих иммуносупрессивную терапию, характеризуется пониженной выработкой специфических антител, в том числе к H. pylori, что приводит к большему числу ложноотрицательных реакций теста в этой группе пациентов.
Кто назначает исследование?
Гастроэнтеролог, педиатр, врач общей практики, инфекционист.
Хеликобактер пилори: когда язва желудка «заразна»
Гастритом сегодня «не удивить». Да и язва желудка – не редкость. Однако не все знают, что эти болезни бывают «заразны», если в процессе виновна бактерия. Но неужели заражаются все? И насколько это опасно? А также, чем лечить «желудочную» хеликобактер пилори?
Почему хеликобактер опасна
Хеликобактер пилори – бактерия особого класса, способная не только выживать, но и «процветать» в условиях агрессивной кислотной среды. При этом, провоцируя развитие гастрита, язвы и даже рака.
Но давайте по порядку.
В образовании эррозий и язв «виновны» ферменты бактерии:
Уреаза
обеспечивает синтез аммиака из белковой пищи. А последний, как щелочное соединение, разбавляет «желудочную» кислоту до нейтрального pH 6-7 (при исходной кислотности 1,5-2), тем самым создавая безопасную среду для «проживания» бактерии.
Однако накопление нужной концентрации аммиака, разумеется, не происходит в «одночасье». И в это время бактерия, казалось бы, должна быть беззащитна. Но здесь у возбудителя есть другой способ защиты.
Липаза, муциназа и протеаза
создают дыры в густом слое «антикислотной» слизи желудка, позволяя бактерии проникать «под» него и надежно «скрываться» от действия кислоты.
Чем больше площадь и количество таких «дыр», тем больше участков желудка оказываются оголены и подвержены «разъеданию» кислотой. При этом, логично предположить, что по мере накопления аммиака, кислотность должна бы снижаться. А вместе с ней и риск язвенных поражений.
Однако на деле продукция кислоты, наоборот, возрастает, в попытке вернуть должный желудочный pH. И оголенные участки подвергаются еще большему поражению, глубина которого может варьировать от минимальных эррозий до обширных язв и даже «сквозных дыр».
Но и это не вся опасность бактерии.
Экзотоксин VacA и особые cagA-эффекторные белки
хеликобактер оказывают влияние на геном желудочных клеток, изменяя их функции и искажая деление, чем провоцируют развитие рака. Присутствие бактерии на слизистой желудка приводит к хроническому воспалению, в слизистую приходят иммунные клетки – лимфоциты, происходит атрофия желудочных желез и нарушение созревания клеток поверхностных слоев желудка.
Связь хеликобактерной инфекции, гастрита с атрофией желез и рака желудка доказана не одним научным исследованием. И, к примеру, в Японии, где инфицированность бактерией повсеместна, даже существует национальная бесплатная программа по эррадикации (излечиванию) хеликобактер пилори. Позволившая значительно снизить заболеваемость раком желудка.
При этом, по какому «сценарию» пойдет хеликобактерная инфекция заранее предугадать невозможно. И у одних заражение протекает без последствий, а у других – заканчивается язвой или раком желудка.
Как передается бактерия
На сегодняшний день хеликобактер пилори считается одной из самых распространенных бактерий в мире.
И ввиду ее «места обитания», основными путями передачи приняты:
А источником всегда служит больной человек.
При этом, ранее считалось, что заражение может произойти через общую посуда или предметы личной гигиены.
Однако сегодня орально-оральный путь подлежит пересмотру.
Дело в том, что по данным некоторых исследований, в слюне зараженных не было обнаружено маркеров бактерии. Тогда как анализ кала, крови и/или уреазный дыхательный тест – все же демонстрировали инфицирование.
Таким образом, предполагается, что основным путем передачи все же является фекально-оральный (через «грязные» руки). Однако и орально-орально путь пока «никто не отменял».
Признаки заражения
А поводом для обследования служат любые проявления «желудочных» нарушений. А также наследственная предрасположенность к язве или раку.
Обследование строится на основании стадии процесса.
И в стадии обострения наибольшую информативность демонстрирует:
основан на способности бактерии образовывать аммиак. А последний вступает в реакцию с кислотой, с выделением углекислого газа, уровень которого и замеряется в процессе анализа.
Однако СО2, как известно, образуется и в процессе дыхания. Поэтому дыхательный тест подразумевает подсчет не обычного углекислого газа, а особого, содержащего меченые атомы углерода. Чтобы получить такие «метки», пациенту предлагается выпить специальный раствор мочевины (CH4N2O), содержащий те самые меченые атомы углерода ( 13 С). И, если хеликобактер присутствует в желудке, она «расщепит» мочевину до аммиака с образованием меченого углекислого газа.
Раствор не имеет ни вкуса, ни запаха. А также абсолютно безопасен и широко разрешен к применению у детей (старше 14 лет).
Подготовка к исследованию требует только прийти на голодный желудок (не менее 6 часов голода) и выпить 200 мл апельсинового или грейпфрутового сока за 10-15 минут до анализа. Чтобы немного замедлит продвижение желудочного содержимого, тем самым повышая интенсивность всасывания меченого углекислого газа в кровоток.
А замеры проводятся путем выдыхания воздуха в специальный «пакет» и не требуют взятия крови или иных материалов.
признан «золотым стандартом» диагностики хеликобактерной инфекции. Но, как уже было отмечено, показателе только в период обострения «желудочных» симптомов.
можно использовать в стадии ремиссии или в целях профилактического обследования.
Повышение уровня поможет подтвердить сам факт заражения. Однако результаты исследования сильно зависят от исходного состояния иммунитета.
Кислотность желудка
также может говорить о наличии атрофического гастрита, вызванного бактерией, правда по косвенным признакам.
А помочь в выявлении «кислотных» нарушений желудка призван комплексный анализ крови «Гастропанель».
Тест включает определение гастрина-17, пепсиногена I и II. Что позволяет своевременно выявлять риск атрофического гастрита, язвы и предраковых состояний без проведения гастроскопии («глотание лампочки»). Ввиду достоверной связи бактерии хеликобактер с указанными процессами, исследование также включает определение IgG к бактерии.
Как избавиться от бактерии
Эррадикация (полное уничтожение) хеликобактер пилори требует обязательного многокомпонентного подхода.
В составе терапии обязательно присутствуют:
Длительность приема антибиотиков в среднем составляет 14 дней, «антикислотной» терапии – до 4 недель, в зависимости от исходной степени нарушения.
А проверка эффективности лечения проводится с помощью уреазного теста или анализа кала на антигены бактерии. Причем не ранее, чем через 4 недели после окончания приема антибиотиков и висмута. И не ранее, чем через 2 недели – после последнего приема ингибиторов протонной помпы.
Схема лечения хеликобактер пилори: все современные методы эрадикационной терапии
Для выявления Хеликобактер пилори используется дыхательный уреазный тест, не требующий много времени, безвредный и не вызывающий никаких неприятных ощущений и представляющий собой золотой стандарт диагностики инфекции. Симптомы и лечение Хеликобактер пилори индивидуальны. Факт присутствия возбудителя в организме далеко не всегда сопровождается патологическими процессами и требует приема лекарственных препаратов.
Для выяснения и согласования лучших подходов к выявлению и лечению хеликобактерной инфекции в Европе была сформирована группа из ведущих специалистов гастроэнтерологов. Периодически на основании проводимых конференций и совещаний они публикуют протоколы – Маастрихтские консенсусы, по названию города, где проходили первые встречи.
Всего их на данный момент существует пять:
По результатам консенсуса «Маастрихт 2» было установлено, что, к сожалению, ни одна из проводимых схем эрадикации, несмотря на одновременное применение нескольких препаратов, не гарантирует полное уничтожение инфекции. В связи с этим было рекомендовано лечить пациентов сначала по схеме «первой линии», а затем при отсутствии терапевтического эффекта – по схеме «второй линии».
Необходимость проведения повторных курсов антихеликобактерной терапии объясняется повышением резистентности H. pylori к назначаемым антибиотикам, что является главной проблемой современной гастроэнтерологии при лечении ассоциированных с возбудителем заболеваний.
Применяемые сегодня, чтобы вылечить хеликобактерную инфекцию, эрадикационные схемы были утверждены на «Маастрихт 4».
Основными требованиями для них являются:
Интересно: Исторически первой успешно апробированной схемой эрадикации Хеликобактер пилори было применение субсалицилата висмута и Метронидазола. Испытал ее на себе ученый Барри Маршалл, обнаруживший совместно с коллегой Helicobacter pylori в слизистой желудка. В 1984 гг. он преднамеренно выпил содержимое чашки Петри с культурой бактерий, а затем вскоре после появления характерных симптомов спровоцированного гастрита провел указанное лечение. После 14 дней терапии по результатам биопсии возбудителя в желудке обнаружено не было.
Препараты I линии
Задачей эрадикационной терапии первой линии является уничтожение H. pylori у максимально возможного числа пациентов.
Согласно рекомендациям Маастрихт 3, назначают так называемую трехкомпонентную схему (тройная терапия), которая включает следующие препараты и дозировки в день:
Как ИПП, снижающие секрецию желудочного сока и выделение соляной кислоты, больных лечат следующими препаратами в указанных дозировках на один прием:
Минимальная продолжительность курса лечения составляет 7 дней. По ряду проведенных клинических исследований оказывается, что более эффективно принимать указанные препараты 10 или 14 дней. Чтобы была достигнута максимальная эрадикация Хеликобактер пилори и исключена вероятность рецидивов, тройную терапию при отсутствии противопоказаний и других ограничений нужно назначать в полном объеме и по дозировкам, и по срокам лечения.
Трехкомпонентную схему можно применять как первую линию терапии в странах, где частота устойчивых к действию кларитромицина штаммов H. pylori составляет менее 15–20%. Развитие устойчивости возбудителя к Кларитромицину объясняется частым назначением антибиотиков из группы макролидов при бактериальных осложнениях ОРВИ и респираторных заболеваниях у детей и взрослых. Если резистентность к Кларитромицину обнаруживается в среднем у 10% населения, то для Метронидазола этот показатель гораздо выше и составляет от 20 до 40%, что значительно ограничивает возможность применения этого антибактериального средства.
Как альтернатива трехкомпонентной эрадикационной терапии может использоваться четырехкомпонентная схема, дополнительно включающая висмута трикалия дицитрат (препарат Де-Нол) по 120 мг 4 раза в день. Если у больного с диагностированной хеликобактерной инфекцией имеется атрофия слизистой желудка, сопровождающаяся отсутствием продукции соляной кислоты, то назначать ИПП в данном случае не надо, поэтому их исключают, оставляя висмута трикалия дицитрат.
Для пациентов пожилого возраста, у которых ввиду высокого риска осложнений при назначении сразу двух антибиотиков, проведение полноценной антихеликобактерной терапии первой линии невозможно, рекомендуется следующая сокращенная схема лечения на 14 дней:
При наличии показаний у пожилых пациентов антибиотик может быть вообще отменен. При этом прием препаратов висмута назначают на 28 дней, при болевых ощущениях дополнительно выписывают короткий курс ИПП.