Гийена барре заболевание что это такое
Синдром Гийена-Барре
Основные факты
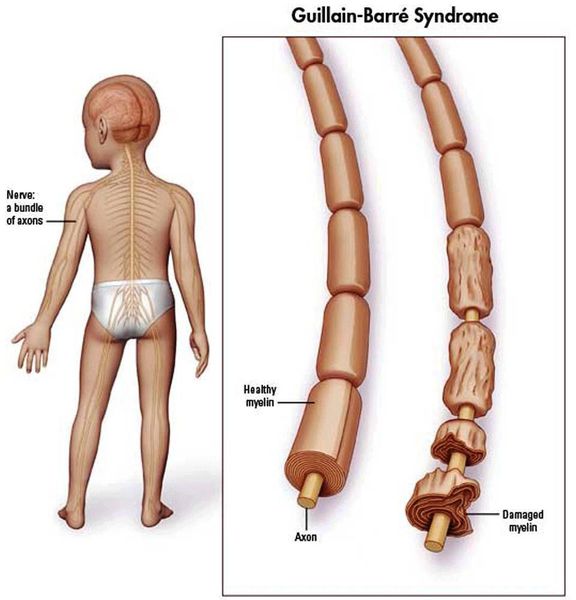
При синдроме Гийена-Барре иммунная система человека поражает часть периферической нервной системы. При этом синдроме могут быть затронуты нервы, контролирующие движения мышц или передающие болевые, температурные и осязательные ощущения. Это может приводить к мышечной слабости и потере чувствительности в ногах и/или руках.
Это редкое заболевание, оно может поражать людей в любом возрасте, но чаще всего он встречается у взрослых людей и у мужчин.
Симптомы
Обычно симптомы длятся несколько недель, и большинство людей выздоравливают без каких-либо длительных, тяжелых неврологических осложнений.
Причины
Синдрому Гийена-Барре нередко предшествует та или иная инфекция, которая может быть бактериальной или вирусной. Толчком к развитию синдрома Гийена-Барре также может послужить вакцинация или хирургическая операция.
В контексте вирусной инфекции Зика в затронутых странах был отмечен неожиданный рост числа случаев синдрома Гийена-Барре. Наиболее вероятное объяснение имеющихся фактических данных о вспышках вирусной инфекции Зика и синдрома Гийена-Барре состоит в том, что вирусная инфекция Зика выступает одной из причин развития синдрома Гийена-Барре.
Диагностика
Диагностика основана на симптомах и результатах неврологического осмотра, в том числе таких, как снижение или утрата глубоких сухожильных рефлексов. Для получения вспомогательной информации может быть произведена спинномозговая пункция, однако это не должно вести к отсрочке лечения.
Для того, чтобы диагностировать синдром Гийена-Барре не требуется других исследований, таких как анализы крови, которые служат для определения причин возникновения синдрома, и эти исследования не должны вести к отсрочке лечения.
Лечение и уход
Ниже приводятся рекомендации по лечению пациентов с синдромом Гийена-Барре и уходу за ними:
Деятельность ВОЗ
ВОЗ оказывает странам поддержку в ведении синдрома Гийена-Барре в контексте вирусной инфекции Зика следующим образом:
Что такое синдром Гийена — Барре? Причины возникновения, диагностику и методы лечения разберем в статье доктора Жуйков А. В., невролога со стажем в 20 лет.
Определение болезни. Причины заболевания
Синдром Гийена-Барре (ГБС) — острое аутоиммунное заболевание, которое охватывает группу острых нарушений периферической нервной системы. Характеризуется мышечной слабостью, а также болью и ползанием мурашек в начале болезни из-за поражения чувствительных волокон. Каждый вариант нарушений характеризуется особенностями патофизиологии и клинического распределения слабости в конечностях и черепных нервах.
У 70% пациентов с ГБС наблюдалось предшествующее инфекционное заболевание перед появлением неврологических симптомов.
Симптомы синдрома Гийена — Барре
Симптомы ОРВИ или расстройства желудочно-кишечного тракта отмечаются у 2/3 пациентов. Первыми симптомами ГБС являются парестезии пальцев конечностей, за которыми следует прогрессирующая слабость мышц нижних конечностей и нарушения походки. Болезнь прогрессирует в течение нескольких часов или дней, возникает слабость верхних конечностей и развиваются паралич черепных нервов. Параличи обычно симметричны и носят, конечно, периферический характер. У половины пациентов боль может быть первоначальной жалобой, что затрудняет диагноз. Атаксия и боль чаще встречаются у детей, чем у взрослых. Задержка мочи наблюдается у 10%-15% больных. Поражение вегетативных нервов проявляются головокружениями, гипертонией, чрезмерным потоотделением и тахикардией.
При объективном обследовании выявляется восходящая мышечная слабость, а также арефлексия. Сухожильные рефлексы нижних конечностей отсутствуют, но рефлексы верхней конечности могут вызываться. Мышечная слабость может задействовать и респираторные мышцы. Поражение черепных нервов отмечается в 35-50%, вегетативная нестабильность в 26%-50%, атаксия — в 23%, дизестезия — в 20% случаев. [1]
Наиболее распространенными признаками вегетативной дисфункции являются синусовая тахикардия или брадикардия и артериальная гипертония. У пациентов с тяжелой вегетативной дисфункцией наблюдаются изменения периферического вазомоторного тонуса с гипотензией и лабильностью артериального давления.
Нечастые варианты клинического течения болезни включают лихорадку в начале неврологических симптомов, тяжелую сенсорную недостаточность с болью (миалгии и артралгии, менингизм, корешковая боль), дисфункции сфинктеров.
Возможность ГБС должна рассматриваться у любого пациента с быстрым развитием острой нервно-мышечной слабости. На ранней стадии ГБС следует отличать от других заболеваний с прогрессирующей симметричной мышечной слабостью, включая поперечный миелит и миелопатию, острую токсическую или дифтеритическую полиневропатию, порфирию, миастению и нарушения электролитного обмена (например, гипокалиемия).
Патогенез синдрома Гийена — Барре
Нейрофизиологические процессы, лежащие в основе ГБС, подразделяются на несколько подтипов. Наиболее распространенные подтипы включают:
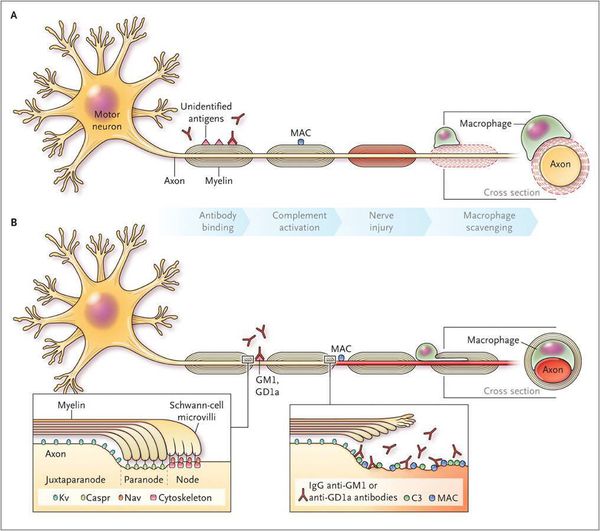
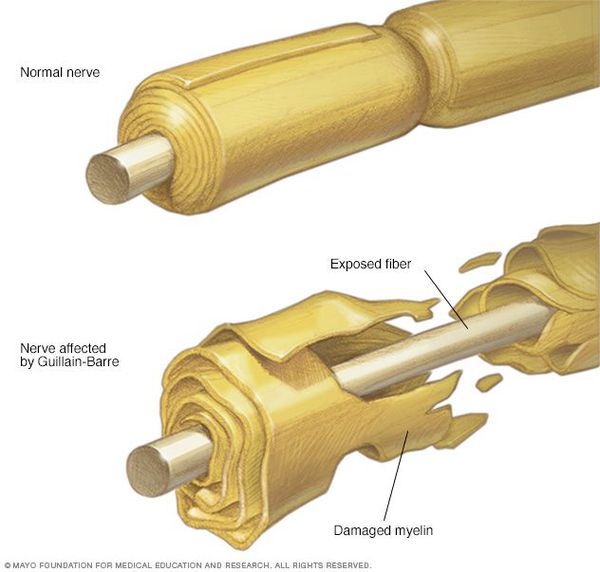
Считается, что ГБС развивается вследствие выработки антител против белка инфекционного агента, которые перекрестно реагируют с ганглиозидами нервных волокон человека. Аутоантитела связываются с миелиновыми антигенами и активируют комплемент, с формированием мембранно-атакующего комплекса на внешней поверхности клеток Шванна. Повреждение оболочек нервных стволов приводит к нарушениям проводимости и мышечной слабости (на поздней стадии может происходить и аксональная дегенерация). Демиелинизирующее поражение наблюдается по всей длине периферического нерва, включая нервные корешки.
Поражаются все типы нервов, в том числе вегетативные, моторные и сенсорные волокна. Вовлечение двигательных нервов происходит значительно чаще, чем сенсорных.
Осложнения синдрома Гийена — Барре
Пациенты с ГБС подвержены риску опасных для жизни респираторных осложнений и вегетативных нарушений.
Показания для перевода в отделение интенсивной терапии включают:
Осложнения проводимого лечения, требующие интенсивной терапии, включают перегрузку жидкостью, анафилаксию на введение внутривенного иммуноглобулина или гемодинамические нарушения при проведении плазмафереза.
У 15%-25% детей с ГБС развивается декомпенсированная дыхательная недостаточность, которая требует механической вентиляции легких. [2] Респираторные нарушения чаще встречается у детей с быстрым прогрессированием заболевания, слабостью верхних конечностей, вегетативной дисфункцией и поражениями черепных нервов. Интубация трахеи может потребоваться у больных для защиты дыхательных путей, проведения механической вентиляции легких. При ГБС быстрое прогрессирование, двусторонний паралич лицевого нерва и вегетативная дисфункция предопределяют повышенную вероятность интубации. Необходимо планирование ранней интубации для минимизации риска осложнений и необходимости проведения экстренной интубации.
Вегетативная дисфункция повышает риск эндотрахеальной интубации. С другой стороны, дисавтономия может увеличить риск гемодинамических реакций на препараты, используемые для индукции анестезии во время интубации.
Признаки, указывающие на необходимость механической вентиляции легких: [4]
Вегетативная дисфункция является основным фактором смертности при ГБС. Фатальный сердечно-сосудистый коллапс из-за вегетативной дисфункции наблюдается у 2%-10% тяжелобольных пациентов. [3] Мониторинг частоты сердечных сокращений, артериального давления и электрокардиограммы следует продолжать до тех пор, пока пациенты нуждаются в респираторной поддержке. Чрескожная кардиостимуляция может потребоваться при выраженной брадикардии. Гипотония корректируется восполнением объема циркулирующей крови (ОЦК), и, если пациент невосприимчив к восполнению ОЦК, применяются α-агонисты, такие как норадреналин, мезатон, адреналин.
При нестабильной гемодинамике непрерывная регистрация артериального и центрального венозного давления должна проводиться для контроля объема инфузионной терапии.
Артериальная гипертензия может возникать, но это осложнение не требует специального лечения, если оно не осложняется отеком легких, энцефалопатией или субарахноидальным кровоизлиянием.
Диагностика синдрома Гийена — Барре
Инструментальная диагностика
Люмбальная пункция
При люмбальной пункции результаты СМЖ обычно показывают повышенный уровень белка (> 45 мг/дл), без плеоцитоза ( Электронейромиография) — единственный инструментальный метод диагностики, позволяющий подтвердить диагноз ГБС и уточнить характер патологических изменений (демиелинизирующий или аксональный) и их распространенность. [3]
Игольчатая электромиография характеризуется наличием признаков текущего денервационно-реиннервационного процесса при полинейропатии. Исследуют дистальные мышцы верхних и нижних конечностей (например, переднюю большеберцовую мышцу, общий разгибатель пальцев), а при необходимости и проксимальные мышцы (например, четырёхглавую мышцу бедра).
ЭНМГ-исследование у больных с ГБС зависит от клинических проявлений:
Оценка основных ЭНМГ- параметров:
Первые признаки денервационного процесса появляются через две-три недели после начала заболевания, признаки реиннервационного процесса — через месяц.
Лечение синдрома Гийена — Барре
Общее поддерживающее лечение и уход
Пациенты, требующие интенсивной терапии, требуют тщательного общего ухода. Запор наблюдается более чем в 50% случаев пациентов с ГБС в результате динамической непроходимости кишечника.
При боли применяют парацетамол. Катадолон и трамадол применяют при выраженном болевом синдроме. При нейропатической боли эффективны карбамазепин и габапентин.
В лечении ГБС предпринимаются различные виды иммуномодулирующей терапии. [1] [2]
Внутривенный иммуноглобулин назначают в виде ежедневной инфузии (в дозе 0,4 гр/кг/день) в течение 5 дней в первые 2 недели болезни. Второй курс иммуноглобулина может потребоваться 5%-10% пациентов, при отрицательной динамике после первоначального улучшения. Механизм действия внутривенного иммуноглобулина, вероятно, многофакторный и, как полагают, включает модуляцию активации комплемента, нейтрализацию идиотипических антител, подавление воспалительных медиаторов (цитокины, хемокины).
Побочные эффекты иммуноглобулина включают головную боль, миалгию и артралгию, гриппоподобные симптомы, лихорадку. У пациентов с дефицитом IgA может развиться анафилаксия после первого курса внутривенного иммуноглобулина.
Плазмаферез способствует удалению антител, вовлеченных в патогенез ГБС. В течение каждого сеанса 40-50 мл/кг плазмы заменяют смесью 0,9% раствора хлорида натрия и альбумина. Проведение плазмафереза приводит к сокращению времени выздоровления и снижению потребности в искусственной вентиляции. Эти преимущества очевидны, если плазмаферез проводится в течение первых двух недель после начала болезни. Осложнения, связанные с плазмаферезом, включают гематому в области венопункции, пневмоторакс после катетеризации подключичной вены и сепсис. Плазмаферез противопоказан пациентам с тяжелой гемодинамической нестабильностью, кровотечением и сепсисом.
Комбинация плазмафереза и иммуноглобулина не показала клинических преимуществ.
Кортикостероиды не должны использоваться при лечении ГБС, т. к. не ускоряют выздоровление, не уменьшают вероятность ИВЛ и не влияют на долгосрочный результат. [2]
Прогноз. Профилактика
ГБС остается серьезным заболеванием, несмотря на улучшение результатов лечения. По сравнению со взрослыми, у детей чаще отмечается более благоприятное течение заболевания, с полным, а не частичным выздоровлением. Причинами неблагоприятного исхода при ГБС являются дыхательная недостаточность, осложнения искусственной вентиляции легких (пневмония, сепсис, острый респираторный дистресс-синдром и тромбоэмболические осложнения), остановка сердца, вторичная по отношению к дисавтономии.
Младшая возрастная группа (менее 9 лет), быстрое прогрессирование и максимальная мышечная слабость, потребность в искусственной вентиляции легких являются важными предикторами длительного двигательного дефицита. [4]
Синдром Гийена-Барре
Всегда ли синдром Гийена-Барре протекает тяжело?
СГБ протекает с разной степенью тяжести. Встречаются легкие и среднетяжелые формы, когда пациент сохраняет способность ходить. Это характерно для большинства пациентов. Тяжелые и крайне тяжелые формы заболевания, при которых пациент обездвижен и нуждается в искусственной вентиляции легких из-за слабости дыхательной мускулатуры, отмечаются у каждого четвертого пациента.
Проведение ЭНМГ-исследования необходимо во всех случаях при подозрении на СГБ, поскольку данный метод позволяет не только подтвердить поражение периферических нервов, но и уточнить характер их повреждения, следовательно определить форму заболевания. Исследование пациентов в ранние сроки заболевания (когда симптоматика только нарастает и очень важно быстро поставить диагноз) имеет особенности, поэтому должно быть проведено хорошо подготовленным и опытным специалистом на миорафе высокого класса. Методологические ошибки и недостаточный объем данного исследования часто приводят к ошибочным диагнозам. Поэтому мы рекомендуем проведение ЭНМГ в нашем центре.
Патогенетическая терапия используются, прежде всего, с целью прерывания «аутоиммунной агрессии», развивающейся при СГБ. При этом предполагается достичь торможения дальнейшего развития заболевания, снизить длительность периода нарастания симптоматики, ускорить начало периода восстановления и добиться максимально полного выздоровления.
Глюкокортикостероиды при СГБ неэффективны и ухудшают прогноз!
К неспецифическим методам лечения относят симптоматическую терапию и реабилитацию. При этом восстановительное лечение является ключевым как в остром, так и в отдаленном периодах. Прием нейрометаболических, ноотропных препаратов, витаминов группы В при СГБ не рекомендован ни в остром периоде, ни в восстановительном, в связи с отсутствием доказательной базы.
ФГБНУ НЦН уже многие годы занимается диагностикой и лечением пациентов с синдромом Гийена-Барре. Коллективом ФГБНУ НЦН во главе с член-корреспондентом РАН Супоневой Н.А. подготовлены клинические рекомендации по ведению данной категории пациентов (в настоящий момент проходят утверждение).
Сотрудники центра заболеваний периферической нервной системы консультируют пациентов амбулаторно в рамках ОМС и на коммерческой основе.
ЗАПИСЬ НА ПРИЕМ И ЭНМГ/иЭМГ ПО МНОГОКАНАЛЬНОМУ ТЕЛЕФОНУ
+7 (495) 374-77-76
+7 (985) 931-60-24
Синдром Гийена–Барре
Острая воспалительная демиелинизирующая полирадикулоневропатия (синдром Гийена–Барре). Описана французскими невропатологами Г. Гийеном и Дж. Барре в 1916 г. Причина болезни остается недостаточно выясненной. Часто она развивается после предшествующей острой инфекции. Возможно, заболевание вызывается фильтрующимся вирусом, но так как до настоящего времени он не выделен, большинство исследователей считают природу заболевания аллергической. Заболевание рассматривается как аутоиммунное с деструкцией нервной ткани, вторичной по отношению к клеточным иммунным реакциям. Обнаруживаются воспалительные инфильтраты в периферических нервах, а также корешках, сочетающихся с сегментарной демиелинизацией.
Что провоцирует / Причины Синдрома Гийена-Барре:
Патогенез (что происходит?) во время Синдрома Гийена-Барре:
Важную роль в патогенезе СГБ играют метаболические нарушения. Отмечаются изменения в системе простаноидов и перекисного окисления липидов (ПОЛ). В крови значительно изменяется соотношение между про- и антиоксидантами, повышается содержание малонового диальдегида. Поскольку мембраны шванновских клеток образованы в основном липидами, активация ПОЛ способствует их дестабилизации и разрушению. Увеличивается суммарная концентрация общего пула простаноидов и их отдельных компонентов: простагландинов, простациклина и тромбоксана А. Это усиливает воспалительные и демиелинизирующие реакции и, возможно, повышает проницаемость барьера между кровью и периферическими нервами. Патоморфологические изменения характеризуются клеточной инфильтрацией периферической нервной системы лимфоцитами и макрофагами с последующей деструкцией миелина.
Симптомы Синдрома Гийена-Барре:
Заболевание начинается с появления общей слабости, повышения температуры тела до субфебрильных цифр, болей в конечностях. Иногда боли носят опоясывающий характер. Главным отличительным признаком болезни служит мышечная слабость в конечностях. Появляются парестезии в дистальных отделах рук и но г, а иногда вокруг рта и в языке. Тяжелые нарушения чувствительности возникают редко. Могут возникать слабость лицевых мышц, поражения других черепных нервов и вегетативные нарушения.
Поражения нервов бульбарной группы при отсутствии дыхательной реанимации могут приводить к летальному исходу. Двигательные нарушения раньше возникают в ногах, а затем распространяются на руки. Возможны поражения преимущественно проксимальных отделов конечностей; при этом возникает симптомокомплекс, напоминающий миопатию. Нервные стволы болезненны при пальпации. Могут быть симптомы натяжения (Ласега, Нери).
Особенно выражены вегетативные нарушения – похолодание и зябкость дистальных отделов конечностей, акроцианоз, явления гипергидроза, иногда имеются гиперкератоз подошв, ломкость ногтей.
Типична белково-клеточная диссоциация в цереброспинальной жидкости. Уровень белка достигает 3–5 г/л. Высокая концентрация белка определяется как при люмбальной, так и окципитальной пункции. Этот критерий очень важен для отличия синдрома Гийена–Барре от спинальной опухоли, при которой высокие концентрации белка обнаруживаются только при люмбальной пункции. Цитоз не более 10 клеток (лимфоциты и моноциты) в 1 мкл.
Заболевание обычно развивается в течение 2–4 нед, затем наступает стадия стабилизации, а после этого – улучшение. Кроме острых форм, могут встречаться подострые и хронические. В подавляющем большинстве случаев исход заболевания благоприятный, но наблюдаются также формы, протекающие по типу восходящего паралича Ландри с распространением параличей на мышцы туловища, рук и бульбарную мускулатуру.
Диагностика Синдрома Гийена-Барре:
Лечение Синдрома Гийена-Барре:
Наиболее активным методом терапии является плазмаферез с внутривенным введением иммуноглобулина. У больных частично удаляют плазму крови, возвращая форменные элементы. Применяются также глюкокортикоиды (преднизолон по 1–2 мк/кг в сутки), антигистаминные средства (димедрол, супрастин), витаминотерапия (группа В), антихолинэстеразные препараты (прозерин, галантамин). Важное значение имеет уход за больным с тщательным контролем за состоянием дыхательной и сердечно-сосудистой систем. Дыхательная недостаточность в тяжелых случаях может развиваться очень быстро и приводит к смерти при отсутствии адекватной терапии. Если у больного жизненная емкость легких оказывается менее 25–30 % предполагаемого дыхательного объема или имеются бульбарные синдромы, рекомендуется интубация или трахеотомия для проведения искусственной вентиляции легких. Выраженную артериальную гипертензию и тахикардию купируют применением антагонистов ионов кальция (коринфар) и бета-адреноблокаторов (пропранолол). При артериальной гипотензии внутривенно вводят жидкости с целью увеличения внутрисосудистого объема. Необходимо каждые 1–2 ч осторожно менять положение больного в постели. Острая задержка мочевыделения и расширение мочевого пузыря могут вызвать рефлекторные нарушения, приводящие к колебаниям артериального давления и пульса. В таких случаях рекомендуется применение постоянного катетера. В восстановительном периоде назначают ЛФК для предупреждения контрактур, массаж, озокерит, парафин, четырехкамерные ванны.
Профилактика Синдрома Гийена-Барре:
Большинство больных имеет перспективы хорошего восстановления.
В восстановительном периоде важно проведение физиотерапии (массаж), электростимуляции мышц глотки (если имеются нарушения глотания) и занятия лечебной физкультурой. Состояние больного оценивается как клинически, так и объективно, с помощью электронейромиографии.
К каким докторам следует обращаться если у Вас Синдром Гийена–Барре:
Лечение больных синдромом Гийена-Барре
Острая воспалительная демиелинизирующая полирадикулоневропатия или синдром Гийена-Барре (СГБ) – это аутоиммунная полинейропатия, характеризующаяся быстро развивающимися (менее чем за 4 недели) двигательными нарушениями в конечностях и (или) поражением черепных нервов в сочетании с белково-клеточной диссоциацией в цереброспинальной жидкости.
Частота заболеваемости СГБ в мире составляет 0,6-2,4 случая на 100 тыс. населения [1,2,3]. Согласно данным, представленными Супоневой Н.А. и соавт. (2014), в России ежегодно СГБ заболевают около 2700 человек [4].
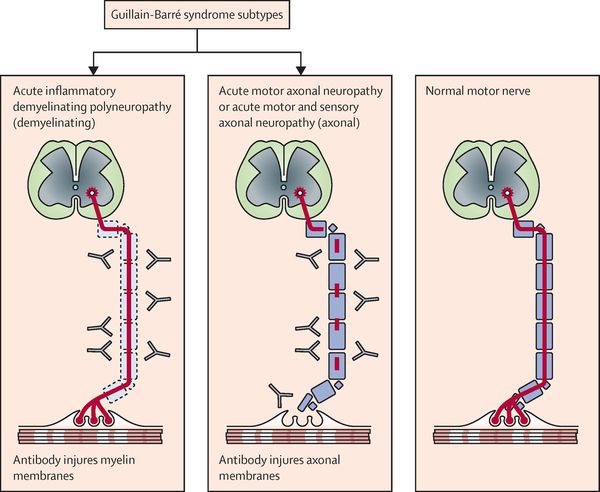
В зависимости от начала аутоиммунного процесса выделяют четыре клинических вариантов СГБ [2,5,6,7]:
1. Острая воспалительная демиелинизирующая полиневропатия (ОВДП) (70-80% случаев) считается классической формой СГБ.
2. Острая моторная аксональная невропатия (ОМАН) (10-15%) характеризуется изолированным поражением двигательных волокон.
3. Острая моторно-сенсорная аксональная невропатия (ОМСАН) (5%) проявляется в виде поражения двигательных и чувствительных волокон.
4. Синдром Миллера-Фишера (не превышает 3%) характеризуется офтальмоплегией, мозжечковой атаксией при слабовыраженных парезах.
В двух трети случаев развитию СГБ предшествует вирусная или кишечная инфекция [4]. В качестве инфекционных агентов могут выступать такие возбудители, как Campylobacter jejuni, Mycoplasma pneumonia, цитомегаловирус, вирус Эпштейна-Барр и вирус гриппа [3,8].
Инфекционные агенты являются пусковым механизмом, который приводит к развитию аутоиммунного поражения периферической нервной системы. В настоящее время доказано, что в основе патогенеза СГБ лежит механизм молекулярной мимикрии, которая приводит к продукции аутоантител к антигенам периферической нервной системы [7,9]. Одним из доказательств участия в воспалении инфекционных агентов является обнаружение у больных высокого титра антител к ганглиозидам GM1, GD1a, GD1b и GQ1b на фоне возросшего титра антител к предполагаемому возбудителю [9,11,13].
Клиническая картина в развернутой стадии СГБ, обычно складывается из двигательных, чувствительных и вегетативных нарушений; сухожильной гипо- или арефлексии. Наиболее часто встречаются двигательные расстройства, характеризующиеся периферическими, преимущественно дистальными парезами с мышечной гипотонией и угасанием сухожильных рефлексов, Возможно развитие диффузной спонтанной (симметричной, двусторонней) миалгии до проявления двигательных расстройств. Примерно у 25% больных в результате дальнейшего прогрессирования заболевания развивается парез диафрагмы и дыхательной мускулатуры, что приводит к дыхательной недостаточности [1,8].
Плазмаферез (ПФ) и внутривенное введение иммуноглобулина класса G (IgG) являются эффективным методом лечения СГБ в течение первых недель заболевания [1,5].
ПФ применяется у больных СГБ с 1985 года. Согласно рекомендациям Американского Общества Афереза (2010) целью ПФ является удаление 200-250 мл/кг плазмы в течение 7-14 дней. Замещение удаляемого объёма плазмы производится 5% альбумином. Показаниями для проведения ПФ является нарастающая неврологическая симптоматика, требующая искусственной вентиляции лёгких, неспособность пройти более 5 м с опорой или поддержкой, или неспособность встать и пройти 5 м самостоятельно в соответствии с Североамериканской шкалой тяжести двигательного дефицита (САШ) (табл. 1) [12,13,14].
Североамериканская шкала тяжести двигательного дефицита
Минимальные двигательные расстройства
Способность проходить 5 м без поддержки (опоры)
Способность проходить 5 м с поддержкой (опорой)
Невозможность проходить 5 м с поддержкой или опорой (прикованность к постели или инвалидной коляски)
Необходимость проведения ИВЛ
Внутривенное введение высоких доз IgG было признано эффективным методом лечения СГБ, способным существенно уменьшать продолжительность и тяжесть заболевания [14]. Для лечения СГБ IgG используются в дозе 0,4 г/кг в течение 2-5 суток. Американская Неврологическая Академия (2003) рекомендовала применение IgG у больных с продолжительностью заболевания не превышающей 2 недели [15].
В настоящее время в нашем стационаре накоплен опыт лечения больных СГБ.
Целью исследования является изучение клинической эффективности патогенетической терапии у больных СГБ.
Материалы и методы
В исследование был включён 21 больной СГБ (12 мужчин и 9 женщин). Возраст больных колебался от 19 до 77 лет. Средний возраст всех больных СГБ составлял 53,5±3,74 года.
Больные по этиологической причине СГБ распределились следующим образом: «острая респираторная вирусная инфекция» – 71,4%, «кишечная инфекция» – 23,8% и не установленная этиологическая причина – 4,8%.
Распределение больных по формам СГБ и степени тяжести двигательного дефицита представлено в таблице 2.
Распределение больных синдромом Гийена-Барре по форме заболевания, времени года.
Примечание: СГБ – синдром Гийена-Барре; ОВДП – острая воспалительная демиелинизирующая полиневропатия; ОМАН – острая моторная аксональная невропатия; ОМСАН – острая моторно-сенсорная аксональная невропатия.
Всем больным, поступавшим в стационар, проводили следующие виды терапии (табл. 3).
Распределение больных синдромом Гийена-Барре в зависимости
Процент от общего количества больных
Примечание: ПФ – плазмаферез; IgG – иммуноглобулин класса G.
1. ПФ проводился на сепараторе клеток крови AS-204 (Fresenius, Германия) с непрерывно-поточным разделением крови на клеточные элементы и плазму. Объём удаляемой плазмы за курс ПФ строился из расчёта 200 мл удаляемой плазмы на 1 кг веса больного, замещение удаляемого объёма плазмы проводилось растворами кристаллоидов, коллоидов и 10% или 20% альбумина. Протокол терапии состоял из 4-6 сеансов ПФ, в течение 7-12 суток. Антикоагуляцию осуществляли постоянной инфузией гепарина в экстракорпоральный контур в дозе 5 ед/кг/час.
Для обеспечения сосудистого доступа во время сеансов ПФ катетеризировали одну из центральных вен (подключичную или внутреннюю ярёмную вену). Для адекватного кровотока использовали двухпросветный рентгеноконтрастный катетер 9 Fr, установленный по методу Сельдингера.
2. Внутривенное введение иммуноглобулина класса G (IgG) проводилось из расчёта 0,4 г на 1 кг веса больного в течение 5 суток.
Больным, поступившим в стационар, проводилось комплексное обследование. Включавшее в себя сбор анамнеза, общий осмотр, оценка неврологического статуса и определение степени тяжести двигательного дефицита по Североамериканской шкале тяжести двигательного дефицита (САШ) (табл. 1), лабораторные исследования, применение методов нейровизуализации, выполнение люмбальной пункции и электронейромиографии.
Эффективность терапии оценивалась по динамике изменения неврологической симптоматики и изменению степени тяжести двигательного дефицита по САШ.
Результаты и их обсуждение
Срок госпитализации в стационар пролеченных больных от момента появления симптомов заболевания составил 10,6±2,36 суток. У всех больных в клинической картине наблюдался периферический парез различной степени выраженности, снижение или отсутствие сухожильных рефлексов, онемение в конечностях и миалгии. Электронейромиография выполнялась 47,6% больным. В стационаре преобладали больные с тяжёлой степенью двигательного дефицита по САШ (табл. 4).
Распределение больных синдромом Гийена-Барре по степени тяжести двигательного дефицита в баллах, САШ
Степень тяжести двигательного дефицита, балл
Процент от общего количества больных
СГБ является одним из самых частых причин острых периферических параличей в мире. Как видно из таблицы 2 набольшее число случаев СГБ регистрировалось в зимний и весенний периоды года. В нашем исследовании основным пусковым фактором заболевания являлась острая респираторная вирусная инфекция, которая составила 71,4% от всех этиологических причин, которые предшествовали развитию СГБ. Существенных различий в половой структуре не было, количество мужчин и женщин, заболевших СГБ, было практически одинаково, что соответствует результатам, полученным Супоневой Н.А. и соавт. (2014) [4].
У 23,8% больных отмечались бульбарные расстройства и у 14,3% больных в связи с тяжёлой дыхательной недостаточностью, проводилась искусственная вентиляция лёгких, продолжительностью 19,7±4,58 суток.
По результатам лабораторных методов диагностики белково-клеточная диссоциация ликвора отмечалась у 57,1% больных.
Лечение больных с использованием указанных выше методов терапии начиналось на 2,7±0,43 сутки от момента госпитализации и постановки окончательного диагноза. На фоне проводимой терапии регресс неврологической симптоматики и изменение степени тяжести двигательного дефицита по САШ регистрировали у 71,4% больных. В двух случаях удалось остановить прогрессирование дыхательной недостаточности и необходимость в искусственной вентиляции лёгких. У 19,0% больных после проведенной терапии достигнут эффект «плато», неврологический дефицит остался на прежнем уровне без ухудшения состояния.
Время пребывания больных в стационаре составило 30,8±3,87 суток.
Заключение.
В настоящее время патогенетической терапией СГБ считается ПФ и внутривенное введение IgG. Эффективность данных методов доказана многочисленными рандомизированными исследованиями [1,13,15]. Как видно из таблицы 3 основным методом лечения СГБ являлся ПФ, который применялся у 95,2% больных, как монотерапия, так и в сочетании с внутривенным введением IgG. Высокая частота применения ПФ связана с возможностью быстрого начала лечения больных СГБ по сравнению с IgG. Для эффективного лечения препаратами IgG необходимо чтобы концентрация IgG превышала 90% [1]. Данное условие не всегда можно выполнить в короткий период времени. Это становиться особенно актуальным у больных с тяжёлой и крайне тяжёлой стадиями заболевания, когда существует реальная угроза развития дыхательной недостаточности или больной уже находится на искусственной вентиляции лёгких. Сочетание ПФ и IgG у одного из больных было связано с рефрактерным течением ОВДП.
Таким образом, подводя итоги можно отметить, что патогенетическая терапия с использованием ПФ, является эффективным методом лечения больных СГБ, позволяющая купировать прогрессирование периферических парезов и предупредить развитие жизнеугрожающих осложнений. Полученные нами положительные результаты, сопоставимы с литературными данными [5,7,13,15]. Достигнутые результаты лечения больных СГБ на наш взгляд связаны с тем, что нам удалось максимально сократить сроки начала патогенетической терапии, в первую очередь ПФ, от момента поступления больного в стационар и постановки диагноза до начала лечения, тем самым уменьшить прогрессирование неврологической симптоматики, риска присоединение гнойно-септических осложнений, прогрессирования дыхательной недостаточности и сроков проведения ИВЛ. В совокупности это позволило уменьшить сроки госпитализации.
Список литературы