Гипорефлексия у новорожденных что
Перинатальная гипоксическая энцефалопатия
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Перинатальная гипоксическая энцефалопатия является частым осложнением патологии беременности и родов и диагносцируется у новорожденных до 5% случаев [1]. Перинатальные повреждения мозга составляют более 60% всей патологии нервной системы детского возраста, непосредственно участвуют в развитии таких заболеваний, как детский церебральный паралич, эпилепсия, минимальная мозговая дисфункция.
Факторы риска. Этиология и патогенез гипоксической энцефалопатии
Для распознавания клинических признаков перинатальной гипоксии необходимо учитывать факторы риска, предрасполагающие к ее развитию [8]:
• Пограничный возраст матери (моложе 20 и старше 35 лет)
• Преждевременная отслойка плаценты
• Предлежание плаценты
• Преэклампсия
• Преждевременные или поздние роды
• Окрашивание околоплодных вод меконием
• Брадикардия, тахикардия плода, приглушение тонов сердца плода
• Многоплодие
• Длительный безводный промежуток
• Диабет матери
• Любые заболевания матери во время беременности
• Прием матерью потенциально опасных для плода препаратов
Среди причин нарушений вентиляции легких и оксигенации крови выделяют периферическую и центральную гипоксию. В периферической гипоксии принимает участие патология дыхательных путей или альвеолярного кровотока, в центральной гипоксии основой является нарушение функции дыхательного центра.
Морфология гипоксической энцефалопатии
Клиника гипоксической энцефалопатии
Лечение острого периода
Лечение восстановительного периода
Гипорефлексия у новорожденных что
Современная классификация перинатальных поражений ЦНС основана на причинах и механизмах, приводящих к нарушениям в работе ЦНС у ребенка. Согласно этой классификации, выделяют четыре группы перинатальных поражений ЦНС:
I – гипоксические поражения ЦНС, при которых основным повреждающим фактором является недостаточность кислорода,
II – травматические поражения, в этом случае ведущим повреждающим фактором является механическое повреждение тканей центральной нервной системы (головного и спинного мозга) в родах и в первые минуты и часы жизни ребенка,
III – дисметаболические и токсикометаболические, при этом основным повреждающим фактором являются нарушения обмена веществ в организме ребенка во внутриутробном периоде,
IV – поражение ЦНС при инфекционных заболеваниях перинатального периода: основное повреждающее воздействие оказывает инфекционный агент (как правило, вирус).
Здесь нужно заметить, что часто врачи имеют дело с сочетанием нескольких факторов, поэтому данное разделение в известной степени условно.
Расскажем поподробнее о каждой из вышеуказанных групп.
I группа
Прежде всего, нужно сказать, что гипоксические поражения ЦНС встречаются наиболее часто. Причинами хронической внутриутробной гипоксии плода являются:
Причинами острой гипоксии (т.е. возникающей во время родов) являются:
Длительность и выраженность гипоксии, и, соответственно, степень поражения ЦНС определяются степенью токсикоза, обострением у матери во время беременности сопутствующих заболеваний, особенно сердечно-сосудистой системы. ЦНС плода наиболее чувствительна именно к недостаточности кислорода. При хронической внутриутробной гипоксии запускается целый ряд патологических изменений (замедление роста капилляров головного мозга, увеличение их проницаемости), которые способствуют развитию тяжелых расстройств дыхания и кровобращения в родах (это состояние называется асфиксией). Таким образом, асфиксия новорожденного при рождении в большинстве случаев является следствием гипоксии плода.
II группа
Травматический фактор играет основную роль в повреждениях спинного мозга. Как правило, здесь имеют место травмирующие плод акушерские пособия (ручные манипуляции, осуществляемые акушеркой с целью облегчения выведения головки и плечиков плода) при большой массе плода, суженном тазе, неправильном вставлении головы, тазовом предлежании, неоправданное применение приемов защиты промежности (приемы защиты промежности направлены на сдерживание быстрого продвижения головы плода по родовым путям; с одной стороны, это предохраняет промежность от чрезмерного растяжения, с другой – увеличивается время пребывания плода в родовых путях и, что, при соответствующих условиях, усугубляет гипоксию), чрезмерные повороты головы при ее выведении, тяга за голову при выведении плечевого пояса и пр.
Порой такие травмы возникают даже при проведении кесарева сечения с так называемым “косметическим” разрезом, как правило, недостаточным для щадящего выведения головы ребенка.
Кроме того, медицинские манипуляции в первые 48 часов (например, интенсивная искусственная вентиляция легких), особенно с маловесными недоношенными также могут приводить к развитию перинатальных поражений ЦНС.
III группа
К группе нарушений обмена веществ относятся такие метаболические нарушения, как алкогольный синдром плода, никотиновый синдром, наркотический абстинентный (то есть нарушения, развивающиеся вследствие отмены наркотиков) синдром, а также состояния, обусловленные действием на ЦНС вирусных и бактериальных токсинов или введенных плоду или ребенку лекарственных препаратов.
IV группа
В последние годы фактор внутриутробного инфицирования приобретает все большее значение, что объясняется более совершенными методами диагностики инфекций. В конечном итоге, механизм повреждения ЦНС во многом определяется видом возбудителя и тяжестью заболевания.
Как проявляются перинатальные поражения ЦНС?
Проявления перинатальных поражений ЦНС варьируют в зависимости от тяжести болезни.
Так, при легкой форме вначале выявляют умеренное повышение или снижение мышечного тонуса и рефлексов, симптомы нерезкого угнетения обычно через 5-7 дней сменяются возбуждением с тремором (дрожанием) рук, подбородка, двигательным беспокойством.
При средней тяжести вначале чаще отмечается угнетение (более 7 дней) в виде мышечной гипотонии, ослаблении рефлексов. Иногда отмечают судороги, нарушения чувствительности. Часто наблюдаются вегетативно-висцеральные нарушения, проявляющиеся дискинезиями желудочно-кишечного тракта в виде неустойчивого стула, срыгиваний, метеоризма, нарушением регуляции деятельности сердечно-сосудистой и дыхательной систем (увеличенной или уменьшенной частотой сердечных сокращений, приглушенностью сердечных тонов, нарушением ритма дыхания и т.д.).
При тяжелой форме преобладают выраженное и длительное угнетение ЦНС, судороги, нарушения со стороны дыхательной, сердечно-сосудистой и пищеварительной систем.
Конечно, еще в родильном доме врач-неонатолог при осмотре новорожденного должен выявить перинатальные поражения ЦНС и назначить соответствующее лечение.
*Если у Вас, уважаемые родители, появились хоть малейшие подозрения, непременно проконсультируйтесь у невролога – ведь чем раньше начато лечение или проведена его коррекция, тем больше вероятность полного восстановления нарушенных функций.
Еще раз подчеркнем, что диагноз ребенку поставит врач. В диагнозе будет отражено наличие перинатального поражения ЦНС, по возможности – группа факторов, вызвавших его развитие, и названия синдромов, к которым относятся клинические проявления поражения ЦНС, выявленные у ребенка. Например: Перинатальное поражение ЦНС гипоксического генеза: синдром мышечной дистонии, синдром вегето-висцеральных нарушений. Это значит, что основной причиной развившегося у малыша поражения центральной нервной системы являлась кислородная недостаточность (гипоксия) во время беременности, что при осмотре у ребенка выявлены неравномерный тонус мышц в руках и/или в ногах (дистония), кожа ребенка имеет неравномерную окраску вследствие несовершенства регуляции тонуса сосудов (вегето-) и у него отмечается дискинезия желудочно-кишечного тракта (задержка стула, или, наоборот, усиленная моторика кишечника, метеоризм, упорные срыгивания), нарушения ритма сердца и дыхания (висцеральные нарушения).
Фазы развития патологического процесса
Выделяют четыре фазы развития патологического процесса при поражениях нервной системы у детей в течение первого года жизни.
Первая фаза — острый период болезни, продолжительностью до 1 месяца жизни, непосредственно связанный с гипоксией и нарушением кровообращения, клинически может проявляться в виде синдрома угнетения или синдрома возбуждения ЦНС.
Вторая фаза патологического процесса распространяется на 2—3-й месяцы жизни, происходит уменьшение выраженности неврологических расстройств: улучшается общее состояние, повышается двигательная активность, происходит нормализация мышечного тонуса, рефлексов. Улучшаются электроэнцефалографические показатели. Это объясняется тем, что пострадавший мозг не утрачивает способности к восстановлению, но продолжительность второй фазы невелика и вскоре (к 3-му месяцу жизни) может наступить нарастание спастических явлений. Фаза “неоправданных надежд на полное выздоровление” завершается (она может быть названа фазой ложной нормализации).
Третья фаза — фаза спастических явлений (3—6-й месяц жизни) характеризуется преобладанием мышечной гипертонии (т.е. повышением мышечного тонуса). Ребенок запрокидывает голову, сгибает в локтях руки и приводит их к груди, ноги перекрещивает и при опоре ставит на носки, выражен тремор, нередки судорожные состояния и др. Смена клинических проявлений болезни может быть обусловлена тем, что в этом периоде идет процесс дегенерации (увеличивается число дистрофически измененных нейронов). В то же время у многих детей с гипоксическим поражением нервной системы наметившийся прогресс во второй фазе болезни закрепляется, что обнаруживается в виде снижения неврологических расстройств.
Четвертая фаза (7—9 мес. жизни) характеризуется разделением детей с перинатальными поражениями нервной системы на две группы: детей с явными психоневрологическими расстройствами вплоть до тяжелых форм детского церебрального паралича (20%) и детей с нормализацией ранее наблюдавшихся изменений со стороны нервной системы (80%). Эта фаза условно может быть названа фазой завершения болезни.
Основные этапы восстановительного лечения и диспансерного наблюдения детей с перенесенной перинатальной гипоксией
Выделяют три основных этапа:
Методы и средства восстановительного лечения
Первый этап
У многих детей, несмотря на клиническое улучшение или выздоровление, отмечаются резидуальные (остаточные) явления, сниженные функциональные резервы. Поэтому для их ликвидации важен второй этап восстановительного лечения.
Это этап проводится в отделении (центре) восстановительного лечения и способствует нормализации функций нервной системы, обменных процессов, иммунологической реактивности. В составлении индивидуальной программы восстановительного лечения принимают участие многие специалисты: педиатр, невролог, врач функциональной диагностики, физиотерапевт, специалист по лечебной физкультуре, психолог, другие специалисты (ортопед, кардиолог, окулист, сурдолог).
Существенное значение в уточнении степени нарушений функции ЦНС, зрения, слуха имеют специальные методы: реоэнцефало-, электроэнцефалография, эхоэнцефалография, аудиометрия, исследование полей зрения, глазного дна, рентгенография черепа. Назначается рациональное питание, лечебная физическая культура и массаж, бальнео-, теплолечение, психолого-педагогическая коррекция и др.
Массаж и лечебная физическая культура (ЛФК)
При синдроме нервно-мышечной возбудимости мероприятия направлены на снижение общей возбудимости и мышечного тонуса. С этой целью применяются: покачивания в позе эмбриона или на мяче, общий расслабляющий массаж, точечный массаж для расслабления гипертоничных мышц по общепринятым точкам. При парезе конечностей и их порочном положении применяется локальный массаж для выведения конечностей в правильное положение и фиксация в этом положении 2 часа (сапожок, лонгеты, «варежка» и др.).
При гипертензионном синдроме начинать занятия можно при стабилизации внутричерепного давления. Методика массажа и лечебной гимнастики зависят от наличия ведущих симптомов: возбуждения и мышечного гипертонуса или вялости и мышечной гипотонии. Во время занятия следует избегать резких движений, резких перемен позы. При этом синдроме особенно эффективны упражнения в воде.
Упражнения в воде

У большинства детей, занимавшихся в воде, положительная динамика становится заметной уже с 3-5 занятия. Возбужденные дети становятся более спокойными, у них нормализуется сон, появляется возможность снижать дозу седативных препаратов. Вялые дети, наоборот, становятся более активными. Особенно эффективными упражнения в воде являются для возбужденных детей с высоким мышечным тонусом и угнетенными рефлексами спинального автоматизма.
Подводный душ-массаж
Массаж проводится в теплой ванне. Воздействие проводится на мышцы при небольшом давлении (0,5 атм). Широкий наконечник передвигается медленно от периферии к центру на расстоянии 10-20 см от поверхности тела. При отсутствии аппарата можно проводить ручной массаж под водой.
Аппаратная физиотерапия
Различные методы физиотерапии (импульсные токи, лекарственный электрофорез, ультразвук и др.) используют на всех этапах реабилитации
Так, лекарственный электрофорез способствует улучшению крово-, лимфообращения, рассасыванию продуктов воспаления и улучшению двигательных функций. Воздействие на воротниковую зону улучшает мозговое кровообращение, стимулирует регуляторную деятельность головного мозга.
Теплолечение
Тепловые процедуры вызывают согревание тканей, расширение сосудов, усиливают крово- и лимфообращение, улучшают регенераторные процессы, снижают мышечный тонус. Рефлекторно развиваются изменения состояния сердечно-сосудистой и нервной систем, дыхания, обмена веществ. Для теплолечения, в основном, используется озокерит, песок, горячие укутывания.
Бальнеотерапия
Иглорефлексотерапия (ИРТ)
Это метод, использующий для достижения лечебного эффекта особые чувствительные точки. Применяется для стимуляции рефлексов, необходимых для нормального психомоторного развития. При воздействии на точки акупунктуры иглой или импульсным электрическим током, лазерным излучением, магнитным полем возникают сдвиги в области сегментарного рефлекторного звена, вегетативных ганглиев и центральных звеньев регуляции всего организма. Такая широкая зона действия ИРТ помогает формировать улучшение не только двигательной, но и эмоциональной сферы ребенка. Лечение ИРТ можно начинать с З-б месяцев жизни. В этом возрасте рефлекторная сфера легче поддается коррекции.
Метод «сухой иммерсии»
Музыкотерапия
При наблюдении за детьми во время сеансов прослушивания специальных музыкальных программ чаще всего отмечается ожидаемая реакция (успокоительная у возбужденных детей при прослушивании медленных композиций, умеренная активизация на фоне музыкальных произведений в быстром темпе). Влияние музыки на клинико-неврологический статус детей оценивается как нормализующее.
Положительный эффект музыкотерапии, по-видимому, вызван благоприятными изменениями в нейроэндокринной системе, которые оптимизируют течение адаптационных процессов в организме.
Такой комплексный подход к своевременной диагностике перенесенных гипоксических поражений ЦНС и восстановительному лечению обеспечивает предотвращение развития болезней нервной системы у детей. При этом большая роль в успешной профилактике принадлежит не только врачам, но и родителям.
Клинический случай синдрома Пьера Робена у новорожденного ребенка
Л.Ф.ВАХИТОВА, Л.К.ФАЗЛЕЕВА,Л.Г.БУЛГАКОВА, О.В. ВАРЛАМОВА
Казанский государственный медицинский университет
Детская республиканская клиническая больница МЗ РТ, г. Казань
Вахитова Лилия Фаукатовна
кандидат медицинских наук, ассистент кафедры госпитальной педиатрии
420012, г. Казань, ул. Бутлерова, д. 49, тел. (843) 237-30-37, e-mail: vlilija@mail.ru
Ранняя диагностика врожденных аномалий развития в настоящее время остается актуальной из-за увеличения частоты этой патологии и необходимости проведения мероприятий, направленных на профилактику возможных осложнений. В статье описан редкий случай клинически выраженного синдрома Пьера Робена тяжелой степени у новорожденного ребенка.
Ключевые слова: новорожденный, наследственные синдромы, синдром Пьера Робена.
Kazan State Medical University
Children’s Republican Clinical Hospital of the Ministry of Health of the Republic of Tatarstan, Kazan
Clinical case of Pierre Robin’s syndrome in a newborn child
Early diagnosis of congenital abnormal development currently remains relevant because of the increasing frequency of this disease and the need for measures aimed at preventing possible complications. This article describes a rare case of clinically apparent severe Pierre Robin’s syndrome in a newborn child.
Key words: newborn, hereditary syndromes, Pierre Robin’s syndrome.
Сведения о нарушении развития нижней челюсти и неба, сочетающемся с нарушением дыхания, появились в медицинской литературе еще в 20-е годы ХІХ века. В 1923 году французским стоматологом Пьером Робеном была установлена связь между гипоплазией нижней челюсти (микрогнатией), расщелиной мягкого неба (рис. 1) и обструкцией дыхательных путей, которая состоит в последовательном появлении симптомов. В дальнейшем патология была названа именем этого ученого, и в зарубежной литературе используется термин «последовательность Пьера Робена» [1, 2]. В настоящее время только в единичных работах приведены эпидемиологические данные по этому синдрому [3, 4]. Согласно результатам ретроспективного исследования, распространенность этой патологии в Дании составляет 1 случай на 14 000 живорожденных детей; по данным американского исследования — 1 случай на 2-30 тысяч. Cоотношение полов — М1: Ж1 [5, 6]. Можно предположить, что данная патология встречается в популяции довольно часто, но выявляемые признаки не рассматриваются в совокупности как проявления единого заболевания. Нарушение эмбрионального развития нижней челюсти происходит как при наличии механической компрессии внутри матки, так и при воздействии инфекции на ранних этапах беременности или нейрогенетических нарушениях. Следует отметить, что последовательность Пьера Робена может быть изолированным синдромом или проявлением генетической патологии. Как часть генетической патологии последовательность Пьера Робена описана почти при 300 синдромах. Наследование может происходить и по аутосомно-доминантному, и по аутосомно-рецессивному типу. Вероятность рождения больного в семье, уже имеющей ребенка с синдромом Пьера Робена, составляет 1-5% [7, 8]. Популяционная частота синдрома — 1 : 12000.
Первичный порок, лежащий в основе синдрома, это резкая гипоплазия нижней челюсти (микрогения). Остальные пороки обусловлены западением языка (глоссоптоз) в связи с уменьшением ротовой полости, что в свою очередь препятствует смыканию небных пластинок. Приблизительно в 25% случаев этот синдром является составной частью синдромов множественных пороков развития, наиболее часто — синдрома Стиклера, а также кампомелического синдрома, синдрома Ханхарта, трисомии 18. У 36% больных аномалад Пьера Робена сочетается с другими пороками развития, в том числе с пороками сердца, аномалиями глаз, ушных раковин, скелета. Также нередко ассоциируется с умственной отсталостью. Клинически проявляется затруднением дыхания и глотания. Изолированные случаи всегда спорадические.
В зависимости от состояния дыхания выделяют три степени тяжести:
1) легкая степень: дыхание не затруднено, незначительные трудности с кормлением, устраняемые консервативным лечением в aмбулаторных условиях;
2) средняя степень: умеренное затруднение дыхания, умеренные трудности с кормлением, требующие лечения в стационаре;
3) тяжелая степень: значительное затруднение дыхания, значительные трудности с кормлением в течение длительного времени, приводящие к необходимости использования дыхательного пособия в виде интраназального зонда в нижние дыхательные пути или трахеостомии [1, 9, 10].
Визуализация структур лица и выявление пороков их развития потенциально возможны уже с 11-12 нед. беременности.
Характерен внешний вид новорожденного — так называемое птичье лицо, что связано с недоразвитием нижней челюсти. В разные сроки, в зависимости от степени тяжести порока, появляется резкое нарушение дыхания, связанное с западением языка, возможны частые апноэ. Из-за нарушения акта глотания во время кормления ребенка может наступить удушье.
Оптимальным и жизненно важным положением малыша с синдромом Робена является положение на боку или на животе с приподнятой (или даже фиксированной в таком положении) головой. Это позволяет избежать обструкции (перекрывания) дыхательных путей смещенным назад корнем языка. Оптимально кормить ребенка в положении на боку, полувертикальном, а иногда практически в вертикальном через назогастральный зонд.
При легкой и среднетяжелой формах заболевания проводят симптоматическую терапию и профилактику возможных осложнений. При аномалии средней тяжести альтернативой хирургического лечения является временная глоссопексия (temporary tongue-lip adhesion) — это подтягивание языка вперед и фиксация его к нижней губе. При тяжелой форме, кроме этого, требуется хирургическое вмешательство, позволяющее удлинить нижнюю челюсть: компрессионно-дистракционный остеосинтез. Метод заключается в том, что на нижнюю челюсть с двух сторон устанавливаются аппараты, проводятся распилы челюсти между лапками аппаратов и фрагменты челюсти плотно прижимаются друг к другу — компрессия. С 5–6-х суток после операции фрагменты челюсти постепенно, со скоростью 1 миллиметр в сутки, разводятся аппаратами на необходимую величину. Процесс удлинения челюсти аппаратами называется дистракцией, а аппарат, соответственно, — компрессионно-дистракционным. Между фрагментами кости образуется новая молодая кость — костная мозоль. В результате дистракции нижняя челюсть перемещается кпереди вместе с языком, который перестает перекрывать верхние дыхательные пути. Самостоятельное дыхание становится возможным в среднем уже на 4–6-е сутки дистракции, которая продолжается до достижения правильного соотношения челюстей. На самостоятельное питание ребенок переводится, как правило, к моменту окончания дистракции или немного позже. Ребенок выписывается с аппаратами на время (3 месяца) превращения костной мозоли в полноценную кость. Через 3 месяца — повторная госпитализация для удаления аппаратов [11, 12].
Важным представляется, что устранение расщелины мягкого неба должно быть проведено до становления речи, поэтому операции производятся в возрасте от полугода до 1,5 года, в зависимости от степени дыхательной обструкции. Проводится операция уранопластики. Часто требуется проведение 3-4 этапов лечения. Перед операцией таким пациентам рекомендуется ношение специального обтуратора, который разделяет ротовую и носовую полость, позволяет малышу правильно дышать, питаться, разговаривать. При оперативном вмешательстве дефект неба восстанавливается при помощи пластического материала, что позволяет получить анатомически правильное строение.
Приводим собственное наблюдение ребенка с синдромом Пьера Робена.
Девочка З., поступила в отделение патологии новорожденных ДРКБ МЗ РТ из роддома на 5-й день жизни с диагнозом: «Синдром Пьера Робена. Атрезия хоан? Неонатальная желтуха. Асфиксия умеренной степени. Синдром задержки фетальной жидкости. Множественные стигмы дизэмбриогенеза. Риск ВУИ» в тяжелом состоянии за счет ДН II-III степени, интоксикации, неврологической симптоматики, микроциркуляторных нарушений.
Ребенок от VIII беременности, четвертых родов. I беременность — роды в 1991 г., здоровый ребенок. II беременность — роды в 1995 г., ребенок с синдромом Пьера Робена, умер в возрасте четырех мес. в результате автомобильной катастрофы. III беременность — роды в 1996 г., здоровый ребенок. IV-я беременность — выкидыш. V, VI, VII беременности — м/аборты. Настоящая беременность протекала: I триместр — угроза прерывания беременности; II триместр — на сроке 22 нед. выявлен порок развития по УЗИ. III триместр — кольпит на 40–41-й нед. Маме 40 лет, папе 44 года. Наследственность отягощена: у отца — микрогения. Роды IV, на сроке 40-41 нед., через естественные родовые пути, дистация плечиков. Оценка по шкале Апгар: 6-7-8 баллов. Проведена ИВЛ мешком Амбу — 3’. Масса при рождении 3550 г, рост 50 см, окр. гол 34 см, окр. гр. кл. 32 см. МУМТ на 5-й день — 9%. Состояние ребенка в роддоме тяжелое. Ребенок находился в вынужденном положении на боку, на животе. Кормление через зонд по 8 мл смесью НАН-1. Движения неактивные. Гипотония, гипорефлексия. Кожные покровы субиктеричные на розовом фоне. Носовое дыхание затруднено, дыхание шумное. Аускультативно дыхание жесткое, проводные хрипы. Тоны сердца ритмичные. Живот мягкий. Стул самостоятельный. Диурез адекватный. В роддоме проведено лечение: амписид, глюкозо-солевые растворы, аминовен для парентерального питания, фототерапия.
При поступлении в отделение патологии ДРКБ состояние оценено как тяжелое за счет интоксикации, дыхательной недостаточности II-III, неврологических расстройств, метаболических и микроциркуляторных нарушений. На осмотр реагировала беспокойством, закатывала глаза. Плач громкий. Двигательная активность снижена. Возбудимость повышена. Мышечный тонус диффузно снижен, гипорефлексия. Стигмы дизэмбриогенеза: микрогения, готическое небо, расщелина твердого неба, аномальная форма ушных раковин, короткая шея, широкая переносица, эпикант, арахнодактилия. Тургор мягких тканей удовлетворительный. Кожные покровы бледно-розовые, отмечается мраморность, периоральный, периорбитальный цианоз, акроцианоз в покое. Пупочная ранка сухая, чистая. Голова округлой формы. БР 1,5×1,7 см, на уровне костей черепа. Швы закрыты. Разведение в тазобедренных суставах полное. Носовое дыхание затруднено. Грудная клетка правильной формы. Отмечается втяжение межреберий и нижней апертуры грудной клетки. Дыхание ритмичное. Аускультативно выслушиваются обильные проводные хрипы, дыхание ослаблено по всем легочным полям. Тоны сердца ритмичные, приглушены. Выслушивается негрубый систолический шум на верхушке. Живот увеличен в объеме, мягкий, печень +2,5 см (край эластической консистенции, острый, ровный), селезенка — не пальпируется. Физиологические отправления — без патологии.
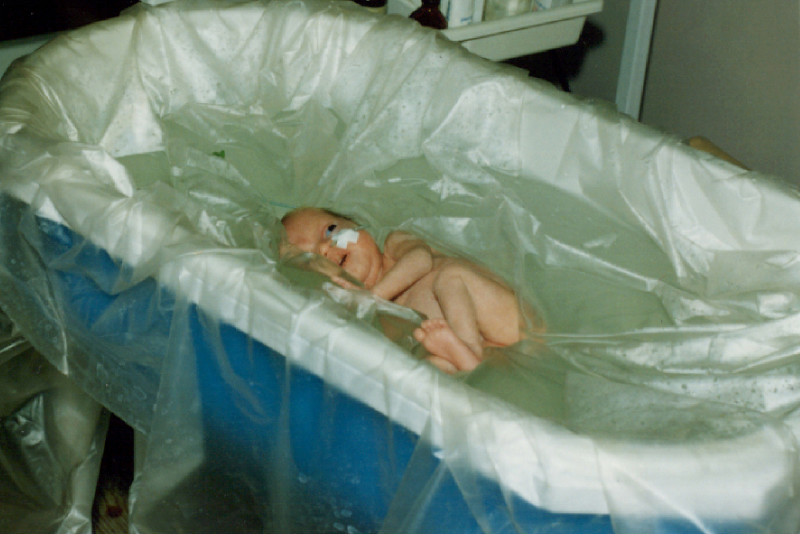
Девочка находилась в палате интенсивной терапии в положении на боку, так как резко беспокоилась в положении на животе. Получала необходимое лечение. Через 2 дня после госпитализации состояние ребенка резко ухудшилось из-за обструкции дыхательных путей, нарастания дыхательной недостаточности, микроциркуляторных нарушений. Ребенок был переведен в отделение реанимации новорожденных. Из-за невозможности интубации трахеи проведена операция «нижняя трахеотомия», вставлена трахеостомическая трубка (рис. 1).
Ребенок с синдромом Пьера Робена (собственное наблюдение)
Диагностированы аспирационная пневмония, острое течение, ДН II-III ст., церебральная ишемия средней тяжести, постгеморрагическая анемия средней тяжести. Проводилось лечение: антибактериальная, противогрибковая терапия, гемостатические, ноотропные препараты, инфузионная терапия. Далее, несмотря на проводимую деэскалационную антибактериальную терапию, состояние ребенка оставалось тяжелым за счет интоксикации, дыхательной недостаточности, респираторных нарушений. Образовался порочный круг: трахеостома поддерживает воспалительный процесс в легких и невозможность проведения остеосинтеза и удаления трахеостомы. Девочка находится под наблюдением детских хирургов. В плане после купирования воспаления проведение оперативного лечения.
1. Bronshtein M., Blazer S., Zalel Y. et al. Ultrasonographic diagnosis of glossoptosis in fetuses with Pierre Robin sequence in early and mid pregnancy // Am. J. Obstet. Gynecol. — 2005 Oct. — Vol. 193, № 4. — P. 1561-1564.
2. Bixler D., Christian J.C. Pierre Robin syndrome occurring in two unrelated sibshops. — Birth Defects, 1971. — Vol. VII, № 7. — P. 67-71.
3. Chiriac A., Dawson A., Krapp M. et al. Pierre-Robin syndrome: a case report // Arch. Gynecol. Obstet. — 2007. — Jul 6.
4. Evans A.K, Rahbar R., Rogers G.F. et al. Robin sequence: a retrospective review of 115 patients // Int. J. Pediatr. Otorhinolaryngol. — 2006 Jun. — Vol. 70, № 6. — P. 973-980.
5. Козлова С.И. Демикова Н.С. Семанова Е. Блинникова О.Е. Наследственные синдромы и медико-генетическое консультирование. — М.: Практика, 1996. — С. 122-123.
6. Наследственные синдромы и медико-генетическое консультирование: справочник / Козлова С.И., Семанова Е., Демикова Н.С., Блинникова О.Е. — Л.: Медицина, 1987. — С. 185.
7. Jakobsen L.P., Knudsen M.A., Lespinasse J. et al. The genetic basis of the Pierre Robin Sequence // Cleft Palate Craniofac J. — 2006 Mar. — Vol. 43, № 2. — P. 155-159.
8. Kirschner R.E., Low D.W., Randall P. et al. Surgical airway management in Pierre Robin sequence: is there a role for tongue-lip adhesion? // Cleft Palate Craniofac J. — 2003 Jan. — Vol. 40, № 1. — P. 13-18.
9. Printzlau A., Andersen M. Pierre Robin sequence in Denmark: a retrospective population-based epidemiological study // Cleft Palate Craniofac J. — 2004 Jan. — Vol. 41, № 1. — P. 47-52.
10. Tolarova M., Senders C. Medicine, Pierre Robin Malformation. — Last updated June 2006.
11. Wagener S., Rayatt S.S., Tatman A.J. et al. Management of infants with Pierre Robin sequence // Cleft Palate Craniofac J. — 2003 Mar. — Vol. 40, № 2. — P. 180-185.
12. Кириллова Л.Г., Ткачук Л.И., Шевченко А.А., Силаева Л.Ю., Лисица В.В., Мироняк Л.А. Синдром Пьера Робена у детей // Международный неврологический журнал. — 2010. — № 3.
1. Bronshtein M., Blazer S., Zalel Y. et al. Ultrasonographic diagnosis of glossoptosis in fetuses with Pierre Robin sequence in early and mid pregnancy // Am. J. Obstet. Gynecol. — 2005 Oct. — Vol. 193, № 4. — P. 1561-1564.
2. Bixler D., Christian J.C. Pierre Robin syndrome occurring in two unrelated sibshops. — Birth Defects, 1971. — Vol. VII, № 7. — P. 67-71.
3. Chiriac A., Dawson A., Krapp M. et al. Pierre-Robin syndrome: a case report // Arch. Gynecol. Obstet. — 2007. — Jul 6.
4. Evans A.K, Rahbar R., Rogers G.F. et al. Robin sequence: a retrospective review of 115 patients // Int. J. Pediatr. Otorhinolaryngol. — 2006 Jun. — Vol. 70, № 6. — P. 973-980.
5. Kozlova S.I. Demikova N.S. Semanova E. Blinnikova O.E. Nasledstvennye sindromy i mediko-geneticheskoe konsul’tirovanie. — M.: Praktika, 1996. — S. 122-123.
6. Nasledstvennye sindromy i mediko-geneticheskoe konsul’tirovanie: spravochnik / Kozlova S.I., Semanova E., Demikova N.S., Blinnikova O.E. — L.: Medicina, 1987. — S. 185.
7. Jakobsen L.P., Knudsen M.A., Lespinasse J. et al. The genetic basis of the Pierre Robin Sequence // Cleft Palate Craniofac J. — 2006 Mar. — Vol. 43, № 2. — P. 155-159.
8. Kirschner R.E., Low D.W., Randall P. et al. Surgical airway management in Pierre Robin sequence: is there a role for tongue-lip adhesion? // Cleft Palate Craniofac J. — 2003 Jan. — Vol. 40, № 1. — P. 13-18.
9. Printzlau A., Andersen M. Pierre Robin sequence in Denmark: a retrospective population-based epidemiological study // Cleft Palate Craniofac J. — 2004 Jan. — Vol. 41, № 1. — P. 47-52.
10. Tolarova M., Senders C. Medicine, Pierre Robin Malformation. — Last updated June 2006.

