Гипогликемия у новорожденных что это
Гипогликемия у новорожденных что это
Метаболические расстройства описаны в отдельных статьях на сайте. Здесь будут рассмотрены только специфические аспекты метаболических проблем у новорожденных детей.
а) Неонатальная гипогликемия. Вопрос об определении гипогликемии и предельных безопасных показателей уровня глюкозы у новорожденных остается дискуссионным (Cornblath et al., 2000). Общепринятым определением значимой гликемии у младенцев является уровень сахара крови менее 1,1 ммоль/л (20 мг/дл). По данным статьи Koh et al. (1988), значения на уровне 2,6 ммоль/л теперь также считаются потенциально опасными для развивающегося мозга. Показатели достаточно произвольные, так как у некоторых новорожденных могут появляться симптомы с уровнем глюкозы 1,6-2,2 ммоль/л (30-40 мг/дл), тогда как у многих течение бессимптомно даже при уровне ниже 1,1 ммоль/л.
Не менее важны и другие факторы: снижение уровня глюкозы и длительность этого состояния, сопутствующая гипоксия-ишемия.. Бессимптомная, транзиторная гипогликемия может обнаруживаться у 11% всех новорожденных детей в течение первых часов после рождения до начала перорального кормления (Fenichel, 1983), особенно у имеющих задержку внутриутробного развития или родившихся в асфиксии или от матерей, страдающих диабетом или токсемией (Cornblath и Schwartz, 1991).
Частота симптоматической гипогликемии, конечно, намного ниже.
1. Механизмы и патология. Механизмы неонатальной гипогликемии разнообразны. Случаи такого серьезного состояния как незидиобластоз редки. В большинстве случаев, особенно у новорожденных с небольшим гестационным сроком, дисбаланс между относительно большим мозгом, который потребляет глюкозу в качестве основного источника энергии, и маленькой печенью с исчерпанным резервом гликогена, вероятно, ставит под угрозу снабжение ЦНС. Отсутствие симптомов у многих детей с гипогликемией может быть связано с фактом, что в мозге новорожденного могут окисляться помимо глюкозы и иные энергетические продукты: кетоновые тела, молочная и жирные кислоты.
Мозговая дисфункция с судорогами и комой не связана со значительным падением высокоэнергетических фосфатных соединений, эта ситуация встречается и при гипоксии (Petroff et al., 1988).
Патология гипогликемии напоминает таковую при гипоксии, с которой она часто связана (Collins и Leonard, 1984). Утрата нейронов затрагивает не только головной мозг, но также клетки передних рогов спинного мозга, хотя этот процесс обычно происходит в задней части полушарий мозга (Anderson et al., 1967). Недавние исследования с применением нейровизуализации подтвердили это наблюдение (Spar et al., 1994, Barkovich et al„ 1998, Traill et al., 1998, Filan et al., 2006).
2. Клинические проявления. Неврологические проявления неонатальной гипогликемии включают в себя апноэ, дрожание, высокочастотный плач, цианоз, рвоту, судороги и кому. Наличие симптомов, очевидно, в большей степени определяется продолжительностью гипогликемии, чем ее уровнем (Koivisto et al., 1972). Может наблюдаться несколько типов. В первые несколько часов жизни у рожденных от матерей страдающих диабетом, в случаях фетального эритробластоза и у многих недоношенных детей, перенесших асфиксию в родах, часто появляется «адаптивная» гипогликемия. Большинство случаев с началом в первые 12 часов жизни остаются бессимптомными. Вторичная гипогликемия обычно встречается в поздней части первого дня жизни и наблюдается у детей с тяжелой асфиксией, родившихся в срок или раньше (Collins и Leonard, 1984).
Роль, которую играет гипогликемия в таких случаях, сложно отделить от первичного расстройства. Классический тип наблюдается в основном у новорожденных с малым сроком гестации. Симптомы присутствовали примерно в 20% таких случаев. Они появлялись во второй половине первых суток или на второй день.
Прогноз зависит от тяжести и продолжительности гипогликемии и от проводимой терапии. Повторная гипогликемия, с другой стороны, обычно связана с гиперинсулинизмом, гликогенозами, непереносимостью фруктозы или другими нарушениями углеводного обмена или его регуляцией. Врожденный гипопитуитаризм, хотя нечасто, является важной причиной, так как его диагностика важна для профилактики рецидивов и задержки умственного развития. Также имеются сообщения о наличии симптоматической гипогликемии у здоровых в остальном доношенных новорожденных на грудном вскармливании, она наблюдается и в тех случаях, когда потребление грудного молока недостаточное и дополнительный прикорм не введен (Moore и Perlman, 1999). Известно, что у детей на грудном вскармливании более низкая концентрация глюкозы в крови и выше уровень кетоновых тел на второй или третий дни жизни, чем у детей на искусственном вскармливании (Hawdon et al., 1994).
Последствия неонатальной гипогликемии являются серьезными, в одном исследовании (Koivisto et al., 1972) были выявлены познавательные или двигательные осложнения примерно у половины симптоматических пациентов, тогда как при последующем наблюдении патологические изменения нервной системы прослеживается лишь в 6% бесимптомных случаев. Pildes et al. (1974) обнаружили, что средний показатель IQ у пациентов с симптоматической гипогликемией был ниже, чем в контрольной группе. Фокальная эпилепсия может наблюдаться в качестве изолированного осложнения (Boulloche et al., 1987).
Duvanel et al. (1999) отметили неблагоприятный эффект повторяющихся эпизодов гипогликемии у новорожденных с малым сроком гестации. В недавних исследованиях выдвигается предположение, что длительные эффекты могут последовать за относительно умеренной гипогликемией. Koh et al. (1988) сообщали о замедлении скорости проведения нервов у детей с критической гипогликемией, которая сохранилась после исправления метаболического дефекта. Lucas et al. (1988) обнаружили, что у детей с продолжительной биохимической гипогликемией, имелся недостаток 3-14 пунктов шкалы развития младенцев Бейли в сравнении с нормогликемическими детьми, хотя это исследование было ретроспективным с соответствующими ограничениями.
3. Лечение. Лечение неонатальной гипогликемии представляет собой внутривенное назначение глюкозы в дозе 0,5-1,0 г/кг в виде 25% раствора со скоростью 1 мл/мин, с последующей непрерывной инфузией 8-10 мг/кг/мин. Болюсное введение допустимо только в критических случаях с обязательным увеличением потребления глюкозы после введения. Необходимо установить основную причину. У младенцев с бессимптомным течением гликемия может быть скорректирована непрерывным вливанием при уровне глюкозы крови менее 2,2 ммоль/л (40mg/L) (Hawdon et al., 1994, Mehta, 1994, Deshpande и Ward Platt, 2005).
б) Гипогликорахия без гипогликемии. Гипогликорахия без гипогликемии (De Vivo et al., 1991) — редкое состояние, суть которого заключается в активности лечения и в сложности диагностики. Расстройство связано с недостаточностью белка-носителя GLUT-1, который переносит глюкозу из крови в ЦСЖ (Seidner et al., 1998). Передается аутосомно-рецессивным путем и обычно проявляется клинически с конца первого месяца жизни. Синдром недостаточности GLUT-1 возникает в результате гаплонедостаточности переносчика гексозы гематоэнцефалического барьера. Известны истинно неонатальные случаи (Brockmann et al., 2001). Основными клиническими проявлениями являются судороги, но также наблюдались атаксия, пароксизмальные нарушения сознания и даже периодическая слабость.
Подсказкой может быть низкий уровень лактата в ликворе. Лечение кетогенной диетой предупреждает развитие неврологического дефицита и успешно проводится в течение многих лет.
в) Гипергликемия. Значительная гипергликемия встречается изредка у новорожденных с повреждением ЦНС (Cornblath и Schwartz, 1991) и имеет серьезное прогностическое значение. Идиопатическая неонатальная гипергликемия является исключением (Lewis и Mortimer, 1964).
Видео нарушение и норма толерантности к глюкозе
Редактор: Искандер Милевски. Дата публикации: 27.11.2018
Гипогликемия у новорожденных что это
Глюкоза является основным источником энергии для центральной нервной системы (ЦНС) уже с периода внутриутробного развития. Примерно 90% глюкозы, циркулирующей в крови плода, участвует в окислительных биохимических реакциях в ткани мозга. Депонирование углеводов в ЦНС отсутствует, в связи с чем важным условием нормального церебрального энергетического метаболизма является регулярный транспорт глюкозы в нервную ткань. Ферментативные системы глюконеогенеза и гликогенолиза в эмбриональном периоде неактивны, поэтому энергетическая потребность плода обеспечивается глюкозой, поступающей от матери трансплацентарно по градиенту концентрации со скоростью 4–6 мг/кг/мин (7 г/кг/сут). Гликемия плода составляет 60–80% от концентрации глюкозы в крови беременной женщины [1–3].
После рождения нормогликемия обеспечивается энтеральным потреблением углеводов (лактоза грудного молока) и собственной эндогенной продукцией глюкозы (печеночный глюконеогенез, гликогенолиз). Следует отметить, что даже у здоровых доношенных новорожденных биохимические пути синтеза глюкозы активизируются в течение первых 2–3 дней жизни и продолжают формироваться на протяжении последующих нескольких недель (физиологическая незрелость гомеостаза углеводов). По данным литературы, половина здоровых новорожденных в первые 8–12 ч после рождения не способны удерживать голодовой нормальный уровень глюкозы в плазме [4]. Использование же альтернативных источников энергии (кетоновые тела, аминокислоты, лактат, глицерин, короткоцепочечные жирные кислоты и др.) в неонатальном периоде ограничено в связи с незрелостью ферментативных систем. Кроме того, существует ряд перинатальных факторов, приводящих к пролонгированию гипогликемии. К ним относятся перинатальная асфиксия, сахарный диабет у беременной, недоношенность, задержка внутриутробного развития (ЗВУР), прием некоторых медикаментов и др. В ряде случаев персистирование гипогликемии может быть обусловлено врожденными нарушениями обмена веществ, ферментопатиями или дисфункцией эндокринных желез, так как метаболизм глюкозы осуществляется с участием различных ферментов и регулируется гормонами (инсулин, глюкагон, кортизол, адреналин и др.). Указанные обстоятельства обусловливают высокую частоту встречаемости гипогликемий у новорожденных (1–5 случаев на 1000 живорожденных, не относящихся к группам риска) [4].
Влияние низкого уровня глюкозы на развитие нервной системы детей активно дискутируется. Многочисленные исследования показывают, что гипогликемии в неонатальном периоде приводят к различным неврологическим нарушениям в постнатальной жизни (судорожный синдром, задержка психомоторного развития, сниженные показатели IQ, нарушение когнитивных функций и др.) [3, 5–8]. Это связано с повреждающим действием низкого уровня глюкозы на нейроны головного мозга.
Дефицит глюкозы в ЦНС увеличивает продукцию лактата, способствует развитию тканевого ацидоза, снижению уровня креатинфосфата и АТФ в клетках мозга. Вследствие этого возникают деполяризация мембраны нейрона и тканевые электролитные нарушения – поступление калия в экстрацеллюлярное пространство и внутриклеточное повышение уровня натрия, хлорида и кальция. Указанные изменения приводят к аккумуляции жидкости в нейронах, высвобождению свободных радикалов, активации простагландинов, тромбоксанов и лейкотриенов, развиваются отек нейронов, атрофия глиальных клеток и демиелинизация белого вещества. Спазм сосудов, обусловленный повышенным содержанием внутриклеточного кальция, усугубляет гипоксию ткани мозга, что в конечном итоге приводит к необратимому повреждению мембран клеток и селективной гибели нейронов [1, 3, 5–9].
По мнению ряда авторов, поражение ЦНС при гипогликемии и развитие нейронального некроза обусловлено нарастанием содержания нейромодулятора глутамата с последующей активацией и увеличением количества функциональных NMDA-рецепторов. Сопутствующие изменения в цикле трикарбоновых кислот приводят к нарушению окислительных процессов, нарастанию свободных радикалов, повреждению митохондриальных мембран и ДНК, снижению активности NADH-дегидрогеназы и количества АТФ. Кроме того, гипогликемия повышает чувствительность NMDA-рецепторов к действию глутамата, что в сочетании с нарушением митохондриального метаболизма приводит к активации клеточных фосфолипаз и протеаз и нарушению синаптической передачи. Конечным результатом указанных процессов являются изменение трансмембранных ионных потоков, нарушение процесса ветвления дендритов, активация апоптоза, гибель нейронов и последующее развитие метаболической (гипогликемической) энцефалопатии. Важно, что для развития незрелого мозга решающее значение имеет нормальный уровень активности рецепторов NMDA, поэтому содержание глутамата коррелирует с выраженностью метаболических изменений в ЦНС в зависимости от гестационного возраста [2, 3].
Наиболее неблагоприятные последствия наблюдаются при одновременном воздействии гипогликемии и церебральной гипоксии. Механизмы развития патологических изменений в ЦНС при указанных состояниях практически идентичны, а при сочетании их отмечается синергическое взаимодействие. Анаэробный гликолиз, возникающий при гипоксии, усугубляет дефицит глюкозы в тканях мозга и ускоряет снижение содержания АТФ. Гипогликемия нарушает защитный эффект вазодилатации мозговых кровеносных сосудов, появляющийся при гипоксии в условиях нормального гомеостаза глюкозы. Кроме того, увеличение объемной скорости мозгового кровотока (защитный механизм при гипогликемии) в сочетании с гипоксией может приводить к риску кровоизлияния [3, 5–7, 9].
Согласно данным литературы, при неонатальных гипогликемиях в первую очередь повреждаются нейроны коры, стриарной системы и гиппокампа. В последующем у таких детей нарушаются когнитивные и сенсорные функции, формируются задержка моторного развития и поведенческие дефекты [1, 3, 5–9]. У 35–50% новорожденных с клиническими гипогликемиями и 20% младенцев с асимптомными гипогликемиями в последующем имеются различные неврологические проблемы [3].
По данным S. Chandran и соавт. [1], у новорожденных через 7 дней после гипогликемии при МРТ головного мозга визуализируются гиперинтенсивные сигналы в теменно-затылочной области. Эти изменения сочетаются с повышенным содержанием лактата и свободных жирных кислот в крови и с большой долей вероятности свидетельствуют о влиянии низкого уровня глюкозы на ЦНС.
В литературе представлены результаты изучения катамнеза доношенных детей без гипоксии при рождении, у которых имела место неонатальная гипогликемия. Полученные данные указывают на высокую частоту (до 90–94%) структурных изменений головного мозга (по данным МРТ) у этих пациентов в возрасте 1,5 года (кортикальные поражения, поражения базальных ганглиев и/или таламуса, признаки кровоизлияния в белое вещество, инфаркты в бассейне средней мозговой артерии) [1–3, 5]. У недоношенных детей на втором году жизни обнаружена корреляция между длительностью гипогликемии в неонатальном периоде и последующей патологией ЦНС. Так, младенцы с персистирующей гипогликемией (свыше 5 дней) в последующем имели задержку психомоторного развития, а также более высокую частоту детского церебрального паралича, чем недоношенные с кратковременным аналогичным снижением уровня глюкозы крови или однократным эпизодом тяжелой гипогликемии.
Важно подчеркнуть, что в большинстве случаев неонатальные гипогликемии протекают бессимптомно, даже при существенном снижении уровня глюкозы крови. Вместе с тем несколько когортных исследований, выполненных в разных странах, установили высокую частоту дефицита внимания и малой мозговой дисфункции у детей, имеющих в анамнезе бессимптомные гипогликемии [1, 3, 5]. Ряд авторов указывают на причастность тяжелой неонатальной гипогликемии к развитию судорожного синдрома в раннем детском возрасте [1–3, 5].
Все это определяет актуальность проблемы неонатальных гипогликемий. Цель настоящей публикации – представить обобщенные данные по тактике ведения новорожденных детей с низким содержанием глюкозы крови.
Гипогликемия новорожденного – это снижение концентрации глюкозы в крови 
Клинические варианты гипогликемии у новорожденных
1. Бессимптомная гипогликемия (низкий уровень глюкозы в крови не проявляется клинической симптоматикой, возможны неблагоприятные отсроченные последствия).
2. Симптоматическая гипогликемия (низкий уровень глюкозы в крови сочетается с клиническими проявлениями).
NB ! Наиболее часто у новорожденных детей отмечаются бессимптомные гипогликемии.
Особенность клиники гипогликемии у новорожденных – неспецифичность симптомов (аналогичные проявления могут быть при других заболеваниях).
Дифференциально-диагностические признаки гипогликемии у новорожденного (триада Уиппла) [3, 5–7]:
– появление клинических симптомов при лабораторно низком уровне глюкозы крови;
– исчезновение этих симптомов при нормализации уровня гликемии;
– возобновление клинических симптомов при снижении уровня глюкозы крови.
Наиболее частые клинические симптомы при гипогликемии у новорожденного [3, 5, 6]:
– глазная симптоматика (круговые, плавающие движения глазных яблок, нистагм, снижение тонуса глазных мышц, исчезновение окулоцефального рефлекса);
– слабый высокочастотный пронзительный неэмоциональный крик;
– слабость, вялость, «бедность» движений;
– вялое сосание, срыгивания, анорексия;
– повышенная возбудимость, раздражительность;
– повышенный рефлекс Моро.
Менее частые симптомы при гипогликемии у новорожденного:
– периоральный, общий цианоз или акроцианоз;
– нестабильность температуры тела (склонность к гипотермии);
– тахикардия, тахипноэ, артериальная гипотензия;
– бледность кожи, повышенное потоотделение;
NB! Гипогликемия (даже бессимптомная) в периоде новорожденности без лечения может привести к необратимому повреждению головного мозга.
В зависимости от этиологии и патогенеза неонатальные гипогликемии могут быть транзиторными (преходящими) и персистирующими (стойкими).
Гипогликемия у новорожденных что это
Гипогликемия — типичная проблема у новорождённых, однако у детей после этого периода встречается намного реже. Она обычно определяется при концентрации глюкозы в плазме менее 2,6 ммоль/л, хотя развитие клинических признаков будет зависеть от того, насколько могут использоваться другие источники энергии. Клинические признаки включают:
• повышенное потоотделение;
• бледность;
• признаки раздражения ЦНС, в том числе головную боль, судороги и кому. Неврологические последствия могут быть перманентными, если гипогликемия сохраняется, и включают эпилепсию, выраженные сложности в обучении и микроцефалию. Риск максимально высок в раннем детском возрасте, в период наиболее интенсивного развития головного мозга.
У детей имеются высокие энергетические потребности и относительно небольшие резервы глюкозы вследствие глюконеогенеза и глюкогенеза. Они имеют риск гипогликемии натощак. Младенцы никогда не должны голодать более 4 ч, например, в предоперационном периоде. Необходимо проверить уровень глюкозы в крови у тех детей, которые:
• имеют признаки септицемии или выглядят серьёзно больными;
• у которых наблюдаются продолжительные судорожные припадки;
• у которых развивается нарушение сознания. Это часто производится у постели пациента с использованием полосок, чувствительных к глюкозе, точность которых увеличивается при использовании глюкометра. Однако полоски только указывают на то, что уровень глюкозы находится в пределах низкого диапазона значений и любое указание на низкое значение должно всегда проверяться лабораторным измерением.
Если причина гипогликемии не установлена, жизненно важно производить забор крови во время гипогликемии. Кроме того, первая полученная порция мочи направляется для анализа, для того чтобы не упустить ценную возможность для установления диагноза.
Исследования, которые необходимо провести при наличии гипогликемии:
• Кровь:
— Подтверждение гипогликемии лабораторным исследованием содержания глюкозы в крови.
— Определение содержания ГР, кортизола, инсулина, С-пептида, жирных кислот, ацетоацетата, 3-гид-роксибутирата, глицерина, аминокислот с разветвлёнными цепями, ацетилкарнитинового профиля, лактата, пирувата.
• Первая моча после гипогликемии:
— Определение содержания органических кислот.
— Рассмотреть возможность сохранения крови и мочи для токсикологического анализа, например, салицилатов, сульфонилурии.
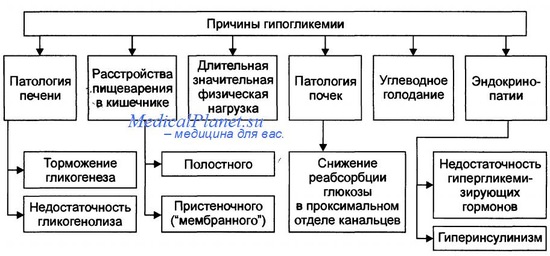
Причины гипогликемии после неонатального периода:
• Голодание
• Избыток инсулина:
— Избыточное экзогенное поступление инсулина, например, при сахарном диабете (скрытое поступление инсулина).
— Опухоли / повышение функции b-клеток — ПГГМ (ранее называемый гиперплазией островковых клеток поджелудочной железы), инсулинома.
— Индуцированный приёмом лекарственных препаратов.
— Аутоиммунный (антитела к рецепторам инсулина).
— Синдром Беквита (синдром висцеромегалии и офтальмоцеле).
• Без гиперинсулинемии:
— Заболевания печени.
— Кетотическая гипогликемия детского возраста.
— Врождённые нарушения метаболизма, например, нарушения накопления гликогена.
— Гормональный дефицит: ГР, АКТГ, болезнь Аддисона, врождённая гиперплазия надпочечников.
• Реактивная (не в результате голодания):
— Галактоземия.
— Чувствительность к лейцину.
— Непереносимость фруктозы.
— Материнский диабет.
— Гормональный дефицит.
— Отравление аспирином / алкоголем.
P.S. АКТГ — адренокортикотропный гормон. ГР — гормон роста. ПГГМ — персистирующий гипогликемический гиперинсулинизм младенцев.
Кетотическая гипогликемия — плохо определяемое понятие, при котором у маленьких детей появляется склонность к гипогликемии после короткого периода голодания, возможно, вследствие ограниченных резервов для глюконеогенеза. Ребёнок часто невысокого роста и худой, уровень инсулина у него низкий. Регулярные лёгкие закуски и напитки с дополнительной глюкозой при болезни обычно могут предотвратить гипогликемию. Это состояние проходит само собой в дальнейшей жизни.
Некоторые редкие эндокринные и метаболические нарушения могут проявляться гипогликемией практически в любом возрасте у детей. Гепатомегалия заставляет подозревать возможность врождённого нарушения накопления гликогена, при котором может быть выраженная гипогликемия.
Персистирующий гипогликемический гиперинсулинизм младенцев (ПГГМ), который ранее назывался гиперплазией островковых клеток поджелудочной железы) — редкое заболевание в младенчестве, при котором имеется мутация ионных каналов, приводящая к нарушению регуляции выброса инсулина островковыми клетками поджелудочной железы, что приводит к выраженной не-кетотической гипогликемии.
Лечение гипогликемии у детей
Гипогликемию обычно можно скорректировать внутривенной инфузией глюкозы (2-4 мл/кг 10% декстрозы). Необходимо предпринять меры по избеганию введения избыточного объёма, поскольку раствор является гипертоническим. Если происходит задержка начала инфузии или отсутствует ответная реакция, внутримышечно вводится глюкагон (0,5-1 мг).
Глюкокортикоиды могут также применяться, если есть вероятность гипопитуитаризма или гипоадренализма. Коррекция гипогликемии всегда должна быть документирована с удовлетворительными результатами лабораторного анализа глюкозы.
Гипогликемия:
• Должна быть исключена у любого ребёнка с септицемией, находящегося в тяжёлом состоянии, в продолжительном эпилептическом припадке или при нарушении уровня сознания.
• Низкий уровень глюкозы крови при тестировании возле кровати пациента (тест-полосками) должен быть подтверждён лабораторными данными.
• Если причина неизвестна, необходимо произвести забор диагностических образцов крови и мочи, если возможно, одновременно.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гипогликемия у новорожденных что это
А. Определение. Гипогликемия — это снижение концентрации глюкозы в крови до уровня 2,2 ммоль/л (в сыворотке или плазме 2,5 ммоль/л ). Гипогликемия — одна из самых частых причин смерти новорожденных и тяжелых нарушений ЦНС у детей. Это неотложное состояние, требующее своевременной диагностики и активного лечения.
1. Гипогликемия у новорожденных (проявляется сразу после рождения или в первые 3—5 дней жизни ребенка) может быть обусловлена недоношенностью, внутриутробной задержкой развития или врожденными нарушениями углеводного обмена. Непосредственные причины гипогликемии у новорожденных:
а. Дефицит веществ — источников глюкозы (например, гликогена).
б. Наследственные дефекты ферментов метаболизма углеводов (например, глюкозо-6-фосфатазы, участвующей в образовании глюкозы из гликогена).
г. Дефицит контринсулярных гормонов.
2. Гипогликемия у грудных детей и детей старшего возраста встречается реже. Возможные причины:
б. Врожденные нарушения обмена углеводов.
в. Приобретенное эндокринное заболевание (например, первичная надпочечниковая недостаточность).
г. Голодание, употребление алкоголя, введение инсулина, случайный прием пероральных сахаропонижающих лекарственных средств.
Г. Классификация гипогликемии представлена в табл. 33.1.
Д. Группы высокого риска преходящей гипогликемии:
3. Новорожденные, родившиеся от матерей, больных инсулинозависимым сахарным диабетом или перенесших диабет беременных.
4. Новорожденные с тяжелым заболеванием (гемолитическая болезнь новорожденных, болезнь гиалиновых мембран).
Е. Распространенность гипогликемии: 1,5—3 случая на 1000 новорожденных; в группах высокого риска распространенность во много раз выше. Преходящая гипогликемия отмечается у 2 из 3 недоношенных маловесных новорожденных. Основная причина — дефицит источников глюкозы (гликогена, белков и жиров) в сочетании с дефектами ферментов глюконеогенеза в печени. Гиперинсулинемии и нарушений секреции контринсулярных гормонов у недоношенных маловесных новорожденных обычно не бывает. Преходящая гипогликемия наблюдается также у 80—90% детей, родившихся от матерей, больных инсулинозависимым сахарным диабетом или перенесших диабет беременных. У 10—20% детей из групп высокого риска развивается стойкая тяжелая гипогликемия.
А. Симптомы гипогликемии у новорожденных и грудных детей: вялость, сонливость, фасцикуляции, небольшое снижение температуры тела, вялое сосание, цианоз, апноэ, судороги. Очень важно отличить гипогликемию от других заболеваний, проявляющихся такими же симптомами (сепсиса, асфиксии, кровоизлияния в желудочки мозга, врожденных пороков сердца, последствий медикаментозного лечения матери). Дифференциально-диагностические признаки гипогликемии: низкий уровень глюкозы во время появления симптомов; исчезновение симптомов при нормализации уровня глюкозы; возобновление симптомов при снижении уровня глюкозы (триада Уиппла).
Б. У детей старшего возраста гипогликемия проявляется как у взрослых. Выделяют две группы симптомов:
1. Раздражительность, беспокойство, слабость, чувство голода, потливость, тремор, тахикардия, боли в области сердца, тошнота и рвота (обусловлены усилением секреции адреналина).
2. Оглушенность, сонливость, спутанность сознания, нарушения концентрации внимания, дизартрия, афазия, головная боль, изменения личности, судороги, потеря сознания, кома (обусловлены углеводным голоданием головного мозга).
В. У новорожденных и грудных детей симптомы гипогликемии обычно выражены не так ярко, как у детей старшего возраста.
Г. Преходящая гипогликемия у новорожденных может быть бессимптомной.
III. Критерии лабораторного диагноза гипогликемии
А. Опасная гипогликемия у доношенных новорожденных: концентрация глюкозы в крови Б. Опасная гипогликемия у недоношенных и маловесных новорожденных: концентрация глюкозы в крови В. Настораживающая гипогликемия у новорожденных: у ребенка в возрасте до 5 дней концентрация глюкозы в крови Г. Опасная гипогликемия у детей старше 5 дней: концентрация глюкозы в крови IV. Преходящая гипогликемия у новорожденных
А. Ведение больных и прогноз. У новорожденных с симптомами гипогликемии и у всех новорожденных из групп высокого риска (см. гл. 33, п. I.Д) определяют содержание глюкозы в крови с помощью тест-полосок. Если уровень глюкозы оказался ниже нормы, берут кровь для лабораторного исследования. Если диагноз гипогликемии подтвержден, назначают глюкозу в/в в виде инфузии. Преходящая гипогликемия обычно возникает в первые 6—10 ч жизни. Возникновению гипогликемии способствует задержка кормления. При правильном лечении гипогликемия проходит через 2—3 дня, после чего инфузию глюкозы постепенно прекращают. Прогноз при преходящей гипогликемии благоприятный. Тяжелых неврологических последствий не бывает, но возможны минимальные нарушения интеллекта.
Б. Важнейшие правила лечения
1. Инфузию глюкозы начинают со скоростью 6—8 мг/кг/мин (максимальный объем инфузионного раствора — 80 мл/кг/сут).
2. Нельзя вводить в периферическую вену растворы глюкозы с концентрацией > 12,5%.
3. Кормление во время инфузии стараются не прерывать.
4. Резкое прекращение инфузии может вызвать гипогликемию, поэтому дозу глюкозы уменьшают постепенно.
В. Предупреждение гипергликемии у беременных, страдающих диабетом, снижает риск гипогликемии у новорожденных. Кроме того, уменьшается риск макросомии, дыхательных нарушений, эритроцитоза, синдрома Жильбера (гипербилирубинемии новорожденных), гипокальциемии, врожденных пороков развития.
V. Стойкая гипогликемия у новорожденных
2) После введения глюкагона концентрация глюкозы в плазме возрастает более чем на 2,2 ммоль/л.
3) Содержание кетоновых тел (ацетона, бета-оксимасляной кислоты и ацетоуксусной кислоты) в моче низкое, или они отсутствуют.
4) Уровень свободных жирных кислот в крови низкий.
б. Диагноз подтверждается, если на фоне гипогликемии (при концентрации глюкозы в крови 72 пмоль/л. Обычно уровень инсулина превышает 144 пмоль/л.
2. Этиология. Наиболее частые причины гиперинсулинемии у новорожденных — гиперплазия бета-клеток поджелудочной железы, инсулинома или незидиобластоз. У некоторых детей одновременно наблюдаются все три типа дисплазии бета-клеток. Тип дисплазии может быть установлен только гистологическим исследованием ткани поджелудочной железы (биопсия во время панкреатэктомии или аутопсия).
Гиперинсулинемия и гипогликемия отмечаются примерно у 50% детей с синдромом Беквита—Видемана (макросомия, макроглоссия, грыжа пупочного канатика, спланхномегалия, увеличение почек, поджелудочной и половых желез, расщепленная мочка уха, макроцефалия, гемигипертрофия, сосудистый невус на лице). Больные с синдромом Беквита—Видемана предрасположены к нефробластоме, раку надпочечников, гепатобластоме и ретинобластоме.
3. Лечение. Если диагноз гиперинсулинемии установлен и гипогликемия сохраняется, несмотря на в/в введение глюкозы со скоростью более 10 мг/кг/мин на фоне лечения глюкокортикоидами и диазоксидом (см. табл. 33.4), необходима субтотальная панкреатэктомия (удаление 80—95% ткани поджелудочной железы) без спленэктомии. Если причина гиперинсулинемии не устранена, у больных развиваются тяжелые неврологические нарушения. Есть сообщения о применении октреотида (аналог соматостатина, подавляющий секрецию инсулина) при гипогликемии у новорожденных и грудных детей, вызванной гиперинсулинемией. К сожалению, лечение октреотидом в этих случаях малоэффективно.
В. Дефицит контринсулярных гормонов
в. Лечение. Заместительная терапия глюкокортикоидами и соматропином дает прекрасные результаты. Такое лечение может потребоваться для предотвращения гипогликемии на протяжении первого года жизни ребенка. Заместительную терапию гидрокортизоном (0,75 мг/кг/сут внутрь в 2 или 3 приема) проводят пожизненно.
Г. Врожденные нарушения обмена углеводов. Гипогликемия может наблюдаться у новорожденных с гликогенозами, галактоземией и болезнью кленового сиропа.
1. Гликогеноз типа I наиболее распространен и в большей части случаев бывает обусловлен дефектом глюкозо-6-фосфатазы — фермента эндоплазматического ретикулума гепатоцитов (см. также гл. 37). Реже причиной гликогеноза типа I служит дефект глюкозо-6-фосфат-транслоказы — белка, переносящего глюкозо-6-фосфат из цитоплазмы в просвет эндоплазматического ретикулума. Из-за недостаточности глюкозо-6-фосфатазы или глюкозо-6-фосфат-транслоказы нарушается превращение глюкозо-6-фосфата в глюкозу на конечных стадиях гликогенолиза и глюконеогенеза. Главные проявления гликогеноза типа I: гипогликемия, метаболический ацидоз (лактацидоз), гепатомегалия. Биохимические признаки: резкое повышение уровней лактата, холестерина, триглицеридов, свободных жирных кислот и мочевой кислоты в крови; уровень глюкозы после введения глюкагона (см. гл. 33, п. V.А) не увеличивается или увеличивается незначительно; могут наблюдаться кетонемия и кетонурия. Гликогеноз типа I обычно проявляется не сразу после рождения, а на протяжении первого года жизни. Однако у новорожденных с этим заболеванием в первые часы или дни жизни может возникнуть тяжелая гипогликемия, особенно при задержке кормления.
VI. Гипогликемия у грудных детей и детей старшего возраста
А. Распространенность. Гипогликемия у детей этих возрастных групп встречается гораздо реже, чем у новорожденных.
1. Наиболее вероятные причины гипергликемии у грудных детей — это легкие формы гиперинсулинемии, врожденного дефицита контринсулярных гормонов или врожденных нарушений обмена веществ. Гипогликемия, обусловленная этими нарушениями, проявляется обычно в возрасте 3—6 мес, когда ночной сон становится более продолжительным (интервалы между кормлениями удлиняются, и ночной период голодания ребенка достигает 8 ч).
2. У детей старше года гипогликемия чаще обусловлена неспособностью поддерживать нормогликемию при голодании или приобретенным дефицитом контринсулярных гормонов.
3. Чем дольше продолжается грудное вскармливание, тем позже проявляется гипогликемия.
В. Клиническая картина (см. также гл. 33, п. II). Тяжелая гипогликемия проявляется судорогами, потерей сознания или комой. При легкой или среднетяжелой гипогликемии неврологические симптомы менее выражены (раздражительность, вялость, сонливость, нарушение координации движений). Для диагностики важно оценить регулярность появления симптомов гипогликемии и их связь с длительностью интервалов между кормлениями.
Г. Принципы диагностики. Определение глюкозы, инсулина и контринсулярных гормонов в крови, взятой в момент появления симптомов, может подтвердить диагноз и установить причину гипогликемии. При появлении судорог у грудного ребенка прежде всего надо исключить гипогликемию. Если кровь в момент припадка взять не удалось, проводят пробу с голоданием и введением глюкагона под постоянным наблюдением врача. Кормление прерывают на 10—20 ч; если возникают судороги, их устраняют в/в или в/м введением глюкагона. Перед введением глюкагона и через 30 мин после введения берут кровь для определения метаболитов и гормонов (см. табл. 33.3).
Д. Дифференциальная диагностика и лечение разных видов гипогликемии
1. Гиперинсулинемия. Это самая распространенная причина гипогликемии в первые 6 мес жизни.
1) Чаще всего гиперинсулинемия обусловлена избыточной секрецией инсулина, вызванной гиперплазией бета-клеток, инсулиномой или незидиобластозом. Продолжительное голодание провоцирует гипогликемию у детей с этими заболеваниями.
2) Непереносимость лейцина. Избыточная секреция инсулина может быть вызвана аминокислотами, содержащимися в молоке, прежде всего — лейцином. У детей с непереносимостью лейцина гипогликемия возникает после кормления молоком или пищей, богатой лейцином. Секреция инсулина в ответ на лейцин обычно усилена и у детей с гиперплазией бета-клеток, инсулиномой или незидиобластозом.
3) Введение инсулина, прием пероральных сахаропонижающих средств и некоторых других препаратов может вызвать гиперинсулинемию у ребенка, не страдающего сахарным диабетом (см. гл. 33, п. VIII).
б. Лабораторная диагностика. В крови, взятой в момент появления симптомов гипогликемии, обнаруживают низкое содержание глюкозы, свободных жирных кислот и кетоновых тел. Концентрация инсулина превышает 72 пмоль/л при концентрации глюкозы менее 2,2 ммоль/л. Содержание СТГ и кортизола нормальное, метаболического ацидоза, лактацидоза и кетоацидоза нет. Введение глюкагона значительно повышает концентрацию глюкозы в плазме (см. гл. 33, п. V.А и п. VI.Г). Для дифференциальной диагностики лекарственной гипогликемии, вызванной введением инсулина, определяют концентрацию инсулина и C-пептида в одной и той же пробе сыворотки: концентрация инсулина может быть очень высокой (> 720 пмоль/л), а концентрация C-пептида непропорционально низкая (в норме инсулин и C-пептид секретируются бета-клетками в эквимолярных количествах). При гиперинсулинемии, вызванной иными причинами, концентрация C-пептида возрастает пропорционально концентрации инсулина.
2. Дефицит СТГ или кортизола редко бывает причиной гипогликемии у детей старше 1 мес. Гипогликемия, обусловленная дефицитом этих гормонов, проявляется только после продолжительного голодания. Диагноз основан на результатах анализа крови, взятой во время приступа гипогликемии; прирост концентрации глюкозы после введения глюкагона снижен или в пределах нормы. Во время голодания концентрация глюкозы снижается, а концентрация свободных жирных кислот и кетоновых тел возрастает, как при гипогликемии голодания. Клинические признаки гипопитуитаризма или повреждения гипофиза у детей старшего возраста: низкорослость, замедленный рост, симптомы внутричерепного объемного образования (например, повышение ВЧД ). Признаки первичной надпочечниковой недостаточности: гиперпигментация, повышенная потребность в соли, гипонатриемия и гиперкалиемия.
3. Гипогликемия голодания. Это самая распространенная форма гипогликемии у детей в возрасте от 6 мес до 6 лет.
а. Этиология. Причина гипогликемии голодания — неспособность поддерживать нормогликемию при голодании. Патогенез гипогликемии голодания не выяснен (за исключением гипогликемии после продолжительного голодания у больных с дефицитом контринсулярных гормонов — СТГ и кортизола). Гипогликемия голодания нередко возникает при недостаточном питании у больных с тяжелыми инфекциями или желудочно-кишечными нарушениями, особенно после долгого сна. Иногда в таких случаях гипогликемия проявляется судорогами или потерей сознания.
б. Лабораторная диагностика. В крови, взятой во время приступа гипогликемии, концентрации глюкозы и инсулина низкие, а концентрация кетоновых тел — высокая. Возможна кетонурия. Прирост концентрации глюкозы после введения глюкагона ниже нормы. Голодание в течение 14—24 ч провоцирует гипогликемию. Чтобы исключить дефицит контринсулярных гормонов, определяют содержание СТГ и кортизола.
в. Лечение. Если обнаружен дефицит СТГ или кортизола, проводят заместительную гормональную терапию. Если дефицита контринсулярных гормонов нет, назначают диету, богатую белком и углеводами; питание должно быть дробным (6—8 раз в сутки). При сопутствующих тяжелых заболеваниях рекомендуются напитки, содержащие большое количество глюкозы. Регулярно определяют концентрацию кетоновых тел в моче. Если на фоне диетотерапии появляется кетонурия, проводят инфузию глюкозы со скоростью 6—8 мг/кг/мин, чтобы предупредить тяжелую гипогликемию. Диетотерапия эффективна у большинства больных; в возрасте 7—8 лет приступы гипогликемии прекращаются.
4. Дефицит карнитина и нарушения обмена свободных жирных кислот
а. Общие сведения. Карнитин необходим для транспорта свободных жирных кислот из цитозоля в митохондрии, где происходит их окисление и образование кетоновых тел. В цитозоле свободные жирные кислоты присоединяются к коферменту A и в таком виде транспортируются через наружную мембрану митохондрий. На внешней поверхности внутренней мембраны митохондрий жирные кислоты отщепляются от кофермента A, присоединяются к карнитину и проникают внутрь митохондрий. На внутренней поверхности внутренней мембраны жирные кислоты отщепляются от карнитина и поступают в митохондриальный матрикс. Реакции присоединения и отщепления жирных кислот катализируются карнитинпальмитоилтрансферазами I и II. В митохондриальном матриксе жирные кислоты подвергаются бета-окислению. В результате образуется ацетил-кофермент A, который включается в цикл Кребса. В гепатоцитах часть кофермента A расходуется на образование кетоновых тел. При дефиците карнитина, дефектах карнитинпальмитоилтрансферазы или ферментов, катализирующих реакции бета-окисления, свободные жирные кислоты не могут быть использованы в качестве источника энергии. Поэтому потребление глюкозы тканями резко усиливается, что приводит к гипогликемии. Кроме того, недостаточное образование кетоновых тел усугубляет гипогликемию. У больных с дефицитом карнитина или с нарушениями обмена свободных жирных кислот голодание или недостаточное потребление углеводов провоцирует гипогликемию.
1) Первичный дефицит карнитина наследуется аутосомно-рецессивно и обусловлен дефектами ферментов синтеза карнитина. Первичный дефицит карнитина — редкая причина гипогликемии. Различают две формы первичного дефицита карнитина — генерализованную и миопатическую.
а) Генерализованная форма характеризуется низким содержанием карнитина в крови, мышцах, печени, сердце и других тканях и органах. Заболевание проявляется у грудных детей и у детей младшего возраста. Клиническая картина: тошнота, рвота, гипераммониемия, печеночная энцефалопатия, нарастающая слабость, кома. Прогноз неблагоприятный. Лечение левокарнитином и глюкокортикоидами эффективно не у всех больных.
б) Миопатическая форма характеризуется низким содержанием карнитина в мышцах и нормальным содержанием карнитина в крови и других тканях и органах. Клиническая картина: нарастающая мышечная слабость, тяжелая кардиомиопатия. Миопатическую форму первичного дефицита карнитина можно спутать с полимиозитом или миодистрофией. Показано лечение левокарнитином и глюкокортикоидами.
2) Вторичный дефицит карнитина может быть вызван заболеваниями печени (нарушение синтеза карнитина), почек (повышенная экскреция карнитина), недостаточным поступлением карнитина с пищей. Клиническая картина как при генерализованной форме первичного дефицита карнитина. Лечение левокарнитином не всегда эффективно.
4) Ямайская рвотная болезнь вызвана употреблением в пищу незрелых плодов тропического кустарника Blighia sapida. Содержащийся в таких плодах токсин гипоглицин A блокирует митохондриальное окисление короткоцепочечных жирных кислот и вызывает накопление масляной, изовалериановой и пропионовой кислот в крови. В результате возникают тяжелая гипогликемия и метаболический ацидоз. Другие клинические проявления: рвота, вялость, сонливость, оглушенность, судороги, кома; нередко заболевание заканчивается смертью.
5. Врожденные нарушения обмена углеводов
а. Гликогенозы (см. также гл. 37)
1) Гликогеноз типа I (недостаточность фермента глюкозо-6-фосфатазы или транспортного белка глюкозо-6-фосфат-транслоказы) может проявиться тяжелой гипогликемией уже в первые часы или дни жизни новорожденного, но чаще наблюдается у грудных детей и детей старшего возраста. Клиническая картина: низкорослость, выступающий живот, гепатомегалия, эруптивные ксантомы, кровоточивость. Биохимические признаки: гипогликемия, стойкий метаболический ацидоз (лактацидоз), гиперлипопротеидемия. Уровни свободных жирных кислот, триглицеридов, лактата, пирувата и мочевой кислоты повышены, уровень инсулина снижен. Кровоточивость обусловлена нарушением функции тромбоцитов (но количество тромбоцитов нормальное). После введения глюкагона повышается концентрация лактата, но не глюкозы. Для подтверждения диагноза необходима биопсия печени с гистохимическим исследованием и определением активности ферментов in vitro. Основной способ лечения — интенсивная диетотерапия. Цель лечения: обеспечить постоянное поступление глюкозы. В ночные часы через назогастральный зонд или гастростому в желудок непрерывно вводят глюкозу или полимеры глюкозы (4—6 мг/кг/мин) либо сырой кукурузный крахмал (в количестве, обеспечивающем 1/3 суточной калорийности). Днем ребенку дают богатую углеводами пищу; питание должно быть дробным. Такое лечение быстро нормализует концентрацию глюкозы и другие лабораторные показатели, скорость роста и размеры печени. Однако у некоторых больных после курса диетотерапии приступы гипогликемии рецидивируют. Поэтому во время и после лечения больные нуждаются в постоянном наблюдении. У нелеченных детей с гликогенозом типа I частота приступов гипогликемии и их тяжесть постепенно уменьшаются с возрастом.
2) При гликогенозе типа III (недостаточность амило-1,6-глюкозидазы) и гликогенозе типа VI (недостаточность фосфорилазы в печени) симптомы гипогликемии при голодании и гепатомегалия выражены значительно слабее. Ацидоз нехарактерен. В обоих случаях для установления диагноза необходимы биопсия печени и определение активности ферментов in vitro. Эффективно частое кормление пищей, богатой углеводами; иногда при гликогенозе типа III требуется постоянное ночное зондовое кормление.
б. Недостаточность гликогенсинтетазы — очень редкое наследственное заболевание. У таких больных вообще не синтезируется гликоген и голодание вызывает тяжелую гипогликемию.
1) Недостаточность фруктозодифосфатазы проявляется тяжелой гипогликемией при продолжительном голодании или при сопутствующем инфекционном заболевании. Характерны гепатомегалия и стойкий лактацидоз, усиливающийся при голодании. Гипогликемию устраняют в/в инфузией глюкозы и бикарбоната. Фруктозу применять нельзя, поскольку фруктоза (так же как и аланин, глицерин и молочная кислота) подавляют синтез глюкозы и усугубляют гипогликемию. Диагноз основан на определении активности фермента в биоптатах печени или в лейкоцитах.
2) При непереносимости фруктозы (недостаточности фруктозодифосфатальдолазы) гипогликемия возникает только после приема фруктозы. Характерна выраженная гепатомегалия. Тяжелая гипогликемия может сопровождаться неукротимой рвотой. При умеренной гипогликемии наблюдаются вялое сосание и задержка роста. Назначают диету, не содержащую фруктозу. Детям старшего возраста запрещают есть сладости и другую пищу, содержащую фруктозу.
3) Недостаточность фосфоенолпируваткарбоксикиназы, ключевого фермента глюконеогенеза, — очень редкая причина гипогликемии. Фосфоенолпируваткарбоксикиназа участвует в синтезе глюкозы из лактата, метаболитов цикла Кребса, аминокислот и жирных кислот. Поэтому при недостаточности этого фермента инфузия лактата или аланина не позволяет добиться нормогликемии. Напротив, введение глицерина нормализует концентрацию глюкозы, поскольку для синтеза глюкозы из глицерина фосфоенолпируваткарбоксикиназа не требуется. При тяжелой гипогликемии проводят инфузию глюкозы.
А. Общие сведения. Прием алкоголя — распространенная причина тяжелой гипогликемии у грудных детей и детей старшего возраста. Ребенок может незаметно от взрослых выпить алкогольный напиток во время вечеринки. В этом случае гипогликемия обычно возникает на следующее утро. Иногда родители сами дают ребенку пиво или вино.
Б. Патогенез. Превращение этанола в ацетальдегид катализируется алкогольдегидрогеназой. Кофактором этого фермента служит НАД — вещество, необходимое для глюконеогенеза. Прием этанола приводит к быстрому расходованию НАД и резкому торможению глюконеогенеза в печени. Этанол вызывает гипогликемию только после 6—8-часового голодания (когда запас гликогена в печени иссякает).
В. Лечение. При легкой или умеренной гипогликемии ребенку дают питье и пищу, богатые глюкозой. Тяжелую гипогликемию устраняют в/в инфузией глюкозы. После единичного приступа гипогликемии, если установлен факт употребления алкоголя, обследовать ребенка не требуется.
VIII. Лекарственная гипогликемия. Гипогликемия у детей может быть вызвана введением инсулина, приемом пероральных сахаропонижающих средств или больших доз салицилатов. Вальпроевая кислота и ее производные ингибируют окисление жирных кислот, что приводит к нарушению глюконеогенеза и вторичному дефициту карнитина. Передозировка вальпроевой кислоты и ее производных может проявляться гипогликемией без кетонемии и кетонурии, особенно после голодания.
Введение инсулина — это одна из форм жестокого обращения с детьми. Бывает и так, что родители вводят инсулин ребенку, заподозрив у него инсулинозависимый сахарный диабет. Гипогликемия, вызванная инсулином и пероральными сахаропонижающими средствами, нередко сопровождается судорогами и потерей сознания и может быть спутана с другими видами гипогликемии.
1. Aynsley-Green A, et al. Nesidioblastosis of the pancreas: Definition of the syndrome and the management of the severe neonatal hyperinsulinemic hypoglycemia. Arch Dis Child 56:496, 1981.
2. Burchell A, et al. Hepatic microsomal glucose-6-phosphatase system and sudden infant death syndrome. Lancet 2:291, 1989.
3. Carnitine deficiency. Lancet 335:631, 1990. Editorial.
4. Haymond MW. Hypoglycemia in infants and children. Endocrinol Metab Clin North Am 18:211, 1989.
5. Hug G. Glycogen storage disease. In VC Kelley (ed), Practice of Pediatrics. New York: Harper & Row, 1985.
6. Shapira Y, Gutman A. Muscle carnitine deficiency in patients using valproic acid. J Pediatr 118:646, 1991.
7. Sperling MA. Hypoglycemia in the newborn infant and child. In F Lifshitz (ed), Pediatric Endocrinology: A Clinical Guide. New York: Dekker, 1990. Pp. 803.
8. Sperling MA. Hypoglycemia. In R Behrman (ed), Nelson Textbook of Pediatrics (14th ed). Philadelphia: Saunders, 1992. Pp. 409.
9. Sudden infant death and inherited disorders of fat oxidation. Lancet 2:1073, 1986. Editorial.
10. Treem WR, et al. Hypoglycemia, hypotonia, and cardiomyopathy: The evolving clinical picture of long-chain acyl-Co-A dehydrogenase deficiency. Pediatrics 87:328, 1991.
11. Volpe JJ. Hypoglycemia and brain injury. In JJ Volpe (ed), Neurology of the newborn. Philadelphia: Saunders, 1987. Pp. 364.
12. Wolfsdorf JI, et al. Glucose therapy for glycogenosis type I in infants: Comparison of intermittent uncooked cornstarch and continuous overnight glucose feedings. J Pediatr 117:384, 1990.