Гиперкинез миокарда левого желудочка что это такое
Гиперкинез миокарда левого желудочка что это такое
а) Региональная сократимость. Так как в различных слоях миокарда волокна ориентированы по-разному, то движение стенки, видимое при ЭхоКГ, является суммой различно ориентированных сокращений в миокарде. При этом внутренняя (субэндокардиальная) половина стенки утолщается значительно сильнее, чем внешняя, субэпикардиальная. В итоге нормальные сегменты стенки желудочка выполняют в систолу движение, направленное внутрь желудочка, а сама стенка утолщается. При этом утолщение стенки является более надежным параметром, который можно использовать и, например, в случае асинхронного сокращения при блокаде ножки пучка Риса.
Утолщение стенки и направленное внутрь движение наименее выражены в области базальных сегментов. Особое место занимает базальная часть базального переднеперегородочного сегмента, которая во время систолы не совершает направленного внутрь движения или даже немного смещается наружу (прежде всего, это хорошо видно на парастернальном базальном сечении по короткой оси), что, предположительно, обусловлено «пульсовой волной» ударного объема в области выносящего тракта левого желудочка.
1. Качественная оценка. В первую очередь происходит качественная оценка региональной сократимости:
— нормокинезия: нормальное движение и утолщение стенки,
— гипокинезия: сниженное, но определяемое движение и утолщение стенки (это наиболее субъективно вариабельная категория),
— акинезия: отсутствие движения и утолщения стенки,
— дискинезия: систолическое движение стенки наружу,
— аневризма: выпячивание левого желудочка, отмечающееся и во время диастолы, с аномально тонким, не сокращающимся миокардом,
— гиперкинезия: движение и утолщение стенки превышают нормальные показатели, что встречается при клапанной регургитации, в качестве компенсации нарушения локальной сократимости в другой зоне (например, после инфаркта), во время нагрузки или при стимуляции катехоламинами. При этом в конце систолы почти вся полость может быть замещена сокращающимся миокардом (систолическая облитерация полости желудочка). Сама по себе гиперкинезия не имеет патологического значения, однако является указанием на одно из вышеназванных состояний.

2. Количественный анализ. Многочисленные попытки количественного анализа локальной сократимости, в особенности автоматизации оценки, до сих пор не привели к созданию надежной методики, хотя бы приблизительно равнозначной визуальному заключению опытного исследователя. Поэтому сохраняется проблема субъективной вариабельности оценки локальной сократимости, которая лишь в ограниченной мере решается улучшением качества изображения, параллельным просмотром различных видеофрагментов, введением контрастных средств для левых отделов сердца и другими усовершенствованиями.
Недавно опубликованный систематический обзор различных методических подходов показал степень соответствия между различными визуализирующими методиками и определяемой при помощи согласованного клинического мнения «истиной» (степень соответствия выражалась в виде доверительного интервала значений каппы Кохена). Значение каппы, равное 1, означает полное соответствие бинарного события (нарушение локальной сократимости присутствует/отсутствует). Доверительные интервалы каппы с точки зрения выявления нарушений локальной сократимости составили:
— 0,5-0,7 для нативной ЭхоКГ,
— 0,6-0,8 для ЭхоКГ с контрастированием левых отделов,
— 0,5-0,8 для МРТ.
В рамках каждой из методик вариабельность между двумя исследователями составила:
— 0,3-0,5 для ЭхоКГ,
— 0,7-0,9 для ЭхоКГ с контрастированием левых отделов и
— 0,3-0,6 для МРТ.
Особенное значение эта проблема имеет в стресс-ЭхоКГ и при диагностике жизнеспособного миокарда в зонах с нарушенной сократимостью (см. соответствующие главы).
3. Анализ региональной деформации. В настоящее время наиболее перспективным подходом к количественной оценке локальной сократимости является анализ региональной деформации (strain/strain rate) при помощи тканевой допплерографии. Здесь можно локально и количественно оценить степень выраженности и временную динамику систолической и диастолической деформации (например, продольное укорочение и удлинение на апикальных сечениях). Но до сих пор получаемые данные чувствительны к артефактам, обременены шумовым сигналом, и их часто бывает трудно интерпретировать. Методика двумерного отображения деформации (20-strain), находящаяся ныне в начальной стадии апробации, должна существенно улучшить данный методический подход.
б) Причины нарушения сократимости:
1. Коронарная болезнь сердца. Чаще всего локальные нарушения сократимости развиваются на фоне коронарной болезни сердца:
— После инфаркта развивается необратимое, сохраняющееся в покое нарушение локальной сократимости. При этом большой постинфарктный рубец проявляется в виде акинезии или аневризмы, а после мелких инфарктов остается лишь гипокинезия или существенное нарушение локальной сократимости не определяется. Большие постинфарктные рубцы характеризуются уменьшением толщины стенки примерно на 30% и иногда несколько более высокой эхогенностью, чем окружающий миокард, что объясняется более высоким содержанием коллагена в рубце.
Надежное соотнесение нарушения локальной сократимости с гистологической зоной инфаркта осложняется связностью всех сегментов миокарда: как соседние, нормально сокращающиеся области миокарда могут «увлекать» акинетическую зону инфаркта, так и, наоборот, нарушения локальной сократимости в инфарктной зоне могут снижать амплитуду сокращений соседних здоровых сегментов («теттеринг-эффект»),
— В случае острой ишемии в покое или на фоне нагрузки (обратимые нарушения сократимости, диагностическое использование в стресс-ЭхоКГ).
— В покое в связи с оглушенным (станнинг) или гибернирующим миокардом, т.е. отсутствием (или снижением) сократимости в еще жизнеспособном миокарде.
2. Другие заболевания. Кроме КБС, нарушения локальной сократимости могут развиваться при следующих заболеваниях:
— ДКМП: хотя поражение часто имеет диффузный характер, но нередко обнаруживаются зоны гипокинезии различной степени выраженности. Однако аневризмы при этом заболевании не встречаются.
— Миокардиты: здесь изредка встречаются и более выраженные нарушения локальной сократимости, например, апикальная аневризма при болезни Чагаса (Trypanosoma cruzii).
— Нарушения локальной сократимости, поражающие только межжелудочковую перегородку, без вовлечения остальной перфузионной территории ПМЖВ, т.е. передней стенки: они встречаются относительно часто. С одной стороны, возможно развитие аномального временного паттерна сократимости с сохраненным утолщением перегородки в результате локального замедления механической систолы (например, при блокаде левой ножки пучка Гиса, правожелудочковом кардиостимуляторе, синдроме WPW, после кардиохирургического вмешательства), а также в результате взаимодействия левого и правого желудочков или наложения движения всего сердца в грудной клетке на процессы сокращения, например, после операции на сердце, при повышении нагрузки давлением или объемом на правый желудочек или в случае значительного перикардиального выпота.
Если в начале систолы происходит движение перегородки, направленное наружу, то такая ситуация обозначается термином «парадоксальная перегородка», что, будучи неспецифическим изменением, может встречаться при всех вышеназванных клинических ситуациях. С другой стороны, может развиваться истинное снижение амплитуды сокращений, как, например, при КБС (закупорка септальной ветви) или кардиомиопатии.
Редактор: Искандер Милевски. Дата публикации: 26.12.2019
Невролог «СМ-Клиника» рассказала о течении гиперкинеза у взрослых
Возможно, вы слышали выражение «Пляска святого Витта» — в исторических источниках так называли специфические проблемы нервной системы. Сегодня их называют гиперкинезами. Что это за болезнь и как ее лечить?
АЛЕНА ПАРЕЦКАЯ
Врач-патофизиолог,
иммунолог, член
Санкт-Петербургского
общества патофизиологов
ВАЛЕНТИНА КУЗЬМИНА
К.м.н., врач-невролог «СМ-Клиника»
До середины прошлого века считалось, что гиперкинезы – это вариант невроза. Но исследования в неврологии помогли определить, что это одно из проявлений серьезных нервных болезней.
Что нужно знать о гиперкинезе
Что такое гиперкинез
Причины гиперкинеза у взрослых
Гиперкинезы – это не заболевание, а синдром (набор определенных симптомов, проявлений). Они являются признаками повреждения нервной системы из-за:
Первичные – это наследственные повреждения нервной системы: болезнь Вильсона, хорея Гентингтона, оливопонтоцеребеллярные дегенерации.
Вторичные – они возникают из-за различных проблем, поражений нервной системы, полученных в течение жизни (черепно-мозговые травмы, энцефалиты, отравление угарным газом, последствия алкоголизма, тиреотоксикоза, ревматизма, опухоли и т.д.).
Психогенные – это гиперкинезы, которые возникают в результате острых психотравм, хронических поражений – истерических неврозов, психозов, тревожных расстройств. Эти формы бывают очень редко, но не исключены.
Проявления гиперкинеза у взрослых
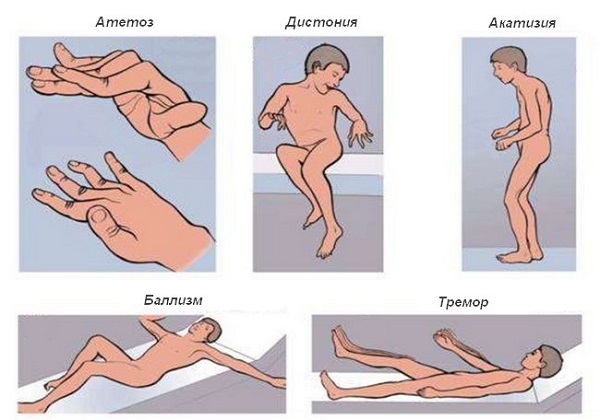
Ключевые проявления патологии – это двигательные акты, которые возникают помимо воли самого человека. Их описывают как непреодолимое желание двигаться именно таким, необычным образом. Кроме того, возникают дополнительные симптомы, которые типичны для основного заболевания. Самые частые варианты проявлений:
Тремор или дрожание – попеременные сокращения мышц сгибателей-разгибателей, имеющие как высокую, так и низкую амплитуду. Они могут быть в разных частях тела, пропадая при движении или в покое (либо, наоборот, усиливаясь).
Нервный тик – резкие, отрывистые сокращения мышц, имеющие низкую амплитуду. Тики обычно локализуются в одной группе мышц, их можно частично подавлять волевым усилием. Бывают моргание, подергивание уголка глаза, мигание, повороты головы, сокращение уголка рта, плеча.
Миоклонии – сокращения в хаотичном порядке отдельных мышечных волокон. За счет них некоторые группы мышц могут совершать непроизвольные движения, рывки.
Хорея – неритмичные рывковые движения, производимые с большой амплитудой. При них двигаться произвольно крайне тяжело, обычно они начинаются с конечностей.
Баллизм – резкие и непроизвольные вращательные движения в плече или бедре, из-за чего конечность совершает бросковые движения.
Блефароспазм – резкое непроизвольное смыкание века из-за повышения тонуса мышц.
Оромандибулярная дистония – непроизвольные смыкания челюстей с открытием рта при жевании, смехе или разговоре.
Писчий спазм – резкое сокращение мышц в области кисти при письме, нередко вместе с дрожанием кисти.
Атетоз – медленные извивающиеся движения в пальцах, стопе, кистях, лице.
Торсионная дистония – медленные скручивающие движения в области торса.
Лицевой гемиспазм – спазм мышц начинается с века, переходя на всю половину лица.
Виды гиперкинеза у взрослых
Гиперкинезы бывают различными, в зависимости от того, какая часть нервной системы и экстрапирамидного пути повреждена. Варианты различаются по темпу движений и особенностям так называемого «двигательного рисунка», времени возникновения и характеру этих движений.
Неврологи выделяют несколько групп гиперкинезов, по локализации их патологической основы.
Повреждения в подкорковых образованиях – их проявления будут в форме хореи, торсионной дистонии, атетоза или баллизма. Движения человека характеризует отсутствие какой-либо ритмичности, достаточно сложные, необычные движения, нарушение тонуса мышц (дистония) и широкие вариации движений.
Повреждения в стволе мозга – в этом случае будет типичным тремор (дрожание) появление миоритмий, тиков, лицевых спазмов, миоклоний. Для них характерна ритмичность, движения относительно простые и стереотипные.
Поражения корковых и подкорковых структур – для них типичны приступы эпилепсии, генерализованные гиперкинезы, диссинергия Ханта, моклонусы.
Если рассматривать скорость движений, которые непроизвольно возникают в теле, можно выделить:
постоянные движения, которые могут исчезать только во сне (это, например, дрожание или атетоз);
приступообразные, которые возникают периодами, ограниченными во времени (это тики, миоклонии).
Лечение гиперкинеза у взрослых
Диагностика
Основной план диагностики подразумевает консультацию невролога. Врач оценивает тип гиперкинеза, определяет сопутствующие симптомы, психические функции, интеллект. Также назначаются:
Современные методы лечения
– Из современных методов лечения, – объясняет врач-невролог Валентина Кузьмина, – можно выделить ботулинотерапию. Например, первичный писчий спазм можно уменьшить с помощью холинолитиков, но более перспективный метод лечения – инъекции ботулотоксина в мышцы, вовлеченные в гиперкинез.
При выраженном кинетическом компоненте тремора, а также треморе головы и голосовых складок, эффективен клоназепам.
При мозжечковом треморе, плохо поддающемся лечению, обычно используют ГАМК-ергические препараты, а также утяжеление конечности с помощью браслета.
Профилактика гиперкинеза у взрослых в домашних условиях
– Специфических мер профилактики развития заболевания не существует, – подчеркивает врач-невролог Валентина Кузьмина. – Профилактика ухудшения уже имеющегося заболевания направлена в первую очередь на ограничение психоэмоциональных нагрузок, стрессов. Также важным является соблюдение здорового образа жизни – полноценное питание, правильный режим отдыха и работы и др.
Популярные вопросы и ответы
Почему опасны гиперкинезы, когда нужно обращаться к врачу, нужно ли пить лекарства и можно ли полечиться самим, рассказала врач-невролог Валентина Кузьмина.
Какие могут последствия у гиперкинеза взрослых?
Среди основных последствий гиперкинеза у взрослых можно выделить проблемы с работой и в быту. Гиперкинезы не являются состоянием, опасным для жизни пациента. В некоторых случаях отсутствие лечения может привести к развитию ограничений подвижности суставов, вплоть до контрактур. Ограничения подвижности могут значительно осложнять осуществление таких простых бытовых действий, как одевание, расчесывание волос, умывание и т.д.
Постепенное развитие атрофии мышц приводит к полной неподвижности и инвалидности пациента.
Существуют ли лекарства от гиперкинеза?
Да, лекарства существуют, пить их надо будет постоянно, иначе гиперкинез усилится. Основной целью лечения является уменьшение имеющейся симптоматики и повышение качества жизни пациента.
Можно ли вылечить гиперкинез народными средствами?
Нет. Подобные методы не имеют доказанной эффективности, более того, они могут серьезно навредить, привести к прогрессированию основного заболевания из-за упущенного времени.
Гиперкинезы – формы, причины, симптомы и лечение
Причины патологии
Главная причина гиперкинезов – это дисфункция церебрального двигательного аппарата. Это нарушение может быть вызвано различными факторами:
Гиперкинезы в ряде случаев возникают как побочный эффект при приеме психостимуляторов или нейролептиков.
Патогенез
Гиперкинезы возникают вследствие нарушений в деятельности экстрапирамидной системы ЦНС. Она отвечает за регулирование напряжения мышц, контролирует положение тела в пространстве и управляет мимикой. Несогласованность в работе мозговой коры, мозжечка, ядер двигательного анализатора искажает импульсы двигательных нейронов, поступающих к мыщцам. В результате моторика человека искажается и принимает аномальный характер.
Общая симптоматика
К главным симптомам гиперкинезов относятся двигательные акты, совершаемые пациентами против их воли, так называемые насильственные. Сами пациенты описывают их как результат непреодолимого желания, которому они не могут противостоять.
В перечень симптомов, представляющих гиперкинезы, входят:
Формы гиперкинезов могут варьировать от прерывисто частых до постоянных. Некоторым больным удается усилием воли контролировать определенные формы гиперкинезов (например, тики), но через некоторое время приступ насильственных движений снова проявляет себя с еще большей силой.
Виды гиперкинезов
Существуют различные критерии, которые используются для классификации патологии. Благодаря им, можно выделить следующие виды гиперкинезов:
Гиперкинезы при ДЦП у детей начинают проявляться в возрасте 1,5-2 года. Дети с такой патологией с трудом координируют свои движения, которые часто выглядят как толчки, рывки и скручивания. Повторяющиеся движения могут быть быстрыми и ритмичными или, наоборот, медленными и беспорядочными.
Гиперкинезы при ДЦП могут сопровождаться нарушениями глотания, задержкой и расстройствами речи, лабильностью эмоциональной системы.
Возможные осложнения
Постепенное развитие атрофии мышц приводит к полной неподвижности и инвалидности пациента.
Диагностика
Прежде, чем определить, как лечить гиперкинез, необходимо провести точную и достоверную диагностику. При этом обращают внимание на клиническую картину заболевания, оценку психологического и интеллектуального состояния пациента.
В диагностике гиперкинезов используются:
Некоторым пациентам назначают консультацию генетика. Она необходима, если есть подозрение о том, что гиперкинезы являются симптомами наследственных заболеваний.
Диагностика гиперкинезов – это длительный процесс, на который понадобится несколько недель. Определение причин патологии позволит лечить гиперкинез более эффективно.
Лечение гиперкинезов
Традиционное лечение гиперкинезов подразумевает применение консервативной терапии. Пациенту подбирают необходимые лекарственные средства следующих групп:
В процессе лечения подбор препаратов осуществляется индивидуально, с учетом состояния пациента. Подбор лучше проводить в условиях стационарного лечения.
Помимо медикаментозной терапии в лечении применяются массажи, выполнение упражнений ЛФК, физиолечение. Пациентам с таким диагнозом показано санаторно-курортное лечение.
Лечение гиперкинезов у детей подразумевает назначение препаратов Пирацетам и Пантокальцин. Они снижают двигательную активность, нормализуют работу сосудистой системы головного мозга. Для улучшения метаболизма клеток головного мозга применяют Глицин, Гликозил, для расслабления мускулатуры – средство Ацедипрол. Для обеспечения клеток головного мозга кислородом принимают витамины группы В.
При гиперкинезах детям назначают массажи, водные и физиотерапевтические процедуры, лечебную физкультуру. В особо сложных случаях показано хирургическое вмешательство.
В целом гиперкинезы не представляют опасности для жизни пациента, но вызывают значительные трудности в его нахождении в обществе и формировании взаимодействия с другими людьми. Полностью исключить самопроизвольные движения пациента нельзя, но при регулярном лечении можно достичь снижения их интенсивности, тем самым улучшив качество жизни человека.
На данный момент не существует эффективных профилактических мер, которые способны снизить риск развития патологии. Среди общих рекомендаций – своевременное выявление и лечение перинатальных, травматических и токсических поражений мозга, консультации генетиков лицам с наследственной предрасположенностью к патологии.
Современные подходы к лечению больных гипертрофической кардиомиопатией
Полувековая история изучения проблемы гипертрофической кардиомиопатии (ГКМП) отражает значительную эволюцию знаний в области этиологии, патогенеза, диагностики, клинического течения, прогноза и вариантов лечения этого заболевания. За указанный период тол
Полувековая история изучения проблемы гипертрофической кардиомиопатии (ГКМП) отражает значительную эволюцию знаний в области этиологии, патогенеза, диагностики, клинического течения, прогноза и вариантов лечения этого заболевания. За указанный период только в англоязычных изданиях опубликованы более 1000 крупных научных работ. ГКМП — одна из основных и, вероятно, наиболее распространенных форм кардиомиопатий, заболеваний миокарда, сопровождающихся его дисфункцией (Report of the 1995 WHO/ISFC Task Force on the Definition and Classification of Cardiomyopathy) [1].
В 2003 г. создан Международный комитет (ACC/ESC), объединивший американских и европейских экспертов по ГКМП, и опубликовано сообщение, суммировавшее основные положения, включая стратегию лечебных мероприятий [2].
Определение заболевания носит описательный характер. Так, по современным представлениям, ГКМП является преимущественно генетически обусловленным заболеванием мышцы сердца, характеризующимся комплексом специфических морфофункциональных изменений и неуклонно прогрессирующим течением с высокой угрозой развития тяжелых, жизнеугрожающих аритмий и внезапной смерти (ВС). ГКМП характеризуется массивной гипертрофией миокарда левого и/или реже правого желудочка, чаще асимметричного характера за счет утолщения межжелудочковой перегородки (МЖП), нередко с развитием обструкции (систолического градиента давления) выходного тракта ЛЖ при отсутствии видимых причин (артериальная гипертония, пороки и специфические заболевания сердца). Основным методом диагностики остается эхокардиографическое исследование. В зависимости от наличия или отсутствия градиента систолического давления в полости ЛЖ, ГКМП разделяют на обструктивную и необструктивную, что имеет важное практическое значение при выборе тактики лечения. При этом различают 3 гемодинамических варианта обструктивной ГКМП: с субаортальной обструкцией в покое (так называемой базальной обструкцией); с лабильной обструкцией, характеризующейся значительными спонтанными колебаниями внутрижелудочкового градиента давления без видимой причины; с латентной обструкцией, которая вызывается только при нагрузке и провокационных фармакологических пробах (в частности, вдыханием амилнитрита, при приеме нитратов или внутривенном введении изопротеренола).
Типичными являются морфологические изменения: аномалия архитектоники сократительных элементов миокарда (гипертрофия и дезориентация мышечных волокон), развитие фибротических изменений мышцы сердца, патология мелких интрамиокардиальных сосудов [3, 4].
В настоящее время наблюдается повсеместный рост числа зарегистрированных случаев этой патологии как за счет внедрения в практику современных методов диагностики, так и, вероятно, в связи с истинным увеличением числа больных ГКМП [8, 9]. Согласно данным последних исследований, распространенность заболевания в общей популяции является более высокой, чем считалось ранее, и составляет 0,2% [10, 11]. ГКМП может диагностироваться в любом возрасте, от первых дней до последней декады жизни, однако преимущественно заболевание выявляется у лиц молодого трудоспособного возраста [12, 13]. Ежегодная смертность больных ГКМП колеблется в пределах от 1 до 6%: у взрослых больных составляет 1–3% [14, 15], а в детском и подростковом возрасте у лиц с высоким риском ВС — 4–6% [16, 17].
Общепризнанна концепция о преимущественно наследственной природе ГКМП [18, 19]. В литературе широкое распространение получил термин «семейная гипертрофическая кардиомиопатия». К настоящему времени установлено, что более половины всех случаев заболевания являются наследуемыми [20, 21], при этом основной тип наследования — аутосомно-доминантный. Оставшиеся приходятся на так называемую спорадическую форму; в этом случае у пациента нет родственников, болеющих ГКМП или имеющих гипертрофию миокарда. Считается, что большинство, если не все случаи спорадической ГКМП, также имеют генетическую причину, т. е. вызваны случайными мутациями.
ГКМП — это генетически гетерогенное заболевание, причиной которого являются более 200 описанных мутаций нескольких генов, кодирующих белки миофибриллярного аппарата [2, 22]. К настоящему времени известны 10 белковых компонентов сердечного саркомера, выполняющих контрактильную, структурную или регуляторную функции, дефекты которых наблюдаются при ГКМП. Причем в каждом гене множество мутаций могут становиться причиной заболевания (полигенное мультиаллельное заболевание).
Наличие той или иной ассоциированной с ГКМП мутации признается «золотым» стандартом диагностики заболевания. При этом описанные генетические дефекты характеризуются разной степенью пенетрантности, выраженностью морфологических и клинических проявлений. Тяжесть клинической картины зависит от присутствия и степени гипертрофии. Мутации, которые ассоциируются с высокой пенетрантностью и плохим прогнозом, выражаются большей гипертрофией левого желудочка и толщиной МЖП, чем те, которые характеризуются низкой пенетрантностью и имеют хороший прогноз. Так, было показано, что лишь отдельные мутации ассоциированы с плохим прогнозом и высокой частотой ВС. К ним относятся замены Arg 403 Gln, Arg 453 Cys, Arg 719 Trp, Arg 719 Gln, Arg 249 Gln в гене тяжелой цепи β-миозина, InsG 791 в гене миозин-связывающего белка С и Asp 175 Asn в гене α-тропомиозина [23, 24, 25, 26]. Для мутаций в гене тропонина Т характерна умеренная гипертрофия миокарда, однако прогноз достаточно неблагоприятен, а вероятность внезапной остановки сердца высока [27]. Другие генетические аномалии, как правило, сопровождаются доброкачественным течением и благоприятным прогнозом или занимают промежуточное положение по тяжести вызываемых ими проявлений.
Таким образом, ГКМП характеризуется крайней гетерогенностью вызывающих ее причин, морфологических, гемодинамических и клинических проявлений, разнообразием вариантов течения и прогноза, что существенно затрудняет выбор адекватных и наиболее эффективных лечебных подходов по контролю и коррекции имеющихся нарушений. При этом отчетливо выделяются 5 основных вариантов течения заболевания и исходов:
Вариабельность прогноза определяет необходимость детальной стратификации риска фатальных осложнений заболевания, поиск доступных прогностических предикторов и критериев оценки проводимого лечения.
По современным представлениям, лечебная стратегия определяется в процессе разделения больных на категории в зависимости от описанных выше вариантов течения и прогноза (рис.).
Все лица с ГКМП, включая носителей патологических мутаций без фенотипических проявлений болезни и пациентов с бессимптомным течением заболевания, нуждаются в динамическом наблюдении, в ходе которого оцениваются характер и выраженность морфологических и гемодинамических нарушений. Особое значение имеет выявление факторов, определяющих неблагоприятный прогноз и повышенный риск ВС (в частности, скрытых прогностически значимых аритмий).
К общим мероприятиям относятся ограничение значительных физических нагрузок и запрещение занятий спортом, способных вызывать усугубление гипертрофии миокарда, повышение внутрижелудочкового градиента давления и риска ВС. Для предупреждения инфекционного эндокардита в ситуациях, связанных с развитием бактериемии, при обструктивных формах ГКМП рекомендуется антибиотикопрофилактика, аналогичная таковой у больных с пороками сердца.
До настоящего времени окончательно не решен вопрос о необходимости проведения активной медикаментозной терапии у наиболее многочисленной группы больных с бессимптомной или малосимптомной формами ГКМП и низкой вероятностью ВС. Противники активной тактики обращают внимание на то, что при благоприятном течении заболевания продолжительность жизни и показатели смертности не отличаются от таковых в общей популяции [28, 29]. Некоторые же авторы указывают на то, что использование в этой группе пациентов β-адреноблокаторов и антагонистов кальция (верапамил) может приводить к сдерживанию гемодинамических нарушений и клинической симптоматики [30, 31]. При этом никто не оспаривает тот факт, что выжидательная тактика в случаях бессимптомного или малосимптомного течения ГКМП возможна лишь при отсутствии признаков внутрижелудочковой обструкции, обмороков и серьезных нарушений сердечного ритма, отягощенной наследственности и случаев ВС у близких родственников.
Следует признать, что лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, пока может быть в большей степени симптоматическим и паллиативным. Тем не менее к основным задачам лечебных мероприятий относятся не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания.
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: β-адреноблокаторы и блокаторы кальциевых каналов (верапамил). Для лечения весьма распространенных при этом заболевании нарушений сердечного ритма используются также дизопирамид и амиодарон.
β-адреноблокаторы стали первой и остаются и по сей день наиболее эффективной группой лекарственных средств, применяемых в лечении ГКМП. Они оказывают хороший симптоматический эффект в отношении основных клинических проявлений: одышки и сердцебиения, болевого синдрома, включая стенокардию, не менее чем у половины больных ГКМП [32, 33, 34], что обусловлено, в основном, способностью этих препаратов уменьшать потребность миокарда в кислороде. Благодаря отрицательному инотропному действию и уменьшению активации симпатоадреналовой системы при физическом и эмоциональном напряжении, β-блокаторы предотвращают возникновение или повышение субаортального градиента давления у больных с латентной и лабильной обструкцией, существенно не влияя на величину этого градиента в покое. Убедительно показана способность β-блокаторов улучшать функциональный статус пациентов в условиях курсового и длительного применения [35]. Хотя препараты не оказывают прямого влияния на диастолическое расслабление миокарда, они могут улучшать наполнение ЛЖ косвенно — за счет уменьшения частоты сердечных сокращений и предупреждения ишемии сердечной мышцы [36]. В литературе имеются данные, подтверждающие способность β-блокаторов сдерживать и даже приводить к обратному развитию гипертрофии миокарда [37, 38]. Однако другие авторы подчеркивают, что вызываемое β-блокаторами симптоматическое улучшение не сопровождается регрессией гипертрофии ЛЖ и улучшением выживаемости больных [39]. Хотя эффект этих препаратов в отношении купирования и предупреждения желудочковых и суправентрикулярных аритмий и внезапной смерти не доказан, ряд специалистов все же считают целесообразным их профилактическое назначение больным ГКМП высокого риска, включая пациентов молодого возраста с отягощенным случаями внезапной смерти семейным анамнезом [40].
Предпочтение отдается β-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают начиная с 20 мг 3-4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой в большинстве случаев 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, так как отсутствие эффекта терапии β-блокаторами, вероятно, связано с недостаточной дозировкой. При этом нельзя забывать о том, что повышение дозировок существенно увеличивает риск известных побочных эффектов.
В настоящее время широко изучается возможность эффективного применения нового поколения кардиоселективных β-блокаторов пролонгированного действия, в частности атенолола, конкора и др. При этом существует мнение о том, что кардиоселективные β-блокаторы у больных ГКМП не имеют преимуществ перед неселективными, так как в больших дозах, к достижению которых следует стремиться, селективность практически утрачивается. Следует отметить, что рекомендуемый к применению у больных ГКМП с тяжелыми суправентрикулярными и желудочковыми аритмиями соталол сочетает в себе свойства неселективных β-блокаторов и антиаритмических средств III класса (кордароноподобный эффект).
Применение блокаторов медленных кальциевых каналов при ГКМП основано на снижении уровня свободного кальция в кардиомиоцитах и нивелировании асинхронии их сокращения, улучшении расслабления миокарда и снижении его сократимости, подавлении процессов гипертрофии миокарда. Среди блокаторов кальциевых каналов препаратом выбора, благодаря наибольшей выраженности отрицательного инотропного действия и наиболее оптимальному профилю фармакологических свойств, является верапамил (изоптин, финоптин). Он обеспечивает симптоматический эффект у 65–80% больных, включая случаи рефрактерности к лечению β-блокаторами, что обусловлено способностью препарата уменьшать ишемию миокарда, в том числе безболевую, и улучшать его диастолическое расслабление и податливость ЛЖ [41, 42, 43]. Это свойство верапамила обеспечивает повышение толерантности больных к физической нагрузке и снижение субаортального градиента давления в покое при меньшей по сравнению с β-блокаторами способности к уменьшению внутрижелудочковой обструкции в случаях физического и эмоционального напряжения и провокации изопротеренолом. Одновременно верапамил снижает периферическое сосудистое сопротивление вследствие вазодилататорного действия [44]. И хотя этот эффект чаще всего нивелируется непосредственным положительным влиянием на диастолическую функцию ЛЖ, у отдельных больных с базальной внутрижелудочковой обструкцией в сочетании с повышенным конечно-диастолическим давлением ЛЖ и склонностью к системной артериальной гипотензии при уменьшении постнагрузки внутрижелудочковый градиент давления может резко возрастать. Это способно приводить к развитию отека легких, кардиогенного шока и даже внезапной смерти [45]. Подобные грозные осложнения фармакотерапии верапамилом описаны также у больных необструктивной ГКМП с высоким давлением в левом предсердии, у которых они обусловлены отрицательным инотропным действием препарата. Очевидно, как важно соблюдать осторожность при начале лечения верапамилом этой категории больных. Прием препарата следует начинать в условиях стационара с малых доз — 20–40 мг 3 раза в день с постепенным их повышением при хорошей переносимости до снижения частоты сердечных сокращений в покое до 50–60 уд/мин. Клинический эффект наступает обычно при приеме не менее 160–240 мг препарата в сутки; более удобны в условиях длительного применения пролонгированные формы (изоптин-ретард, верогалид-ретард). С учетом благоприятного влияния верапамила на диастолическую функцию и величину субаортального градиента давления в ЛЖ, а также доказанной способности увеличивать выживаемость больных ГКМП по сравнению с плацебо [46], целесообразно его профилактическое назначение у асимптоматичных больных ГКМП высокого риска.
Место дилтиазема в лечении ГКМП окончательно не определено. Имеются данные, что в средней дозе 180 мг/сут за 3 приема он оказывает столь же выраженное, как 240 мг верапамила, благотворное влияние на диастолическое наполнение ЛЖ и одинаковый симптоматический эффект, однако в меньшей степени улучшает физическую работоспособность больных [47].
В нашей клинике продолжается проспективное наблюдение (от 1 до 5 лет) более 100 больных ГКМП. Больные были рандомизированы на 3 сопоставимые по количеству, полу, возрасту и тяжести клинических проявлений группы. Пациентам произвольно назначались атенолол или изоптин-ретард; в третьей группе преобладали лица с тяжелыми желудочковыми нарушениями ритма, и им был рекомендован прием соталола. Оценка эффективности различных вариантов медикаментозного лечения проводилась в условиях длительного (не менее 1 года) применения препаратов. Суточные дозы при двухкратном режиме приема титровались индивидуально и составили в среднем 85, 187, 273 мг для атенолола, изоптина и соталола соответственно. Длительная терапия привела к улучшению клинического состояния соответственно у 77, 72 и 83% пациентов каждой группы, что выражалось в достоверном уменьшении основных симптомов, проявлений сердечной недостаточности (СН), увеличении мощности и времени выполненной нагрузки и улучшении показателей качества жизни (на 25, 32 и 34% соответственно). При этом выявлены достоверное (p
С. А. Габрусенко, кандидат медицинских наук
Ю. В. Сафрыгина
В. Г. Наумов, доктор медицинских наук, профессор
Ю. Н. Беленков, доктор медицинских наук, профессор
НИИ кардиологии им. А. Л. Мясникова РК НПК МЗ РФ, Москва


.jpg)
