Гиперинсулинемия что это такое простыми словами
ГИПЕРИНСУЛИНЕМИЯ, ВЛИЯНИЕ НА МЕТАБОЛИЧЕСКИЕ ПРОЦЕССЫ В ОРГАНИЗМЕ
Никольская 1 В.А., Постольник 2 Н. А., Меметова 3 З.Н.
1 Кандидат биологических наук, доцент, Таврический национальный университет им. В.И. Вернадского; 2 Магистр, Таврический национальный университет им. В.И. Вернадского; 3 Аспирант, Таврический национальный университет им. В.И. Вернадского
ГИПЕРИНСУЛИНЕМИЯ, ВЛИЯНИЕ НА МЕТАБОЛИЧЕСКИЕ ПРОЦЕССЫ В ОРГАНИЗМЕ
Аннотация
В данной статье определена результирующая в изучении воздействия гиперинсулинемического состояния на различные процессы в организме при его проявлении как в роли самостоятельного фактора влияния на организм, так и в виде осложнения при патологии, а также произведена краткая систематизация имеющихся в литературе данных, способствующих раскрытию механизмов возникновения и развития гиперинсулинемии.
Ключевые слова: гиперинсулинемия, гестационный сахарный диабет, ишемическая болезнь сердца, окислительная модификация белков.
HYPERINSULINEMIA, INFLUENCE ON METABOLIC PROCESSES IN AN ORGANISM
Abstract
In this article a resultant is certain in the study of influence of the state excessively increased contents of insulin on different processes in an organism at his display both in a role of independent factor of influence on an organism and as complication at pathology, and also short systematization of present in literature of information, cooperant opening of mechanisms of origin and development of hyperinsulinemia is made.
Keywords: hyperinsulinemia, gestational diabetes, ischemic disease, oxidative мodifications of proteins.
Изменения метаболических процессов в организме определяют последующую вероятность развития патологии, а структурный след любого отклонения – её интенсивность и направленность; следует учитывать, что, в конечном счете, совокупность затронутых звеньев различных процессов обусловливают характер выраженности заболевания.
Система тестирования, как правило, направлена на выявление индикаторов любого патологического состояния или изменения физиологического. Однако следует отметить, что предикторная функция является той малоиспользуемой составной частью медицинских исследований, которая позволила бы уже на ранних этапах диагностировать отклонения, а не фиксировать уже имеющуюся патологию.
Сегодня, помимо инсулиннезависимого сахарного диабета, установлен целый ряд заболеваний, в том числе сердечно−сосудистой системы, при которых выявлена гиперинсулинемия [1−8]. Вместе с тем хорошо известен феномен гиперинсулинемии как адаптивный процесс, который развивается в ответ на тканевую гипоксию после достаточно длительного периода гипоксических тренировок.
Инсулинотерапия применяется с лечебной целью у психически больных [9,10]. Лечебный эффект связан не с прямым действием инсулина на центральную нервную систему, а с вызываемой инсулином гипогликемией, которая оказывает влияние на нервную систему и обмен веществ [11,12].
В настоящее время установлена многогранность эффектов инсулина [13,14] Показаны некоторые механизмы его непосредственного участия в регуляции сосудистого тонуса, энергетического метаболизма кардиомиоцитов [6,15]. Особое значение придают роли инсулина в регуляции микроциркулярного звена коронарного русла и обеспечении жизнедеятельности сердца. Поэтому изучение механизмов развития и последствий ответной реакции организма на состояние гиперинсулинемии является одной из важных задач биохимии и медицины, поскольку данное состояние может быть как выражением отклонения с последующим нарастанием негативных последствий, в результате чего возможно развитие патологии, так и сопутствующим фактором, обеспечивающим усиление и увеличение количества осложнений.
Воздействие экспериментальной гиперинсулинемии на организм
Изучение биохимического аспекта влияния на организм гиперинсулинемического состояния, проявляющегося гипогликемическим симптомокомплексом, является несомненно актуальным в связи с тем, что его проявление достаточно часто встречается в лечебной практике; кроме того искусственно вызванная гиперинсулинемия применяется в лечении психических расстройств. Гиперинсулинемическое состояние может быть вызвано различными причинами [16−20] и обусловлено абсолютным или относительным повышением уровня инсулина. При этом особую значимость имеют гипогликемии у больных сахарным диабетом, развивающиеся на фоне инсулинотерапии, реже при лечении сахароснижающими сульфаниламидными препаратами, что в свою очередь может вызывать диагностические ошибки и трудности [21].
Инсулин усиливает транспорт гексоз и аминокислот через цитолемму клеток тканей, снижая их уровень в крови, синтез гликогена, белков и липосинтез [22]. В то же время инсулин предохраняет гексозофосфаты от расщепления, тормозит глюконеогенез и липолиз. Снижение глюкозы крови под воздействием избыточной секреции инсулина (например, в случае опухоли островковых клеток Лангерганса, врожденной гиперинсулинемии) либо введении больших доз инсулина может привести к гипогликемии [15].
В процессе метаболизма в клетках аэробных организмов постоянно образуются активные формы кислорода (АФК), которые при избыточной их продукции либо при нарушении работы защитных систем могут оказывать токсическое действие и приводить к окислительной модификации фактически всех аминокислот, вызывая деградацию очищенных белков, белков интактных клеток и интрацеллюлярных органелл [23], к разрушению структуры мембран клеток и, как следствие, к окислительному повреждению тканей и органов [24−26]. Накопление продуктов свободнорадикального окисления ведет к истощению антиоксидантной системы, снижению содержания восстановленного глутатиона и активности супероксиддисмутазы и каталазы. Одним из серьезных нарушений энергетического обмена при усилении свободнорадикального окисления является разобщение дыхания и фосфолирирования, а, следовательно, и ослабление биосинтеза макроэргических соединений, особенно АТФ. Это, в свою очередь, затормаживает процессы биосинтеза белков, нуклеиновых кислот и других соединений, а также нарушает функции организма [24,27,28].
Результаты исследований воздействия на организм белых крыс–самцов (Rattus norvegicus) экспериментальной гиперинсулинемии свидетельствуют, о том, что воздействие инсулинового шока приводит к увеличению степени окислительной модификации белков: содержания альдегид–динитрофенилгидразонов и кетон–динитрофенилгидразонов как нейтрального, так и основного характера в исследуемых тканях опытных групп лабораторных крыс по сравнению с контрольной [29].
Перегрузка дыхательной цепи митохондрий при активном гликолизе приводит к тому, что молекула кислорода способна присоединять один электрон, образуя супероксиданион–радикал •О2ˉ. В этих условиях супероксиданион–радикал претерпевает превращения, приводящие к образованию других высокореакционных радикалов, которые могут причинить прямой вред клетке: •О2ˉ, H2O2, ОН • [30]. Утилизация глюкозы крови при воздействии избыточных доз инсулина способствует снижению процессов гликолиза и ослаблению биосинтеза АТФ. При адаптации организма к стрессовым ситуациям для быстрого образования и получения АТФ имеют место более короткие пути тканевого дыхания: отщепившиеся в процессе окисления в цикле Кребса атомы водорода переносятся на флавиновые ферменты электронотранспортной цепи митохондрий, минуя систему никотинамидных ферментов, при этом образуется всего две молекулы АТФ вместо трех. Более коротким путем быстрого получения АТФ является перенос атомов водорода с окисляемых субстратов с помощью флавиновых ферментов непосредственно на молекулярный кислород, минуя систему цитохромов. Конечным продуктом окисления в этих случаях будет не вода, а пероксид водорода [28,30]. Повышение скорости образования свободных радикалов нарушает работу антиоксидантных систем (АО), а, следовательно, ведет к накоплению АФК, избыточная продукция которых оказывает токсическое действие и приводит к окислительному повреждению тканей и органов [30].
После введения избыточных доз инсулина в ткани печени наблюдалось достоверное увеличение содержания альдегидных продуктов нейтрального характера на 24%, кетонных продуктов нейтрального характера – на 13%, продуктов окислительной модификации аминокислотных остатков основного характера – на 36%. После введения глюкозы достоверных изменений показателя окислительной модификации белков в ткани печени крыс не выявлено.
В ткани головного мозга после введения избыточных доз инсулина содержание окислительных продуктов нейтрального характера возросло в 1,4 раза, альдегидных продуктов основного характера – в 2 раза, кетонных продуктов основного характера – в 5 раз.
После введения глюкозы достоверно снижалось на 30% содержание альдегидных и кетонных продуктов окислительной модификации нейтрального характера, большая часть которых может быть продуктами окислительной модификации гидрофобных аминокислотных остатков. Возможно, полученные результаты являются подтверждением того, что окислительную модификацию претерпевают аминокислотные остатки не только в поверхностных слоях, но и в более глубоких участках белковых молекул ткани, где они также подвержены окислительной деградации при воздействии АФК [23,24].
Фактором, усиливающим окислительный стресс в ткани головного мозга, является закисление среды, вызванное происходящей при гипоксии активацией гликолиза. При этом образование АТФ уменьшается [28]. Поэтому после введения глюкозы и восстановления кровообращения появляющийся в тканях кислород взаимодействует с промежуточными компонентами дыхательной цепи. Такое взаимодействие происходит по одноэлектронному пути и заканчивается образованием супероксиданион−радикала [25,26]. В результате этого купирование гипогликемии глюкозой в ткани головного мозга не привело к снижению показателей окислительной модификации белков.
В ткани сердца лабораторных крыс после введения избыточных доз инсулина содержание продуктов окислительной модификации белков по сравнению с контрольной группой увеличилось почти в 2 – 2,5 раза при всех длинах волн, регистрирующих данные соединения. После купирования комы глюкозой в ткани сердца крыс наблюдается достоверное снижение содержания продуктов окислительной модификации белков: альдегидных – в 1,5 раза, кетонных – в 2 раза по сравнению с показателем крыс в состоянии выраженной гиперинсулинемии.
Снижение изученных показателей в ткани сердца могут являться отражением на биохимическом уровне сопряжения состояния данного органа и изменений концентрации глюкозы в постоянной циркулирующей крови.
Результаты исследований позволяют предположить, что изменения показателя окислительной модификации белков в тканях лабораторных крыс могут быть обусловлены резким снижением содержания углеводов под воздействием экспериментальной гиперинсулинемии, что приводит к уменьшению скорости гликолитических процессов, ослаблению биосинтеза АТФ с последующей интенсификацией окислительных реакций.
Гиперинсулинемия при развитии патологических состояний
Относительное увеличение инсулина может наблюдаться у больных с надпочечниковой недостаточностью. Это обусловлено не столько увеличением секреции инсулина β−клетками островков Лангерганса, сколько со снижением секреции кортизола корой надпочечников. Дефицит гормона−антагониста инсулина – кортизола, может вызвать повышение уровня инсулина, и в частности С−пептида [32 – 37].
Показано, что при данной патологии наблюдается тенденция к увеличению концентрации калия и уменьшению натрия в сыворотке крови по сравнению с контрольной группой. Показаны достоверные изменения концентрации исследуемых ионов в эритроцитах больных с гипофункцией коры надпочечников: в направлении повышения на 11% – для концентрации ионов калия и снижения на 23% – для ионов натрия, по сравнению с контрольной группой [38].
Всасывание натрия усиливается в присутствии кортизола, а так как у больных с надпочечниковой недостаточностью наблюдается достоверное снижение кортизола, то в результате этого снижается концентрация натрия в крови, приводящие к уменьшению концентрации глюкозы в эритроцитах из−за нарушения механизма транспорта глюкозы в клетку [39]. Нарушение ионного обмена связано с недостаточной секрецией гормонов коры надпочечников и сопровождается комплексом структурно−метаболических нарушений эритроцитов в виде дезорганизации плазматических мембран с увеличением проницаемости мембраны для ионов воды [39,40].
Гиперинсулинемия являются одним из основных факторов, ведущих к развитию СД 2 типа, особенно у лиц с наследственной предрасположенностью [18]. В условиях инсулинорезистентности происходит снижение утилизации глюкозы периферическими тканями, повышается продукция глюкозы печенью, что способствует развитию гипергликемии. При адекватной способности β−клеток реагировать на повышение глюкозы в крови компенсаторной гиперинсулинемией сохраняется состояние нормогликемии. Однако постоянная стимуляция β−клеток в сочетании с вероятными генетическими нарушениями, влияющими на их функциональные возможности, и воздействием повышенной концентрации СЖК на β−клетки (феномен липотоксичности), способствуют развитию секреторной дисфункции β−клеток, прогрессирующему нарушению секреции инсулина. С течением времени развивается СД 2 типа.
Исследования зарубежных ученых показали, что высокий уровень инсулина у практически здоровых мужчин увеличивает риск развития ишемической болезни сердца. Причем эта взаимосвязь не зависела от массы тела, артериального давления или концентрации липопротеидов в плазме крови. У пациентов с ишемической болезнью сердца изначальные значения содержания инсулина натощак были на 18% выше, чем в контрольной группе. Взаимоотношения между уровнем инсулина и ишемической болезнью сердца не изменились и после того, как были внесены поправки на уровень триглицеридов и липопротеидов высокой и низкой плотности [15,31 ].
Гиперинсулемия, манифестирующая при индуцированной ишемии, не связана с инсулинрезистентностъю, но, вероятно, является адаптивно−компенсаторной реакцией на возрастание потребности миокарда в глюкозе и может быть одним из ранних маркеров ишемической болезни сердца [3].
Достоверных сведений о роли коррекции уровня инсулина в крови, как и показателя инсулинорезистентности для уменьшения заболеваемости ишемической болезнью сердца и смертности пока нет.
Комплекс метаболических, гормональных и клинических нарушений, являющихся факторами риска развития сердечно−сосудистых заболеваний, в основе которых лежит инсулинорезистентность и компенсаторная гиперинсулинемия, в литературе известен под названием синдром X. Также употребляются названия метаболический синдром и синдром инсулинорезистентности [2,4,42].
Нарушения, объединенные рамками метаболического синдрома, длительное время протекают бессимптомно, нередко начинают формироваться в подростковом и юношеском возрасте, задолго до клинической манифестации СД 2 типа, артериальной гипертензии и атеросклеротических поражений сосудов. Следует отметить, что взаимосвязь между артериальной гипертензией и гиперинсулинемией при метаболическом синдроме до сих пор продолжает активно обсуждаться. В развитии артериальной гипертензии при синдроме инсулинорезистентности ведущее значение имеет комплексное влияние гиперинсулинемии и сопутствующих метаболических нарушений [41].
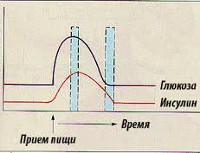
Гестационный сахарный диабет представляет по своей сути непереносимость глюкозы, впервые диагностированную во время беременности [1]. Порог, при котором непереносимость глюкозы вредно воздействует на беременность и увеличивает риск будущего диабета у матери и ее ребенка, неизвестен. Поэтому вопрос о лечении остается спорным. С точки зрения перспективы развития диабета беременность представляет собой физиологический стрессовый тест β−клеткам, сохранение толерантности к глюкозе при этом зависит от присутствия достаточного запаса материнских β−клеток. При нормальной беременности чувствительность к инсулину уменьшается вдвое, а выделение инсулина после приема пищи увеличивается к третьему триместру и возникает гиперинсулинемия [22]. Гестационный сахарный диабет развивается при неспособности повысить секрецию инсулина до уровня, достаточного, чтобы противостоять этому физиологическому снижению чувствительности к инсулину и поддерживать эугликемию; доказательства сниженной функции β−клеток могут сохраняться и в послеродовой период [1,22,42].
Клинически вероятно, что особенность роста плода, а не абсолютная масса тела при рождении, лучше отражает гликемический контроль при беременности, сопровождаемой диабетом.
Беременные обезьяны макаки резус, у которых гиперинсулинемия была вызвана экспериментальным путем с помощью инфузии инсулина, показали ненормальный рост плода (с отложением жира в животе и органомегалией), имитирующий огромного младенца у страдающей диабетом матери. Это предполагает, что гиперинсулинемия плода, а не его гипергликемия несет ответственность за особенности роста [1].
Гиперинсулинемия плода и быстрый рост в последнем триместре беременности могут происходить независимо от материнской гликемии как следствие измененной дифференциации и пролиферации фетальных β−клеток в ранний период беременности или присутствия в фетальных β−клетках средства, усиливающего секрецию иначе, чем глюкоза.
Механизмы и последствия воздействия гиперинсулинемии на метаболические процессы в организме
Развитие артериальной гипертонии при СД типа 2 связано с активацией ряда механизмов, особое место среди которых занимает повышение тонуса симпатической нервной системы под влиянием гиперинсулинемии [34−37]. Гиперинсулинемия увеличивает поглощение и обмен глюкозы в инсулинчувствительных клетках вентромедиального гипоталамуса. Это приводит к растормаживанию симпатических центров ствола головного мозга и повышает центральную активность симпатической нервной системы. К усилению активности центральных ядер симпатической нервной системы ведет и уменьшение тормозящих воздействий, исходящих с барорецепторов крупных сосудов шеи, эластичность которых изменяется под воздействием гиперинсулинемии.
Повышение концентрации свободных жирных кислот в крови под влиянием норадреналина, выделение которого повышено в этом случае препятствует поглощению глюкозы мышечными клетками и таким образом способствует еще большему нарастанию инсулинорезистентности и гиперинсулинемии [34−37].
Гиперинсулинемия может приводить к осложнениям, которые повышают риск развития ишемической болезни сердца, поскольку вазодилатацию за счет стимуляции образования окиси азота в клетках сосудистого эндотелия. Однако инсулин также может стимулировать образование эндотелина−1, мощного вазоконстриктора, поэтому возникло предположение, что влияние инсулинорезистетнтости на сосуды зависит от баланса между двумя указанными механизмами. Инсулин также является антинатрийуретическим гормоном, то есть он препятствует экскреции натрия с почками. Это сопровождается задержкой мочевой кислоты, что объясняет высокую распространенность гиперурикемии и предрасположенность к артериальной гипертонии при инсулинорезистентности. Баланс между симпатической и парасимпатической нервными системами также может изменяться под действием инсулина в сторону увеличения активности симпатической нервной системы [14,34−37].
Таким образом, инсулинорезистентность и гиперинсулинемия самостоятельно или опосредованно (через сопутствующие метаболические нарушения), оказывая патологическое воздействие на сердечно−сосудистую систему, в конечном итоге ускоряют развитие атеросклеротических сосудистых заболеваний [3].
Гиперинсулинемия у беременных является причиной вызывающей ряд осложнений при развитии плода. Во−первых, гиперинсулинемия ведет к макросомии плода, являющейся причиной высокой частоты родового травматизма и асфиксии новорожденных. Во−вторых, угнетая синтез лецитина в легких плода, гиперинсулинемия способствует повышению риска развития синдрома дыхательных расстройств (респираторного дистресс−синдрома новорожденных). В−третьих, наличие гиперинсулинемии у плода незадолго перед родами приводит к высокому риску развития гипогликемических состояний, в том числе тяжелых, в раннем послеродовом периоде [1].
Заключение
Возрастающий интерес исследователей к проблеме гиперинсулинемии обусловлен, прежде всего, тем, что осложнения, вызванные или сопутствующие данному состоянию, могут привести к серьезным отдаленным отрицательным последствиям для здоровья человека. На современном этапе развития медицины и биохимии формируется новая система видения процессов формирования данного отклонения, способствующая поиску маркеров, позволяющих оценить интенсивность его проявления.
Клиническая значимость нарушений, объединенных рамками гиперинсулинемического состояния, заключается в том, что их сочетание в значительной степени ускоряет развитие и прогрессирование заболеваний.
Гиперинсулинизм
Гиперинсулинизм — клинический синдром, характеризующийся повышением уровня инсулина и снижением сахара в крови. Гипогликемия приводит к слабости, головокружению, повышению аппетита, тремору, психомоторному возбуждению. При отсутствии своевременного лечения развивается гипогликемическая кома. Диагностика причин состояния основывается на особенностях клинической картины, данных функциональных проб, динамическом исследовании глюкозы, ультразвуковом или томографическом сканировании поджелудочной железы. Лечение панкреатических новообразований – хирургическое. При внепанкреатическом варианте синдрома проводят терапию основного заболевания, назначают специальную диету.
Общие сведения
Причины гиперинсулинизма
Врожденная патология возникает вследствие внутриутробных аномалий развития, задержки роста плода, мутаций в геноме. Причины возникновения приобретенной гипогликемической болезни разделяют на панкреатические, приводящие к развитию абсолютной гиперинсулинемии, и непанкреатические, вызывающие относительное повышение уровня инсулина. Панкреатическая форма болезни встречается при злокачественных или доброкачественных новообразованиях, а также гиперплазии бета-клеток поджелудочной железы. Непанкреатическая форма развивается при следующих состояниях:
Патогенез
Глюкоза является главным питательным субстратом центральной нервной системы и необходима для нормального функционирования головного мозга. Повышенный уровень инсулина, накопление гликогена в печени и торможение гликогенолиза приводит к снижению уровня глюкозы в крови. Гипогликемия вызывает торможение метаболических и энергетических процессов в клетках головного мозга. Происходит стимуляция симпатоадреналовой системы, увеличивается выработка катехоламинов, развивается приступ гиперинсулинизма (тахикардия, раздражительность, чувство страха). Нарушение окислительно-восстановительных процессов в организме приводит к снижению потребления кислорода клетками коры головного мозга и развитию гипоксии (сонливость, заторможенность, апатия). Дальнейший дефицит глюкозы вызывает нарушение всех обменных процессов в организме, увеличение притока крови к мозговым структурам и спазм периферических сосудов, что может привести к инфаркту. При вовлечении в патологический процесс древних структур мозга (продолговатый и средний мозг, варолиев мост) развиваются судорожные состояния, диплопия, а также нарушение дыхательной и сердечной деятельности.
Классификация
В клинической эндокринологии наиболее часто используется классификация гиперинсулинемии в зависимости от причин возникновения заболевания:
Симптомы гиперинсулинизма
Клиническая картина гипогликемической болезни обусловлена понижением уровня глюкозы в крови. Развитие приступа начинается с повышения аппетита, потливости, слабости, тахикардии и ощущения голода. Позже присоединяются панические состояния: чувство страха, тревога, раздражительность, дрожь в конечностях. При дальнейшем развитии приступа отмечается дезориентация в пространстве, диплопия, парестезии (онемение, покалывание) в конечностях, вплоть до возникновения судорог. При отсутствии лечения наступает потеря сознания и гипогликемическая кома. Межприступный период проявляется снижением памяти, эмоциональной лабильностью, апатией, нарушением чувствительности и онемением в конечностях. Частый прием пищи, богатой легкоусвояемыми углеводами, провоцирует увеличение массы тела и развитие ожирения.
В современной практике выделяют 3 степени гиперинсулинизма в зависимости от тяжести течения болезни: легкую, среднюю и тяжелую. Легкая степень проявляется отсутствием симптоматики межприступного периода и органического поражения коры головного мозга. Обострения болезни проявляются реже 1 раза в месяц и быстро купируются медикаментозными препаратами или сладкой пищей. При средней степени тяжести приступы возникают чаще 1 раза в месяц, возможна потеря сознания и развитие коматозного состояния. Межприступный период характеризуется легкими нарушениями поведенческого характера (забывчивость, снижение мышления). Тяжелая степень развивается при необратимых изменениях коры головного мозга. При этом приступы случаются часто и заканчиваются потерей сознания. В межприступном периоде пациент дезориентирован, память резко снижена, отмечается тремор конечностей, характерна резкая смена настроения и повышенная раздражительность.
Осложнения гиперинсулинизма
Осложнения можно условно разделить на ранние и поздние. К ранним осложнениям, возникающим в ближайшие часы после приступа, относят инсульт, инфаркт миокарда вследствие резкого снижения метаболизма сердечной мышцы и головного мозга. В тяжелых ситуациях развивается гипогликемическая кома. Поздние осложнения проявляются спустя несколько месяцев или лет от начала болезни и характеризуются нарушением памяти и речи, паркинсонизмом, энцефалопатией. Отсутствие своевременного диагностики и лечения заболевания приводит к истощению эндокринной функции поджелудочной железы и развитию сахарного диабета, метаболического синдрома, ожирения. Врожденный гиперинсулинизм в 30% случаев приводит к хронической гипоксии головного мозга и снижению полноценного умственного развития ребенка.
Диагностика гиперинсулинизма
Диагностика основывается на клинической картине (потеря сознания, тремор, психомоторное возбуждение), данных анамнеза заболевания (время начала приступа, его связь с приемом пищи). Эндокринолог уточняет наличие сопутствующих и наследственных заболеваний (жировой гепатоз, сахарный диабет, синдром Иценко-Кушинга), после чего назначает лабораторные и инструментальные исследования. Пациенту проводится суточное измерение уровня глюкозы крови (гликемический профиль). При выявлении отклонений выполняют функциональные пробы. Проба с голоданием используется для дифференциальной диагностики первичного и вторичного гиперинсулинизма. Во время теста измеряют С-пептид, иммунореактивный инсулин (ИРИ) и глюкозу в крови. Повышение данных показателей свидетельствует об органическом характере болезни.
Для подтверждения панкреатической этиологии заболевания проводят тесты на чувствительность к толбутамиду и лейцину. При положительных результатах функциональных проб показано УЗИ, сцинтиграфия и МРТ поджелудочной железы. При вторичном гиперинсулинизме для исключения новообразований других органов выполняют УЗИ брюшной полости, МРТ головного мозга. Дифференциальная диагностика гипогликемической болезни проводится с синдромом Золлингера-Эллисона, началом развития сахарного диабета 2 типа, неврологическими (эпилепсия, новообразования головного мозга) и психическими (неврозоподобные состояния, психоз) заболеваниями.
Лечение гиперинсулинизма
Тактика лечения зависит от причины возникновения гиперинсулинемии. При органическом генезе показано хирургическое лечение: частичная резекция поджелудочной железы или тотальная панкреатэктомия, энуклеация новообразования. Объем оперативного вмешательства определяется местоположением и размерами опухоли. После операции обычно отмечается транзиторная гипергликемия, требующая медикаментозной коррекции и диеты с пониженным содержанием углеводов. Нормализация показателей наступает через месяц после вмешательства. При неоперабельных опухолях проводят паллиативную терапию, направленную на профилактику гипогликемии. При злокачественных новообразованиях дополнительно показана химиотерапия.
Функциональный гиперинсулинизм в первую очередь требует лечения основного заболевания, вызвавшего повышенную продукцию инсулина. Всем больным назначается сбалансированная диета с умеренным снижением потребления углеводов (100-150 гр. в сутки). Отдается предпочтение сложным углеводам (ржаные хлебцы, макароны из твердых сортов пшеницы, цельнозерновые крупы, орехи). Питание должно быть дробным, 5-6 раз в день. В связи с тем, что периодические приступы вызывают у пациентов развитие панических состояний, рекомендована консультация психолога. При развитии гипогликемического приступа показано употребление легкоусвояемых углеводов (сладкий чай, конфета, белый хлеб). При отсутствии сознания необходимо внутривенное введение 40 % раствора глюкозы. При судорогах и выраженном психомоторном возбуждении показаны инъекции транквилизаторов и седативных препаратов. Лечение тяжелых приступов гиперинсулинизма с развитием комы осуществляют в условиях реанимационного отделения с проведением дезинтоксикационной инфузионной терапии, введением глюкокортикоидов и адреналина.
Прогноз и профилактика
Профилактика гипогликемической болезни включает в себя сбалансированное питание с интервалом в 2-3 часа, употребление достаточного количества питьевой воды, отказ от вредных привычек, а также контроль уровня глюкозы. Для поддержания и улучшения обменных процессов в организме рекомендованы умеренные физические нагрузки с соблюдением режима питания. Прогноз при гиперинсулинизме зависит от стадии заболевания и причин, вызывавших инсулинемию. Удаление доброкачественных новообразований в 90% случаев обеспечивают выздоровление. Неоперабельные и злокачественные опухоли вызывают необратимые неврологические изменения и требуют постоянного контроля за состоянием пациента. Лечение основного заболевания при функциональном характере гиперинсулинемии приводит к регрессии симптомов и последующему выздоровлению.