Гидроксикоричные кислоты что это
Эхинацея
Что такое эхинацея
и гидроксикоричные кислоты?
Эхинацея пурпурная — это многолетнее растение с запоминающимися розовыми цветками. Родина эхинацеи — восток Северной Америки, однако в настоящее время
ее культивируют во многих странах. Эхинацея пурпурная давно используется в народной медицине для предупреждения гриппа, простудных и инфекционных заболеваний.
В XX веке на эхинацею пурпурную обратили внимание ученые и подтвердили, что она
обладает иммуномодулирующими свойствами и улучшает адаптационные возможности
организма. Сегодня препараты на основе эхинацеи пурпурной широко применяются в традиционной медицине.
Эхинацея, как и все растения, имеет сложный химический состав: флавоноиды, витамины А и С, полисахариды, эфирные масла и т. д. Однако полезное действие эхинацеи обусловлено высоким содержанием в ней гидроксикоричных кислот.
Как действуют гидроксикоричные кислоты?
Чтобы увеличить концентрацию полезных веществ, используют не высушенное растение, а экстракт его наземной части. В экстракте контролируется (стандартизуется) именно содержание гидроксикоричных кислот.
Гидроксикоричные кислоты способствуют формированию адекватного иммунного ответа и поддержанию адаптационного потенциала организма. Они участвуют в подавлении
процессов воспаления, усиливают активность белков, которые должны защищать организм от чужеродных агентов (в том числе микроорганизмов), а также стимулируют поглощение клетками иммунной системы чужеродных частиц, вирусов, бактерий. Гидроксикоричные
коричные кислоты усиливают выработку интерферонов — мощного противовирусного
оружия.
Таким образом, гидроксикоричные кислоты обладают противомикробными свойствами и повышают устойчивость организма к вирусам и бактериям. Такое действие
гидроксикоричных кислот особенно важно во время «сезона простуд», когда риск респираторных инфекций резко возрастает.
Также читайте о пользе и особенностях других действующих веществ препарата Веторон — бета-каротина, витамина С, витамина Е и цинка.
Гидроксикоричные кислоты что это
Urtica L. —род многолетних или однолетних травянистых растений семейства крапивные (Urticaceae). Род включает 45 видов. Наибольшее распространение в России имеют крапива двудомная (Urtica dioica L.), крапива жгучая (Urtica urens L.) и крапива коноплевидная (Urtica cannabina L.) [6]. Urtica cannabina (рис. 1) образует значительные заросли в Европейской части России, в Западной и Восточной Сибири, на Дальнем Востоке.
Рис. 1. Внешний вид крапивы коноплевидной – Urtica cannabina L.
Крапива коноплевидная широко применяется в народной и традиционной медицине при широком спектре заболеваний как поливитаминное, противовоспалительное и детоксикационное средство [9, 13, 14]. В экспериментальной медицине крапива коноплевидная показала противовоспалительную активность [11, 12]. Нашими исследованиями показано, что сухой экстракт крапивы коноплевидной обладает способностью корректировать деструктивные изменения клеток печени мышей при экспериментальной полихимиотерапии [5]. Широкий спектр биологической активности крапивы коноплевидной обусловлен комплексом биологически активных веществ, синтезируемым данным растением. По нашим данным гидроксикоричные кислоты являются одной из основных групп БАВ надземной части Urtica cannabina [3, 4]. В последнее время они стали предметом пристального внимания исследователей с точки зрения проявления широкого спектра биологической активности [1, 8].
Целью данного исследования являлось изучение гидроксикоричных кислот надземной части крапивы коноплевидной.
Материал и методы исследования
Объектами исследования служили образцы надземной части Urtica cannabina, собранные по фазам развития растения, из разных точек ареала. Образцы фиксировались воздушно-теневой сушкой.
Образцы Urtica cannabina L. (надземная часть) взятые для исследования
Характеристика места и времени сбора сырья, фаза развития растения
Республика Бурятия, окрестности села Байкальское, остепненный луг, 28.07.2015 г., фаза цветения
Кемеровская область, окрестности деревни Литвиново, остепненный луг, 15.07.2015 г., фаза цветения
Алтайский край, Алейский район, остепненный луг, 10.07. 2014 г., фаза цветения
Новосибирская область, Ордынский район, окрестности села Красный Яр, 15.07.2015 г., фаза цветения
Там же, 15.05.2015 г., фаза вегетации
Там же, 16.06.2015 г., фаза бутонизации
Там же, 01.07.2015 г., фаза цветения
Там же, 08.09.2015 г., фаза плодоношения
Казахстан, Восточно-Казахская область, окрестности деревни Новоберезовка, остепненный луг, 21.07.2015 г., фаза цветения
Методика получения извлечения: около 1 г сырья (точная навеска), измельченного да частиц размером 1 мм, экстрагируют до истощения спиртом этиловым 50%. Объем объединенных фильтратов замеряют.
Методика анализа компонентного состава гидроксикоричных кислот: состав компонентов суммы гидроксикоричных кислот надземной части Urtica cannabina исследовали методами бумажной хроматографии; бумага «FN-7а», Ленинградская-С (средняя); системы растворителей: кислота уксусная 2%-ная; кислота хлористоводородная : вода очищенная (3 : 97). Для идентификации веществ использовали: характер свечения веществ в УФ-свете до и после обработки хроматограмм раствором натрия гидроксида 10%-ным в спирте этиловом 96%-ном; их окраску после обработки хроматограмм диазотированной кислотой сульфаниловой, величины Rf в сравнении со стандартными (аутентичными) образцами кислот гидроксикоричных [1, 2].
Методика определения содержания гидроксикоричных кислот: количественное содержание гидроксикоричных кислот в надземной части Urtica cannabina определяли прямым вариантом спектрофотометрического метода. Оптическую плотность суммарных извлечений из надземной части Urtica cannabina определяли на приборе СФ-56 при длине волны 326 нм (в пересчете на кислоту хлорогеновую). Извлечение, полученное по вышеописанной методике, помещают в кюветы с толщиной слоя 10 мм и замеряют оптическую плотность. Раствор сравнения – спирт этиловый 50%-ный. При необходимости проводят разведение извлечений. Расчет количественного содержания гидроксикоричных кислот производят с помощью калибровочного графика, построенного по государственному стандартному образцу (ГСО) кислоты хлорогеновой по формуле:
Х = D · V · 100 / K · m · (100 – W),
где V – объем извлечения из надземной части Urtica cannabina, мл; К – коэффициент пересчета, рассчитанный по калибровочному графику, построенному по стандартному веществу (кислоте хлорогеновой); D – оптическая плотность исследуемого раствора; m – масса сырья, г; W – потеря в массе при высушивании сырья, в %.
Построение калибровочного графика. 40 мг (точная навеска) ГСО кислоты хлорогеновой помещают в мерную колбу вместимостью 25 мл, прибавляют 10 мл 40%-ного спирта этилового и перемешивают до растворения кислоты хлорогеновой, затем доводят 40%-ным этанолом до метки. Отбирают по 0,75; 1,0; 1,25; 1,5 и 2,25 мл раствора в мерные колбы вместимостью 25 мл и доводят 40%-ным спиртом этиловым до метки. Оптическую плотность растворов измеряют на спектрофотометре СФ-56 при длине волны 326 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют 40%-ный спирт этиловый. Для построения калибровочного графика (рис. 2) по оси ординат откладывают оптическую плотность, а по оси абсцисс – концентрацию РСО кислоты хлорогеновой в миллиграммах в 1 мл раствора.
Рис. 2. Калибровочный график, построенный по кислоте хлорогеновой
Результаты исследования и их обсуждение
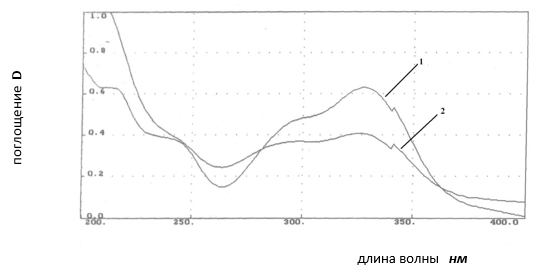
При хроматографическом исследовании суммарных извлечений из надземной части Urtica cannabina обнаружено 7 гидроксикоричных кислот, из которых идентифицированы: феруловая, хлорогеновая, кофейная и транс-коричная кислоты. Состав компонентов данной группы БАВ не изменяется в течение всего вегетационного периода. Вегетативные и генеративные органы надземной части Urtica cannabina (листья, стебли и соцветия) по составу компонентов суммы гидроксикоричных кислот различий не имеют. Географический фактор в пределах территории Сибири не оказывает влияния на качественный состав данной группы веществ. В сумме гидроксикоричных кислот преобладающей является хлорогеновая кислота. Данный факт подтверждает сравнительный визуальный анализ хроматограмм и электронных спектров поглощения ГСО кислоты хлорогеновой и суммарного извлечения из надземной части Urtica cannabina (рис. 3). В связи с этим содержание суммы гидроксикоричных кислот рассчитывали в пересчете на кислоту хлорогеновую.
Рис. 3. Электронные спектры поглощения: 1 – государственный стандартный образец хлорогеновой кислоты, 2 — извлечение из надземной части Urtica cannabina (max = 326 нм)
Анализ зависимости содержания суммы гидроксикоричных кислот в надземной части Urtica cannabina от фазы развития растения (вегетация, бутонизация, цветение и плодоношение) показал, что содержание исследуемой группы веществ в фазе вегетации достигает 1,5% и в течение всего вегетационного периода, по мере роста и развития растения, изменяется незначительно (табл. 2).
Динамика содержания гидроксикоричных кислот в надземной части Urtica cannabina L. в зависимости от фазы развития, местообитания и длины стебля (в %, в пересчете на абсолютно сухое сырье)
Гидроксикоричные кислоты что это
Введение
В настоящее время отмечается широкое распространение вторичных иммунодефицитов, связанных с урбанизацией, химизацией повышенной стрессовой нагрузки. Такие состояния нуждаются в иммунокоррекции, в этой связи актуальной проблемой является поиск новых и использование уже известных лекарственных растений, обладающих иммуномодулирующим действием. Известно, что растительное сырье по-разному влияет на иммунную систему, некоторые из лекарственных растений, обладающих иммунотропным действием, оказывают стимулирующее влияние на иммунный статус, но большинство характеризуются как модуляторы. При этом лекарственные растения и препараты из них нельзя рассматривать как простое органическое вещество. По мере того как фармакологические исследования выявляют новые возможности растений, возрастает необходимость изучения биологически активных соединений и механизма их действия на организм животных и человека [1].
Применение эхинацеи пурпурной, обладающей иммунотропным действием, для лечения больных, страдающих хроническими рецидивирующими заболеваниями на фоне вторичных иммунодефицитов, является весьма перспективным. Эффект лекарственного растения, приводящий к неспецифической стимуляции иммунной системы, может быть использован параллельно с лекарственной терапией, а возможно, и как альтернатива стандартной химиотерапии инфекций [2; 3].
На мировом фармацевтическом рынке представлено множество различных препаратов, содержащих водный и спиртовой экстракт эхинацеи, свежевыжатый и концентрированный соки, настойка и т.д., как монопрепарат или в комбинации [4; 5].
Биологическая активность готовых препаратов эхинацеи зависит от технологических факторов и качества исходного сырья. Известно, что препараты из свежих растений по активности превышают экстракционные препараты из высушенных растений.
Целью представленного фрагмента было изучение состава фенольных соединений в водно-спиртовых извлечениях травы эхинацеи пурпурной в зависимости от камеральной обработки растительного сырья.
Материалы и методы исследования
В качестве объекта исследования использовали надземную часть растения эхинацеи пурпурной (Echinacea purpurea), собранную в фазу цветения в Ботаническом саду Пятигорской ГФА. Собранное сырье подвергали камеральной обработке. Свежее сырье измельчали на измельчителях тканей до кашицеобразного состояния. Часть сырья доводили до сухого состояния высушиванием на воздухе и измельчали до размера частиц, проходящих через сито с отверстиями 3 мм на траворезках лабораторного типа. Экстракционные препараты из подготовленных образцов сырья готовили с использованием стандартных методов экстракции.
Анализ спиртовых извлечений проводили по методике количественного определения гидроксикоричных кислот в препарате Иммунал по НД 42-4501-07 «Иммунал». Изучение качественного и количественного состава гидроксикоричных кислот травы эхинацеи пурпурной проводили методом высокоэффективной жидкостной хроматографии [6].
Гидроксикоричные кислоты что это
Создание фитопрепаратов на основе отечественной растительной сырьевой базы является важной составляющей медицинской науки и практики.
К такой группе растений относится и боярышник. Из официальных 12 видов на территории Российской Федерации, после распада СССР, произрастает 7 видов, сохранившаяся сырьевая база далеко не отвечает запросам фармацевтической промышленности.
Цветки и плоды боярышника в современной медицине используются при функциональных расстройствах сердечной деятельности, ангионеврозах, мерцательной аритмии, параксизмальной тахикардии [6]. Фармакологический эффект при вышеуказанных патологиях определяется суммой биологически активных веществ (БАВ), в которой фенольные соединения, в частности и гидроксикоричные кислоты, занимают одно из основных мест [3, 5].
Разрешенным сырьем боярышника в Российской Федерации являются цветки и плоды [2], Побеги (цветки и листья) боярышника включены в Европейскую (European Pharmacopoeia), Французскую (Pharmacopee Francais), Немецкую (Deutsche Arzneibuch), Швейцарскую (Swiss Pharmacopoeia Ph. Helv), Британскую фармакопеи (Britich Pharmacopoeia) и Американскую травяную фармакопею (American Herbal Pharmacopoeia) [4]. Они присутствуют более чем в 100 зарубежных лекарственных препаратах, главным образом в сосудистых, антиаритмических, кардиотонических, гериатрических группах и препаратах для лечения и профилактики атеросклероза [8].
В Германии боярышник занимает 5-6 позиции по популярности среди лекарственных средств, используемых при сердечно-сосудистых патологиях, в 2002 году препаратов на основе побегов боярышника реализовано на 13,9 млн €, на основе плодов более чем в 2 раза меньше (5-6 млн €) [9].
Ранее мы сообщали при изучении плодов боярышников на присутствие и количественное содержание флавоноидов [1].
Целью нашей работы явилось изучение гидроксикоричных кислот цветков и листьев фармакопейного и нефармакопейных видов боярышника распространенных на территории Центрального Федерального Округа как перспективных источников БАВ, и также с учетом вступления нашей страны в ВТО.
Материалы и методы исследования
Результаты исследования и их обсуждение
Химическими реакциями и хроматографическими методами анализа были обнаружены различные группы фенольных соединений, в том числе и гидроксикоричные кислоты.
Вещества определяли по флуоресценции в УФ-свете до и после обработки аммиака парами, а также по сравнительным значениям Rf и Rs с известными образцами. Фенольные соединения, являющиеся общими для исследуемых объектов, представлены на схеме хроматограммы (рисунок).
Схема общей хроматограммы фенольных соединений исследуемых видов
Качественный состав фенольных соединений цветков колеблется в пределах от 16 до 24, во всех образцах подтверждено наличие кофейной, хлорогеновой, неохлорогеновой и феруловой кислот.
Таблица 1
Спектральная характеристика гидроксикоричных кислот боярышников
Гидроксикоричные кислоты что это
Деятельность по выпуску сетевого издания «Медицина и образование в Сибири» прекращена с связи с перерегистрацией 18.05.2017. Сетевое издание преобразовано в печатное издание «Journal of Siberian Medical Sciences» (ISSN 2542-1174, свидетельство СМИ: ПИ № ФС77-72398 от 28.02.2018).
Рецензируемое научное издание «Journal of Siberian Medical Sciences» выпускается с периодичностью 4 раза в год и публикует научные статьи и обзоры, отражающие достижения в области медицинских наук (14.01.00 Клиническая медицина, 14.03.00 Медико-биологические науки, 14.04.00 Фармацевтические науки).
Рецензируемое научное издание «Journal of Siberian Medical Sciences» включено в базу данных Российского индекса научного цитирования. При расчете показателей публикационной активности и в статистических отчетах используются сводные данные для журнала и его предыдущей версии.
Статьи, предоставленные на опубликование аспирантами, публикуются бесплатно.
Приглашаем к сотрудничеству!
Учредитель: Федеральное государственное бюджетное образовательное учреждение высшего образования «Новосибирский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО НГМУ Минздрава России)
Государственная лицензия ФГБОУ ВО НГМУ Минздрава России
на образовательную деятельность:
серия ААА № 001052 (регистрационный № 1029) от 29 марта 2011 года,
выдана Федеральной службой по надзору в сфере образования и науки бессрочно
Свидетельство о государственной аккредитации ФГБОУ ВО НГМУ Минздрава России:
серия 90А01 № 0003592 (регистрационный № 3376) от 31 марта 2020 года
выдано Федеральной службой по надзору в сфере образования и науки
на срок по 31 марта 2026 года
Адрес редакции: 630091, г. Новосибирск, Красный проспект, д. 52
тел./факс: (383) 229-10-82, адрес электронной почты: mos@ngmu.ru
Выпуск сетевого издания «Медицина и образование в Сибири» (ISSN 1995-0020)
прекращен в связи с перерегистрацией в печатное издание «Journal of Siberian Medical Sciences» (ISSN 2542-1174). Периодичность выпуска — 4 раза в год.
Архивы выпусков «Медицина и образование в Сибири» доступны на сайте с 2006 по 2016 годы, а также размещены в БД РИНЦ (Российский индекс научного цитирования) на сайте elibrary.ru.
Средство массовой информации зарегистрировано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор) —
Свидетельство о регистрации СМИ: ПИ № ФС77-72398 от 28.02.2018.
© ФГБОУ ВО НГМУ Минздрава России, 2021
22.05.2017
Сетевое издание «Медицина и образование в Сибири» преобразовано в печатное издание «Journal of Siberian Medical Sciences». Дата перерегистрации: 18.05.2017. Свидетельство о СМИ: ПИ № ФС 77-69793.
Подробнее >>
03.04.2017
С 2017 года Издательско-полиграфическим центром НГМУ осуществляется выпуск печатного издания «Сибирский медицинский вестник».
Подробнее >>
08.02.2016
Уважаемые авторы! Открыт прием статей во 2-й номер 2016 года (выход номера — середина мая 2016 г.).
Подробнее >>
11.01.2016
Уважаемые авторы! Продолжается прием статей в 1-й номер 2016 года (выход номера — конец февраля 2016 г.).
Подробнее >>
28.12.2015
Уважаемые авторы! Сетевое издание входило в Перечень ВАК до 30 ноября 2015 г. Работа по включению издания в новый Перечень ВАК продолжается.
Информация о формировании Перечня ВАК
Подробнее >>