Гидроксид натрия что это щелочь или кислота
Гидроксид натрия: способы получения и химические свойства
Гидроксид натрия (едкий натр) NaOH — белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 40; относительная плотность для тв. и ж. состояния d = 2,130; tпл = 321º C; tкип = 1390º C;
Способы получения
1. Гидроксид натрия получают электролизом раствора хлорида натрия :
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии натрия, оксида натрия, гидрида натрия и пероксида натрия с водой также образуется гидроксид натрия:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Карбонат натрия при взаимодействии с гидроксидом кальция образует гидроксид натрия:
Качественная реакция
Химические свойства
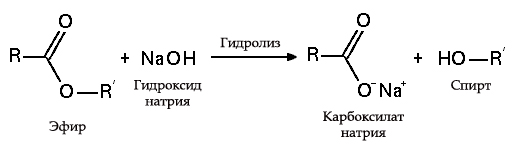
1. Гидроксид натрия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид натрия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид натрия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида натрия:
Сера взаимодействует с гидроксидом натрия только при нагревании:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
Хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксид натрия разлагается при нагревании до температуры 600°С:
2NaOH → Na2O + H2O
NaOH ↔ Na + + OH —
4NaOH → 4Na + O2 + 2H2O
Что такое гидроксид натрия и где мы с ним сталкиваемся в быту
Сегодня хочу рассказать об очередном интересном химическом веществе, с которым мы часто сталкиваемся в быту. Это гидроксид натрия.
Что это такое
По традиции, как было, например, с глауберовой солью или аммиаком, начинаю с названий. Так уже исторически сложилось, что почти у всех химических веществ не одно, а несколько названий. Посмотрите, как по-другому можно назвать гидроксид натрия:
По своему виду это твердые белые кристаллы, которые очень легко впитывают в себя воду, даже ту, которая есть в воздухе, а вместе с ними – и содержащийся в воздухе углекислый газ. Поэтому, если это вещество хранить в открытой или неплотно закрытой таре, то можно в итоге запросто получить бесформенную, расплывшуюся белую массу, которую весьма проблематично будет добыть из этой тары. Особенно если она была стеклянная.
Впрочем, сейчас каустик уже практически не хранят в стеклянной посуде, перешли на пластмассовую. Почему? Потому что он вступает в химическую реакцию со стеклом и разъедает, разрушает его. Естественно, не мгновенно, а при длительном хранении. Это называется выщелачивание стекла – гидроксид натрия взаимодействует с соединениями кремния, которые входят в состав стекла.
Я уже рассказывала, что, когда организуете свою домашнюю лабораторию и делаете раствор гидроксида натрия, то хранить такой раствор нужно в пластиковой бутылке, но никак не в стеклянной.
Что еще нужно знать про физические свойства этого вещества? Оно хорошо растворяется в воде с выделением достаточно большого количества тепла.
Если вдруг захотите потрогать руками (настоятельно не советую!), то обнаружите эффект мыльных рук. Ну а следом за этим – достаточно чувствительные и долго не заживающие ожоги кожи – едкий натр полностью оправдывает это свое название.
В природе это вещество не встречается, его получают в промышленности химическими или электрохимическими способами. Кстати, используется это вещество в достаточно больших количествах – около 60 миллионов тон в год во всем мире. Для чего? Давайте посмотрим.
Применение
Начнем с самого простого – без едкого натра не обойдется ни одно производство мыла. Любого. Хозяйственное, туалетное, банное, детское, гипоаллергенное, антибактериальное, с запахом, без запаха…
Любое мыло, включая самодельное (если оно делается с самого начала, а не из уже готовых компонентов, которые уже прошли эту химическую реакцию), невозможно без гидроксида натрия, это – основной компонент мыла. Поэтому когда я слышу что-нибудь типа «Это – натуральное мыло, в нем нет никакой химии», меня сразу пробивает на смех.
Мыло – это типичный, классический случай применения химии в жизни человека. И, на мой взгляд, далеко не самый плохой и бесполезный.
Следующая довольно обширная область применения едкого натра – в производстве бумаги, картона и различных искусственных волокон и полимеров.
Не отстает от бумажной и текстильная промышленность – гидроксидом натрия обрабатывают хлопок и шерсть.
Само собой разумеется, что без этого интересного и важного вещества не обходится ни одна химическая лаборатория. Это – стандартный и неотъемлемый реактив любой лаборатории.
Это же касается и химической промышленности. Химические свойства гидроксида натрия позволяют его применять и как катализатор, и для нейтрализации различных кислот, и в производстве масел, и многое-многое другое.
В быту это вещество встречается в составе средств для прочистки канализационных труб. Самый простой пример – «Крот», о котором я в свое время много писала. Гидроксид натрия используют здесь именно из-за его высокой химической активности, «агрессивности», способности растворять сильные загрязнения, в том числе жиры и остатки пищи, которые порой скапливаются в кухонных трубах.
Как ни удивительно, не обошлось без него и в пищевой промышленности. Пусть не в таких масштабных количествах, как в том же производстве бумаги или мыла, но и здесь гидроксид натрия на своем месте. Он даже является пищевой добавкой Е524. Его используют в производстве шоколада, какао, мороженого, газированных напитков, карамели, выпечки. Естественно, в очень небольших количествах, но, тем не менее, без него не обойтись.
Еще одна область использования – в автомобильных щелочных аккумуляторах. Правда, не знаю, насколько такие аккумуляторы сейчас востребованы.
Из своей практики помню случай, когда работала в Курчатове, и военные, охранявшие территорию нашего Института, попросили сделать электролит для аккумулятора с плотностью 1,27. Честь возиться с щелочью выпала мне как молодой, только что пришедшей на работу лаборантке.
До сих пор помню, как тщательно растворяла и фильтровала раствор, а потом замеряла ареометром, будто от этого зависела моя жизнь
Что же касается косметологии, то гидроокись натрия напрямую используется для удаления бородавок. Если вы сталкивались с этим, то наверняка можете вспомнить, как покупали маленькие пластиковые флаконы с надписью «Чистотел» или что-то в этом духе. Растение чистотел здесь совершенно не при чем. В пузырьке налит именно раствор гидроксида щелочи. Аккуратно наносишь его на ороговевшую часть кожи и ждешь – а вдруг поможет.
На своем опыте (давно, правда, это было, еще на третьем курсе университета) могу сказать, что действительно помогает, если делать это регулярно.
Кроме того, все шампуни и моющие средства содержат небольшие количества этого вещества. Именно поэтому косметологи рекомендуют после мытья головы шампунем ополаскивать ее слабым раствором яблочного или обычного уксуса – именно для нейтрализации щелочи, содержащейся в шампуни.
Техника безопасности
Гидроксид натрия – сильная щелочь (второй класс опасности), с которой нужно обращаться осторожно, так как она вызывает сильные химические ожоги, а при длительном воздействии – долго не заживающие язвы.
Вот краткие правила по обращению с ним:
Несмотря на то, что это вещество пожаро- и взрывобезопасно, хранить его нужно, как я уже говорила, в пластмассовой таре или пластиковых мешках, герметично запечатанных. Вдали от источников тепла и прямых солнечных лучей. Помещение для хранения должно быть прохладным и сухим.
Если вы решили прочистить дома канализационные трубы и купили для этого специальное средство, то внимательно прочитайте инструкцию к нему. Как правило, в состав этого средства будет входить гидроксид натрия, а в инструкции будет написано, что с ним необходимо работать в резиновых перчатках и избегать вдыхания паров. Думаю, не нужно объяснять, почему?
Итоги
Итак, я рассказала в общих чертах о гидроксиде натрия, который, оказывается, используют не только химики в лабораториях, но с ним мы сталкиваемся и в быту.
О химических свойствах предлагаю поговорит в следующей статье. Заодно я расскажу и покажу несколько опытов, которые вы легко сможете сделать самостоятельно.
Надеюсь, вам понравилась моя статья. Рассказывайте в комментариях свои случаи из жизни, дополняйте или поправляйте меня, если с чем-то не согласны. Надеюсь, вам, как и мне, всегда интересно узнавать что-то новое.
До встречи в следующей статье!
Едкий натр
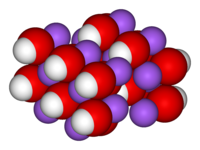
каустическая сода,
едкая щелочь
— 52,2 (20 °C) г/100 мл
Гидроксид натрия лат. Natrii hydroxidum ; другие названия — каустическая сода, каустик, едкий натр, едкая щёлочь. Самая распространенная щёлочь, химическая формула NaOH. В год в мире производится и потребляется более 57 миллионов тонн едкой щёлочи. Гидроксид натрия также используется для мойки пресс-форм автопокрышек, называется Mold Cleaner фирмы «NALCO». Интересна история тривиальных названий как гидроксида натрия, так и других щелочей, название «едкая щёлочь» обусловлено свойством разьедать кожу, бумагу, стекло и вызывать сильные ожоги. До XVII века, щёлочью (фр. alkali) называли также карбонаты натрия и калия. В 1736 французский учёный А. Л. Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой (по растению Salsola Soda, из золы которого её добывали), а карбонат калия — поташем. В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.
Содержание
Физические свойства
ΔH 0 растворения для бесконечно разбавленного водного раствора —44,45 кДж/моль.
Из водных растворов при 12,3 — 61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления 65,1 °C; плотность 1,829 г/см³; ΔH 0 обр −734,96 кДж/моль), в интервале от —28 до —24°С — гептагидрат, от —24 до —17,7°С — пентагидрат, от —17,7 до —5,4°С —тетрагидрат (α-модификация), от —5,4 до 12,3 °C. Растворимость в метаноле 23,6 г/л (t=28 °C), в этаноле 14,7 г/л (t=28 °C). NaOH·3,5Н2О (температура плавления 15,5 °C);
Химические свойства
Гидроксид натрия (едкая щёлочь)— сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочно-земельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкий калий), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдает электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в ряду электрохимической активности металлов, в котором за ноль принята активность водорода.
Гидроксид натрия вступает в реакции:
1.Нейтрализации с различными веществами в любых агрегатных состояниях, от растворов и газов до твердых веществ:
так и с растворами:
(Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора — тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.)
(2) H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
2. Обмена с солями в растворе:
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе. Его и используют, в частности, для очистки воды от мелких взвесей.
например, с фосфором — с образованием гипофосфита натрия:
4. С металлами: Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксиалюмината натрия и водорода:
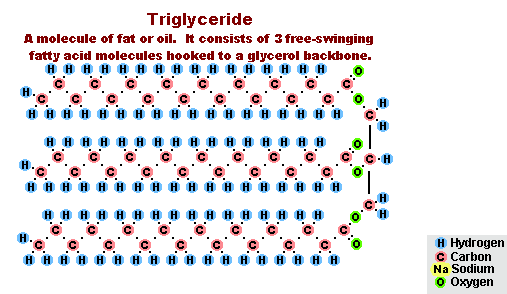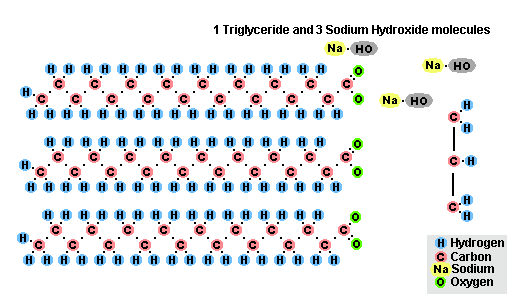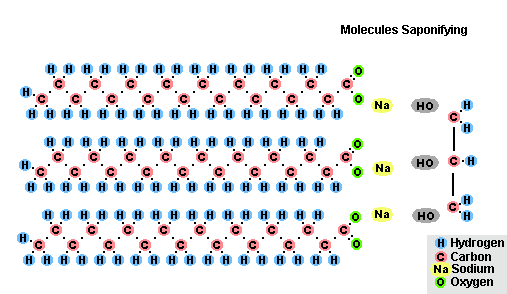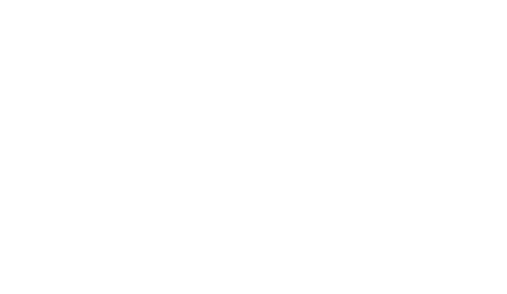
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла, в зависимости от состава жира.
6. С многоатомными спиртами — с образованием алкоголятов:
7. Со стеклом: в результате длительного воздействия горячей гидроокиси натрия поверхность стекла становится матовой (выщелачивание силикатов):
Качественное определение ионов натрия возможно несколькими способами
1. По цвету пламени горелки — ионы натрия придают пламени жёлтую окраску:
2. С использованием специфических реакций на ионы натрия:
| Реагент | Фторид аммония | Нитрит цезия-калия-висмута | Ацетат магния | Ацетат цинка | Пикро- | ||
|---|---|---|---|---|---|---|---|
| Цвет осадка | белый | бледно-жёлтый | жёлто-зеленый | желто-зеленый | белый | белый | бледно-жёлтый |
Способы получения
Промышленные способы получения
В промышленном масштабе гидроксид натрия получают электролизом растворов галита (каменная соль NaCl) с одновременным получением водорода и хлора:
Едкие щёлочи, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом. Для некоторых производств это важно. Так, в производстве искусственных волокон можно применять только каустик, полученный при электролизе с жидким ртутным катодом. В мировой практике используются все три метода получения хлора и каустика, при явной тенденции в сторону увеличения доли мембранного электролиза. В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Эффективность процесса производства рассчитывается не только по выходу едкого натра, но и по выходу хлора и водорода, получаемых при электролизе, соотношение хлора и гидроксида натрия на выходе 100/110, реакция протекает в следующих соотношениях:
1,8 NaCl + 0, 5 H2O + 2,8 МДж = 1,00 Cl2 + 1,10 NaOH + 0,03 H2,
Основные показатели различных методов производства даны в таблице:
Технологическая схема электролиза с твёрдым катодом
Диафрагменный метод — Полость электролизёра с твёрдым катодом разделена пористой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом [1]. В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита. В результате электрохимического процесса на аноде за счет разложения галита выделяется хлор, а на катоде за счет разложения воды — водород. Хлор и водород выводятся из электролизёра раздельно, не смешиваясь:
При этом прикатодная зона обогащается гидроксидом натрия. Раствор из прикатодной зоны, называемый электролитическим щёлоком, содержащий неразложившийся анолит и гидроксид натрия, непрерывно выводится из электролизёра. На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до 42—50 % в соответствии со стандартом. Галит и сульфат натрия при повышении концентрации гидроксида натрия выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или на стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией. Кристаллический галит (обратную соль) возвращают на электролиз, приготавливая из неё так называемый обратный рассол. Из него во избежание накапливания сульфата в растворах перед приготовлением обратного рассола извлекают сульфат. Убыль анолита возмещают добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов или растворением твёрдого галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния. Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Мембранный метод — аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной мембраной. Мембранный электролиз обеспечивает получение наиболее чистого каустика.
который отводится из электролизёра, а на ртутном катоде образуется слабый раствор натрия в ртути, так называемая амальгама:
Амальгама непрерывно перетекает из электролизёра в разлагатель. В разлагатель также непрерывно подаётся хорошо очищенная от примесей вода. В нем амальгама натрия в результате самопроизвольного электрохимического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Полученный таким образом раствор каустика, являющийся товарным продуктом, не содержит примеси галита, вредной в производстве вискозы. Ртуть почти полностью освобождается от амальгамы натрия и возвращается в электролизер. Водород отводится на очистку. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесенные с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают двух- или трёхступенчатым процессом растворённый в нём хлор.
Лабораторные способы получения
В лаборатории гидроксид натрия получают химическими способами, которые имеют больше историческое, чем практическое значение.
В результате реакции образуется раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % NaOH. Расплавленный NaOH разливают в железные барабаны, где он застывает.
Ферритный способ описывается двумя реакциями:
(1) — процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек-феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции (2); получается раствор гидроксида натрия и осадок Fe2O3, который после отделения его от раствора возвращается в процесс. Раствор содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % NaOH.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество топлива, получаемый едкий натр загрязнен примесями, обслуживание аппаратов трудоемко. В настоящее время эти методы почти полностью вытеснены электрохимическим способом производства.
Гидроксид натрия — распространенная и полезная щелочь
Данный реактив, самая распространенная щелочь, более известен 
Важные особенности гидроксида натрия
Их важно знать, чтобы работа с этим реактивом была безопасной, и чтобы его применение принесло ожидаемые результаты.
Основные сферы применения едкого натра
Техника безопасности в работе с гидроксидом натрия
По ГОСТ 12.1.007-76 каустическая сода относится ко II классу токсичности (высокоопасна). Может вызвать сильный ожог кожи и слизистых, необратимое повреждение зрения при попадании в глаза. Именно поэтому работать с ней нужно в перчатках и защитных очках, использовать специальную одежду с виниловой пропиткой или прорезиненную.
При попадании вещества на слизистую ее как можно скорее нужно промыть большим количеством проточной воды, кожу промыть слабым раствором уксуса.
При большой поверхности ожога, при попадании реактива внутрь или в глаз следует не только приянть эти меры, но и незамедлительно обратиться к врачу.
Вы можете купить щелочь гидроксид натрия в нашем магазине, и мы надеемся, что вы будете соблюдать технику безопасности. Товар продается с доставкой, поэтому вы можете купить щелочь в Москве или другом городе России и вскоре получить его в своем городе.