Гидроген пероксид что это
Перекись водорода: помощь или вред?
Перекись водорода была впервые получена химиком Луисом Тенеро в 1818 году и уже очень скоро стала применяться в промышленности. Сейчас ее повсеместно используют в хозяйстве и быту.
1 Что такое перекись водорода: химическая формула и свойства
Перекись водорода это простейший представитель пероксидов. Он представляет собой прозрачную жидкость со своеобразным металлическим вкусом и слабым запахом, способную неограниченно растворяться в спирте, воде и эфире.
Химическая формула

Химические свойства
При взаимодействии с определенными металлами, такими например, как Mn или Fe, происходит активная химическая реакция
Распад вещества быстрее происходит в щелочной среде, кислотная же среда наоборот замедляют процесс. Именно поэтому в раствор часто добавляют фосфорную кислоту. В термических условиях H2O2 быстро разлагается, поэтому не рекомендуется хранить его на свету.
Пероксид водорода хорошо смешивается с C2H5OH (спиртом) и H2O (водой) в любых пропорциях.
Реакция распада перокисда водорода
Кислотная среда более подходящаая среда для распада. Щелочная же более подходит для восстановления
Пример реакции восстановления мы можем наблюдать при взаимодействии H2O2 с серебром
Аналогично, по существу, протекает его взаимодействие с озоном (О3 + Н2О2 = 2 Н2О + 2 О2) и с перманганатом калия в кислой среде:
Последняя реакция применяется для количественного определения пероксида водорода.
2 Основные лечебные свойства
3 Способы применения
Уже многие годы перекись водорода используется в различных областях применения благодаря своей эффективности и доступности. Его применение основывается в первую очередь на его окисляющих свойствах.
В традиционной медицине
В косметологии
Препарат используется на коже, склонной к излишней жирности и появлению акне, черных точек, благодаря способности уничтожать возбудителей инфекции. Для этого 5 капель 3% раствора добавляют к 50 мл тоника. Косметологи советуют его наносить не более 2 раз в неделю.
Людям с веснушками и пигментными пятнами вещество также подойдет за счет его отбеливающего свойства. Чтобы провести процедуру, применяют специальные маски. Взять ст. л. 20% творога, сырой желток и 5 капель перекиси. Все ингредиенты перемешиваются до однородной структуры, а затем кисточкой наносятся на кожный покров. Слегка массируют, оставляя маску на 15 мин. По истечении времени масса смывается, а на лицо накладывают увлажняющий крем.
Применение в быту
Благодаря полезным свойствам Н2О2 можно не только устранить желтые пятна, разводы с белой материи и удалить налет на кафельной плитке, но и избавиться от грибка и плесени.
Чтобы почистить плитку в ванной комнате, взять 40 мл пероксида, ч. л. жидкого мыла и полстакана пищевой соды. Компоненты хорошо перемешать и нанести на влажную губку, которой оттереть проблемные участки. Если загрязнений много, нужно оставить массу на 10 минут, чтобы они растворились.
Для очистки материала берут 3% раствор, который вливают на пятна. Оставляют на 20-30 минут, а затем смывают с поверхности.
Перекись водорода в народной медицине
4 Польза или вред?
Если человек хорошо переносит пероксид и правильно им пользуется, он не должен вызвать каких-либо неблагоприятных последствий.
Нельзя употреблять вещество внутрь, это опасно появлением отравления. При полоскании рта иногда теряется чувствительность языка и могут гипертрофироваться его сосочки.
Также не стоит использовать при наличии у человека индивидуальной непереносимости. Это может повлечь за собой развитие аллергической реакции.
5 Форма выпуска и возможные противопоказания препарата
Изготавливается в виде 3% раствора для наружного местного нанесения.
6 Метод Неумывакина: что это?
Это лечение с успехом применяется в нетрадиционной медицине. Профессор Неумывакин считал перекись панецеей от всех заболеваний. Принцип действия он объяснял укрепляющим эффектом лекарства: при взаимодействии с кровью и ферментом каталазой оно распадается до воды и кислорода, который разжижает кровь, нормализует обменные процессы и улучшает деятельность органов и систем.
Если ожидаемый эффект не достигался, профессор считал, что организм чрезмерно зашлакован. Поэтому он рекомендовал проводить полную очистку.
Метод не признан официальной медициной, так как его противники утверждают, что перекись не только неэффективна, но и может причинить опасность при использовании не по назначению.
В нашей следующей статье мы поговорим об особенностях применения каустической соды.
Перекись водорода
Перекись водорода – незаменимый антисептик
Понятие и особенности

История появления
Перекись водорода появилась в начале XIX века, ее открыл практически в чистом виде химик Луис Тенар (Франция, 1818 год) в результате химической реакции пероксида бария с серной кислотой. В те времена она называлась «окисленной водой». Промышленное производство пероксида по методу французского химика началось полвека спустя (Берлин, 1873 год), но срок годности его был довольно короткий, поэтому его должны были использовать почти сразу же после получения. Широкое применение пероксид водорода нашел лишь 100 лет спустя, когда советский ученый Волькенштейн открыл его в безопасном виде.
Перекись водорода применялась во время Второй Мировой войны при изготовлении военной техники. Также, в зависимости от концентрации, начала использоваться в промышленных целях (например, в качестве отбеливающего средства), в фармакологии (антисептик).
Применением перекиси водорода в лечебных целях занимался в начале прошлого века американский врач Уильям Дуглас, после чего она стала широко применяться в медицине.
Применение
На сегодняшний день данный химический реактив, благодаря своим окислительным свойствам, нашел свое применение практически во всех областях промышленности:
— в целлюлозно-бумажной (для отбелки механических и химических масс, для изготовления бумаги);
— в текстильной (в качестве отбеливателя различных тканей, мехов);
— в химической (в качестве окислителя);
— в горнодобывающей (для добычи золота, урана);
— в нефтедобывающей и нефтеперерабатывающей;
— в сельском хозяйстве (для обработки сельскохозяйственных культур);
— в рыбном хозяйстве (для лечения рыб);
— в пищевой (для дезинфекции и стерилизации);
— в косметологии (как очищающее и отбеливающее средство, для приготовления краски для волос);
— в стоматологии (для отбеливания зубов);
— в быту (для поддержания чистоты);
— в ракетно-космической промышленности (для изготовления ракетного топлива);
— в медицине и фармакологии.
Применение перекиси водорода в медицине
Несмотря на вышеупомянутый перечень отраслей, перекись водорода нашла свое самое большое применение в медицине, особенно в хирургии, как антисептическое, дезинфицирующее, дезодорирующее средство.
Перекись может быть использована как наружно, так и внутренне, но самый безопасный и эффективный способ применения– это наружное. Для внутреннего применения в качестве профилактики от многих болезней используют только слабоконцентрированный 3% раствор перекиси и не более одного раза в день.
В медицине перекись используют при лечении:
— аллергии;
— хронического бронхита;
— герпеса;
— гипертонии;
— гриппа;
— инсульта;
— опухолей (также и злокачественных);
— болезни Паркинсона;
— артроза;
— рассеянного склероза;
— болезней кожи;
— чесотки;
— кариеса;
— невралгии и многое др.
Перекись водорода является незаменимым антисептиком при чистке крови, а также для лечения инфекционных заболеваний.
Опасно! Несмотря на то, что перекись водорода нетоксичена и неопасна, при попадании концентрированного раствора на кожу, слизистую оболочку глаз или дыхательные пути может вызвать ожог. Первая помощь – промыть обильно холодной водой и обратиться к врачу. Следует помнить, что самолечение перекисью водорода может быть опасно для здоровья.
Купить перекись водорода
Магазин химических реактивов в Москве розница “Prime Chemicals Group” – это огромный выбор лабораторного оборудования и химических реактивов по доступным ценам. Купить перекись водорода 37% под заказ или перекись водорода цена (50%) всего за 52 руб.
Пероксид водорода
| Пероксид водорода | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Плотность | 1.4 г/см³ |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия образования (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная |
| Классификация | |
| Рег. номер CAS | 7722-84-1 |
| SMILES | OO |
| Регистрационный номер EC | 231-765-0 |
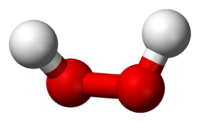
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
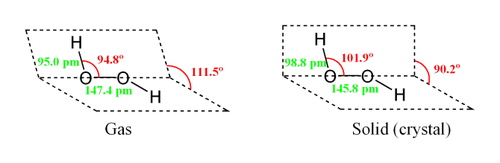
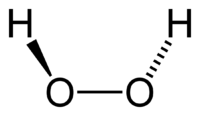
Молекула пероксида водорода имеет следующее строение:
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7·10 −29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Содержание
Химические свойства
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обуславливает способность пероксидов выступать как в роли окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:

При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до кислорода:
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на H2O и O2.Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4·10 −12 ), и поэтому диссоциирует по двум ступеням:
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):

Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
В реакции с нитритом калия соединение служит окислителем:
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидисерная H2S2O8 кислоты.
Окислительно-восстановительные свойства
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако, несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получают в промышленности при реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
Ценным побочным продуктом этой реакции является ацетон.
В промышленных масштабах пероксид водорода получают электролизом серной кислоты, в ходе которого образуется надсерная кислота, и последующим разложением последней до пероксида и серной кислоты.
В лабораторных условиях для получения пероксида водорода используют реакцию:
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
Хотя разбавленные растворы перекиси водорода применяется для небольших поверхностных ран, исследования показали что этот метод обеспечивая антисептический эффект и очищение и удлиняет время заживления. [1] [2] Обладая хорошими очищающими свойствами, перекись водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также удлинять время заживления из-за повреждения прилегающих к ране клеток. [3] Более того, перекись водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи. [4] Однако, в качестве средства для очистки глубоких ран сложного профиля, гнойных затеков, флегмон, и других гнойных ран санация которых затруднена, перикись водорода остается препаратом выбора. Так как она обладает не только антисептическим эффектом, но и продуцирует большое количество пены, при взаимодействии с ферментом пероксидазой. Что в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые буду легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки перекисью водорода, антисептический раствор не сможет удалить данные патологические образования, что приведет значительному увеличению времени заживления раны, и ухудшит состояние больного.
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, получившихся при взаимодействии перманганата калия «марганцовки» с предметами (ввиду его окислительных свойств).
Пероксид водорода в аквариумистике
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме (гидры, планарии, паразиты, водоросли, бактерии и др.)
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл. [7]
Пероксид водорода
Из Википедии — свободной энциклопедии
наименование
(при 20 °C)

Перокси́д водоро́да (пе́рекись водоро́да), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2∙2H2O.
Молекула пероксида водорода имеет следующее строение:
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7⋅10 −29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
- Мыть посуду во сне к чему снится женщине замужней
- Минимальная продолжительность сна без вреда здоровью