Гетерозиготная мутация что это значит у женщин простыми словами
Генетическое обследование
Сегодня генетическое обследование применяют в случае наличия вероятности появления какого-то генетического нарушения в семье. Данное тестирование приемлемо лишь в том случае, если структура генетического наследования нарушения достаточно изучена, возможно эффективное лечение и использованы достоверные, надежные, высокочувствительные, безвредные и специфические методики исследования. В определенном поколении преобладание должно быть весьма высоким для оправдания тех усилий, которые будут затрачены на проведение теста. Целью генетического тестирования может быть идентификация гетерозиготного носителя гена рецессивного нарушения, однако при этом не выражающего его (к примеру, у евреев ашкенази болезнь Тея-Сакса, у негров серповидно-клеточная анемия, талассемия у определенных этнических групп). Когда гетерозиготной парой выступает также гетерозигота, семья находится в зоне риска рождения нездорового ребенка.
Когда нужен тест?
Исследование может быть необходимо до того, как проявится симптоматика в том случае, когда в истории семьи была мажорирована наследовавшаяся патология, которая проявляется в более позднем возрасте (к примеру, рак молочной железы, болезнь Хантингтона). Тест определяет уровень риска развития нарушения, следовательно, человек в будущем сможет принять превентивные меры. Когда тест продемонстрировал, что человек выступает носителем нарушения, тогда он тоже может принимать решения, которые касаются рождения потомства.
Предродовой тест также может включать амниоцентез, исследование крови пуповины, взятие пробы ворсин хориона, обследование материнской крови, тест эмбрионального воплощения или материнской сыворотки. Распространенные причины для предродового обследования это:
Обследование новорожденного дает возможность осуществить профилактику (специальную диету или терапию замены) галактозного диабета, фенилпировиноградной олигофрении, а также гипотиреоза.
Также текст сегодня используют для создания семейной генеалогии. В современной генетической консультации широко используется создание семейной генеалогии (генеалогическое древо). При этом применяются условные символы, которые обозначают членов семьи и дают необходимые данные о состоянии их здоровья. Определенные семейные нарушения с похожими фенотипами обладают несколькими моделями наследования.
Митохондриальные нарушения ДНК
В митохондрии содержится уникальная округлая хромосома, которая несет информацию о тринадцати протеинах, разных РНК, а также нескольких регулятивных ферментах. Но данные о более чем 90 процентов митохондриальных протеинов есть в ядерных генах. У каждой клетки в составе есть несколько сотен митохондрий в собственной цитоплазме.
Митохондриальные нарушения часто проистекают от митохондриальных патологий или патологий ядерных ДНК (к примеру, разрушений, мутаций, дупликаций). Ткани высокой энергии (к примеру, мускулы, мозг, сердце) располагаются в зоне особенного риска нарушения функций из-за митохондриальных аномалий.
Митохондриальные патологии проявляются при множестве распространенных нарушений, к примеру, при определенных видах болезни Паркинсона (которые способны спровоцировать сильные митохондриальные делеционные мутации в тканях подкорковых узлов) и множестве других видов нарушений функционирования мышц.
Патологии митохондрии ДНК определяют наследованием со стороны матери. Митохондрии все наследуются от цитоплазмы яйцеклетки, по этой причине все потомство нездоровой матери пребывает в зоне риска наследования нарушений, однако при этом какой-либо риск наследования нарушения от больного отца отсутствует. Разнообразие клинических проявлений выступает правилом, которое способно объясняться частично вариативностью сочетаний наследованных мутаций и нормальных клеток и тканей.
Дефект одного гена
Генетические расстройства, вызванные нарушением лишь в одном гене (так называемые «менделевские нарушения»), наиболее простые для анализа и самые полно изученные на сегодняшний день. Наукой описано множество специфических нарушений подобного рода. Патологии одного гена бывают аутосомными, или сцепленными с X-хромосомой, рецессивными или доминантными.
Доминантный аутосомный признак
Лишь одна аутосомная аллель гена нужна, чтобы выразить аутосомные доминантные черты; это означает, что происходит поражение гомозиготы и гетерозиготы аномального гена.
В данном случае применимы такие правила:
1. Мужчина и женщина подвержены одинаковому риску появления болезни.
2. У больного человека будет больной родитель.
3. Здоровый ребенок больного родителя не передает черту своему потомку.
4. Здоровый родитель и гетерозиготный больной родитель обладают, в среднем, одинаковым количеством здоровых и больных детей; это означает, что вероятность развития заболевания составляет 50 процентов для каждого потомка.
Аутосомный рецессивный признак
Чтобы выразить аутосомную рецессивную черту необходимо наличие двух копий аномальной аллели. У определенных поколений процент гетерозиготных носителей является высоким по причине эффекта инициатора (то есть была начата группа несколькими людьми, из которых один был носителем) либо вследствие того, что носители обладают селективным преимуществом (к примеру, гетерозиготность в случае серповидно-клеточной болезни служит защитой от малярии).
В данном случае применимы такие правила наследования:
Когда у здоровых родителей был рожден больной ребенок, оба родителя являются гетерозиготными носителями и, в среднем, один из 4х их потомков будет болен, один из 2х гетерозиготный, а один из 4х– здоровым.
В среднем, половина детей больного человека, а также один гетерозиготный носитель подвержены заражению, в треть является гетерозиготными носителями.
Все дети двух больных родителей будут больны.
Женщины и мужчины в одинаковой степени подвержены риску заражения.
Гетерозиготные носители фенотипически нормальны, однако выступают проводниками черты. Когда черта порождена дефектом специфического белка (к примеру, энзимы), обычно гетерозиготный человек имеет ограниченное количество этого белка. Когда нарушение известно, с помощью генетических молекулярных приемов возможно проведение идентификации гетерозиготных носителей.
Родственники скорее прочих унаследуют такую же мутантную аллель, поэтому браки между близкими родственниками сильно увеличивают вероятность рождения больных детей. У пары брат-сестра или родитель-ребенок вероятность родить нездорового ребенка возрастает за счет наличия 50 процентов одинаковых генов.
Что такое синдром Жильбера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, врача общей практики со стажем в 14 лет.
Определение болезни. Причины заболевания
Краткое содержание статьи — в видео:
Синонимы названия болезни: простая семейная холемия, конституциональная или идиопатическая неконъюгированная гипербилирубинемия, негемолитическая семейная желтуха.
По распространённости данное заболевание встречается не менее, чем у 5 % населения, в соотношении мужчин и женщин — 4:1. Впервые заболевание описал французский терапевт Августин Жильбер в 1901 году.
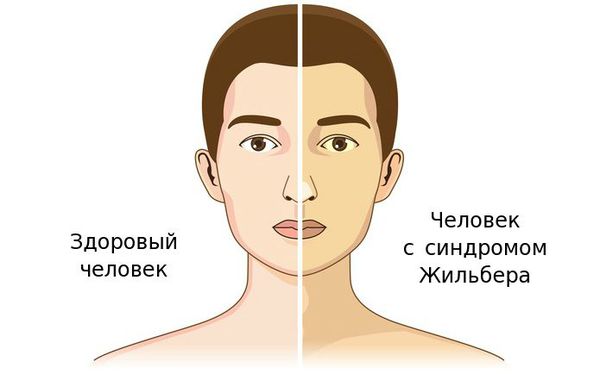
Чаще синдром Жильбера проявляется в период полового созревания и характеризуется доброкачественным течением. Основным проявлением этого синдрома является желтуха.
К провоцирующим факторам проявления синдрома можно отнести:
Причина заболевания — генетический дефект фермента УДФГТ1*1, который возникает в результате его мутации. В связи с этим дефектом функциональная активность данного фермента снижается, а внутриклеточный транспорт билирубина в клетках печени к месту соединения свободного (несвязанного) билирубина с глюкуроновой кислотой нарушается. Это и приводит к увеличению свободного билирубина.
Симптомы синдрома Жильбера
Некоторые специалисты трактуют синдром Жильбера не как болезнь, а как физиологическую особенность организма.
До периода полового созревания данный синдром может протекать бессимптомно. Позже (после 11 лет) возникает характерная триада признаков:
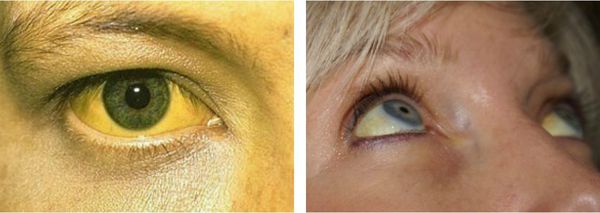
Желтуха чаще всего проявляется иктеричностью (желтушностью) склер, матовой желтушностью кожных покровов (особенно лица), иногда частичным поражением стоп, ладоней, подмышечных впадин и носогубного треугольника.
Заболевание нередко сочетается с генерализованной дисплазией (неправильным развитием) соединительной ткани.
Усиление желтухи может наблюдаться после перенесения инфекций, эмоциональной и физической нагрузки, приёма ряда лекарственных препаратов (в частности, антибиотиков), голодания и рвоты.
Клиническими проявлениями заболевания общего характера могут быть:
В отношении ЖКТ синдром Жильбера проявляется снижением аппетита, изменением привкуса во рту (горечь, металлический привкус), реже возникает отрыжка, тяжесть в области правого подреберья, иногда наблюдается боль ноющего характера и плохая переносимость лекарственных препаратов.
При ухудшении течения синдрома Жильбера и существенном повышении токсичной (свободной) фракции билирубина может появляться скрытый гемолиз, усиливая при этом гипербилирубинемию и добавляя в клиническую картину системный зуд.
Патогенез синдрома Жильбера
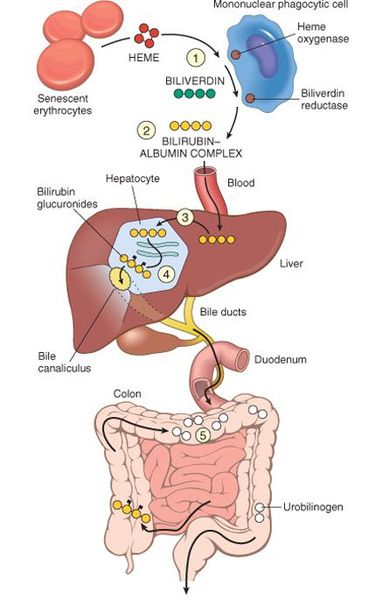
В норме свободный билирубин появляется в крови преимущественно (в 80-85 % случаев) при разрушении эритроцитов, в частности комплекса ГЕМ, входящего в структуру гемоглобина. Это происходит в клетках макрофагической системы, особенно активно в селезёнке и купферовских клетках печени. Остальная часть билирубина образуется из разрушения других гемсодержащих белков (к примеру, цитохрома P-450).
У взрослого человека в сутки образуется приблизительно от 200 мг до 350 мг свободного билирубина. Такой билирубин слаборастворим в воде, но при этом хорошо растворяется в жирах, поэтому он может взаимодействовать с фосфолипидами («жирами») клеточных мембран, особенно головного мозга, чем можно объяснить его высокую токсичность, в частности токсичное влияние на нервную систему.
Первично после разрушения комплекса ГЕМ в плазме билирубин появляется в неконъюгированной (свободной или несвязанной) форме и транспортируется с кровью при помощи белков альбуминов. Свободный билирубин не может проникнуть через почечный барьер за счёт сцепления с белком альбумином, поэтому сохраняется в крови.
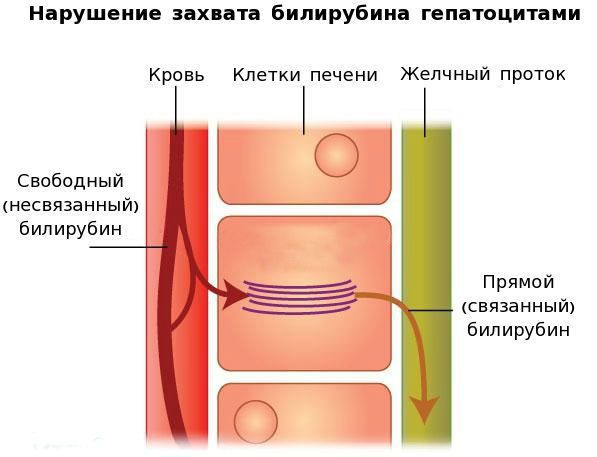
В печени несвязанный билирубин переходит на поверхность гепатоцитов. С целью снижения токсичности и выведения в клетках печени свободного билирубина при помощи фермента УДФГТ1*1 он связывается с глюкуроновой кислотой и превращается в конъюгированный (прямой или связанный) билирубин. Конъюгированный билирубин хорошо растворим в воде, он является менее токсичным для организма и в дальнейшем легко выводится через кишечник с желчью.
При синдроме Жильбера связывание свободного билирубина с глюкуроновой кислотой снижается до 30% от нормы, тогда как концентрация прямого билирубина в желчи увеличивается.
В основе синдрома Жильбера лежит генетический дефект — наличие на промонторном участке A(TA)6TAA гена, кодирующего фермент УДФГТ1*1, дополнительного динуклеотида ТА. Это становится причиной образования дефектного участка А(ТА)7ТАА. Удлинение промонторной последовательности нарушает связывание фактора транскрипции IID, в связи с чем уменьшается количество и качество синтезируемого фермента УДФГТ1, который участвует в процессе связывания свободного билирубина с глюкуроновой кислотой, преобразуя токсичный свободный билирубин в нетоксичный связанный.
Вторым механизмом развития синдрома Жильбера является нарушение захвата билирубина микросомами сосудистого полюса клетки печени и его транспорта глутатион-S-трансферазой, которая доставляет свободный билирубин к микросомам клеток печени.
Классификация и стадии развития синдрома Жильбера
Общепринятой классификации синдрома Жильбера не существует, однако условно можно разделить генотипы синдрома по полиморфизму.
Что такое MTHFR?
У людей есть две копии гена MTHFR, каждый из которых наследуется от одного из родителей. Мутации в них могут быть гетерозиготными или гомозиготными.
Существует два распространенных типа или варианта мутации MTHFR: C677T и A1298C.
Мутации в генах MTHFR встречаются примерно у 25% людей испаноязычного происхождения и у 10–15% людей европейского происхождения.
Эти мутации часто приводят к высоким уровням гомоцистеина в крови, что может способствовать возникновению многих патологий, таких как:
· врожденные пороки развития;
· расстройства психического здоровья;
· определенные виды рака.
В этой статье мы рассмотрим мутации MTHFR более подробно, включая сопряженные с ними состояния, диагностику и способы лечения. Мы также обсудим, как мутации MTHFR могут повлиять на беременность.
Состояния, связанные с мутацией MTHFR
Мутации в гене MTHFR могут повлиять на метаболизм метионина и гомоцистеина, что может привести к неблагоприятным последствиям для здоровья.
Состояния, которые исследователи связывают с мутациями гена MTHFR, включают:
· сколиоз – аномальное искривление позвоночника;
· анемия, что означает, что у человека низкий уровень эритроцитов;
· сердечно-сосудистые заболевания, такие как тромбозы, инсульты и инфаркт миокарда;
· расстройства психического здоровья и поведения, такие как депрессия и синдром дефицита внимания и гиперактивности (СДВГ).
Возможные признаки и симптомы
Симптомы различаются как у отдельных людей, так и в зависимости от типа мутации. Люди обычно не знают, что они являются носителями мутации MTHFR, если они не испытывают серьезных симптомов или не проходят генетическое тестирование.
Наличие одной или двух мутаций MTHFR может немного увеличить уровни гомоцистеина, присутствующего в крови или моче. Это состояние называется гомоцистинурия.
Симптомы гомоцистинурии вследствие мутаций MTHFR включают в себя:
· патологии свертывания крови;
· онемение или покалывание в руках и ногах.
Врач может заподозрить, есть ли у человека мутации гена MTHFR, просмотрев его историю болезни, учитывая его текущие симптомы и выполнив медицинский осмотр. Врач может порекомендовать провести анализ крови, чтобы проверить уровень гомоцистеина.
Хотя можно идентифицировать мутацию гена MTHFR с помощью генетического тестирования, такие организации, как Американская кардиологическая ассоциация и Американский конгресс акушеров-гинекологов, не рекомендуют проводить скрининг на распространенные варианты генов MTHFR.
Медикаментозное лечение не всегда необходимо при наличии вариантов MTHFR. Изменения в питании и образе жизни зачастую способны компенсировать любые возникающие в результате дефициты питательных веществ.
Однако людям может потребоваться медицинское лечение, если у них высокий уровень гомоцистеина. Врач может предложить людям с повышенным уровнем гомоцистеина принимать следующие добавки:
Ген MTHFR регулирует, как организм обрабатывает фолат, аминокислоту в животных белках, и другие витамины группы В. Употребление пищи, богатой фолатом, может помочь купировать симптомы, вызванные мутациями MTHFR.
Богатые фолатом продукты включают в себя:
· животные и растительные белки, такие как говядина, яйца, бобы, горох и чечевица;
· овощи, в том числе шпинат, спаржа, брюссельская капуста и брокколи;
· фрукты, такие как банан, дыня, папайя и авокадо;
· обогащенные зерна, которые включают в себя рис, муку и зерновые.
Исследователям еще предстоит определить преимущества добавок фолиевой кислоты для лечения людей с мутациями MTHFR.
Влияние на беременность
Женщины с положительным результатом теста на мутацию MTHFR могут иметь повышенный риск преэклампсии, повторных выкидышей или рождения ребенка с врожденными нарушениями.
Мета-анализ 2015 года, основанный на 54 исследованиях с контролем случаев заболевания, выявил убедительные доказательства того, что женщины с генотипом MTHFR C677T имеют более высокий риск преэклампсии.
По словам исследователей, эта мутация присутствовала в 1,371 раза чаще среди женщин с преэклампсией.
В исследовании, проведенном в 2018 году, ученые обнаружили, что преждевременное прерывание беременности чаще встречалось у женщин с мутацией MTHFR C677T, чем у женщин с мутацией MTHFR A1298C.
Исследователи также отметили сильную связь между вариантами MTHFR и следующими исходами беременности:
· рождение детей с расщелиной губы или неба;
· рождение детей с сердечно-сосудистыми нарушениями;
· рождение детей с нарушениями мочевыделительной системы;
· преждевременный разрыв плодных оболочек ( ПРПО);
· преждевременная отслойка нормально расположенной плаценты.
Информационный центр по генетическим и редким заболеваниям заявляет, что исследования показывают: женщины с двумя вариантами гена C677T могут иметь более высокий риск рождения ребенка с дефектом нервной трубки.
Дефекты нервной трубки относятся к нарушениям позвоночника, головного или спинного мозга, которые присутствуют при рождении. Они обычно развиваются в течение первого месяца беременности.
Люди наследуют одну копию гена MTHFR от каждого из своих родителей, что означает, что у каждого есть два гена MTHFR. Мутации могут происходить в одном или обоих генах.
Наличие родителя или близкого родственника с мутацией гена MTHFR может увеличить риск наследования этого варианта человеком.
Люди, чьи оба родителя являются носителями мутации, имеют повышенный риск гомозиготной мутации MTHFR.
Когда обратиться к врачу
Человек должен обратиться к врачу, если он испытывает симптомы дефицита фолата или витамина B-12, которые могут включать:
· потеря аппетита или непреднамеренная потеря веса;
· онемение, покалывание или боль в руках или ногах;
· головокружение или потеря равновесия;
Человек также должен обратиться к врачу, если у него есть симптомы анемии, которые могут включать:
Наличие мутации MTHFR по-разному влияет на разных людей. Люди с одним или несколькими вариантами MTHFR могут иметь более высокие, чем обычно, уровни гомоцистеина в крови или моче.
Хотя текущие исследования выявили связи между вариантами MTHFR и многочисленными заболеваниями, необходимы дополнительные исследования, чтобы определить точное влияние этих генных мутаций на здоровье.
Люди могут поговорить со своим врачом о преимуществах и рисках генетического тестирования. Однако большинство организаций здравоохранения не рекомендуют генетическое тестирование, если человек не испытывает значительных проблем со здоровьем.
Бомба замедленного действия: чем опасно носительство мутаций у будущих родителей
Когда тест на беременность показывает заветные две полоски – это очень радостное и волнительное событие. Будущие родители готовятся к тому, что с появлением малыша их жизнь заиграет новыми красками. К сожалению, не для всех пар эти мечты воплощаются в реальность. Иногда счастье сменяется болью утраты из-за того, что беременность прерывается по непонятным причинам.
Пары, пережившие такие события, часто начинают винить себя. Женщина перебирает в памяти события из своей жизни, пытается понять, что она делала неправильно, где совершила роковую ошибку, из-за которой всё это произошло. На самом деле чаще всего никто не виноват. Одна из возможных причин прерываний беременности и рождения детей с тяжелыми заболеваниями – наследственность. Генетические мутации коварны. Некоторые из них передаются по аутосомно-рецессивному типу. Катастрофа происходит, когда в клетках организма встречаются две «неправильные» копии гена. Оба родителя могут оказаться носителями. Каждый из них здоров, потому что один ген функционирует нормально. Но есть 25% вероятность, что ребенок получит оба дефектных гена. Это высокий риск.
Еще существуют наследственные заболевания, сцепленные с полом. Тут тоже довольно сложный механизм наследования. Например, если дефектный ген находится в «женской» X-хромосоме, то носительницами могут быть только женщины, а их сыновья в 50% случаев рождаются больными, в остальных 50% случаев они здоровы и не являются носителями.
Проблема в том, что такие «неправильные» гены обычно сложно выявить. У носителей нет симптомов, и они не догадываются о рисках для потомства. Зачастую это вскрывается только после нескольких прервавшихся беременностей или рождения ребенка с тяжелым заболеванием.
Случаи из нашей практики
В 2019 году в Репробанк обратилась пара, у которой было несколько потерь беременности и безуспешных попыток ЭКО. Эти люди очень хотели завести ребенка, они прошли обследование, и после тщательного обследования врач-генетик заподозрил в паре носительство одного из генетических заболеваний, относящихся к группе митохондриальной патологии.
Генетический анализ показал, что оба партнера являются носителями мутации в гене SCO2. Эта мутация связана с тяжелым заболеванием – фатальной инфантильной митохондриальной миопатией. Эта патология вызвана нарушением функции митохондрий – «клеточных электростанций», она проявляется в виде почечной недостаточности, поражения сердечной мышцы (кардиомиопатии), выраженных дыхательных нарушений, снижения мышечного тонуса, слабости, повышенного уровня молочной кислоты в крови (лактат-ацидоз).
Другая пара обратилась к нам по поводу замершей беременности на девятом месяце. Это одно из самых страшных осложнений беременности, которого сильнее всего боятся будущие мамы. Развитие плода останавливается, и он погибает. В случае с данной парой генетический анализ показал, что оба родителя являются носителями мутации, связанной со спинальной мышечной атрофией (СМА). Это наследственное заболевание может передаваться в том числе по аутосомно-рецессивному типу и характеризуется гибелью нервных клеток, ответственных за движения. Тяжелее всего протекает младенческий тип СМА: у таких детей с рождения нарушено дыхание, они не могут нормально сосать грудь, глотать, держать головку, сидеть.
Еще одна мутация, носители которой обращались в Репробанк, была связана с наследственным поликистозом почек. При этой патологии у детей примерно 90% ткани почек замещается кистами, развивается прогрессирующая почечная недостаточность. У этой пары в анамнезе было 4 потери ребенка.
Донорские половые клетки – одно из возможных решений
Для родителей, которые являются носителями одинаковых мутаций, связанных с тяжелыми наследственными заболеваниями, есть несколько решений. Вот что об этом говорит врач-генетик Александра Борисовна Тюрина:
«У партнеров, которые являются носителями мутаций в одном и том же гене, ответственном за редкую наследственную патологию, очень высок риск родить больного ребенка. Вариантов у таких семей несколько: сделать ЭКО с поиском семейной мутации у эмбриона, обследовать плод во время беременности, сделать выбор в пользу донорского материала, выбрать усыновление или отказ от деторождения вовсе. Это так называемые «reproductive options». Этот термин можно перевести как репродуктивный выбор или репродуктивные варианты. У каждого из этих вариантов есть как преимущества, так и недостатки, но нет плохого или хорошего решения. Каждая семья, столкнувшаяся с редким наследственным заболеванием, делает приемлемый для себя выбор. Репробанк помогает подобрать подходящего донора для каждой конкретной семьи и минимизировать риск рождения ребенка с наследственным заболеванием, если пара выберет этот путь».
Паре из нашего первого примера – носителям мутации SCO2 – было предложено воспользоваться донорскими половыми клетками. Для первой беременности наши специалисты оплодотворили яйцеклетку женщины донорской спермой, а для второй беременности сперматозоиды ее партнера использовали для оплодотворения донорской яйцеклетки. Оба донора были дополнительно проверены на носительство данной мутации. Теперь эта пара растит двух здоровых малышей.
«Наши стандарты отбора доноров – одни из самых строгих в мире. Донором Репробанка становится только 1 из 300 кандидатов. Мы стремимся снизить до минимума риски возникновения генетических заболеваний. В дополнение к необходимым, согласно №107н (803н) приказу, обследованиям все наши доноры обязательно проходят генетический скрининг. Многим из них проведено полноэкзомное секвенироване экзома — исследование (прочтение) всей кодирующей белок части генома.
Как итог, около 40% доноров мы отсеиваем по причине носительства того или иного частого или очень серьезного наследственного заболевания (а в некоторых случаях и нескольких одновременно). Для данной пары мы подобрали доноров спермы и яйцеклеток, не имеющих мутации в гене SCO2».
Автандил Чоговадзе, руководитель Репробанка.
Также мы могли бы предложить этой паре воспользоваться технологией предимплантационного генетического тестирования на моногенную патологию (ПГТ-М). Этот метод помог бы получить совместные эмбрионы у супругов, протестировать их и отобрать на перенос только те, что здоровы или являются здоровыми носителями. К сожалению, у этой технологии есть ряд ограничений: высокая себестоимость, значительное время для реализации. Поэтому наши пациенты отказались от этого варианта.
Все три наших примера иллюстрируют огромную роль генетических исследований при подготовке к беременности. Всем парам, планирующим завести ребенка, стоит проконсультироваться с клиническим генетиком вне зависимости от возраста, состояния здоровья и семейной истории. Это может помочь избежать трагедии в будущем.
Все доноры половых клеток в Репробанке проходят тщательное обследование, в том числе генетический скрининг. В нашем каталоге нет носителей опасных мутаций. Тем не менее, если вы решили использовать донорский материал, вам стоит пройти генетическое обследование.