Гетерологический прайм буст что это
Различные точки зрения на вакцинацию против свиного гриппа
Различные точки зрения на вакцинацию против свиного гриппа
Сложности при выборе штамма вакцины против SwIV
SwIV претерпел больше изменений, чем когда либо за последние десять лет, а отсутствие перемен в вакцинном штамме SwIV и рекомендаций стало важным вопросом. Хотя по существу все вирусы свиного гриппа получили свой гемагглютинин от вирусов, когда-то циркулирующих у людей, эпидемиология гриппа намного сложнее у свиней, чем у людей (Lewis и др, 2016). Множественный перенос вирусов гриппа от человека свиньям в различных странах и тот факт, что свиньи не перемещаются подобно людям, внесло вклад в огромное генетическое и антигенное многообразие вирусов свиного гриппа. Это проиллюстрировано на Рис. 1 для подтипа H3N2. 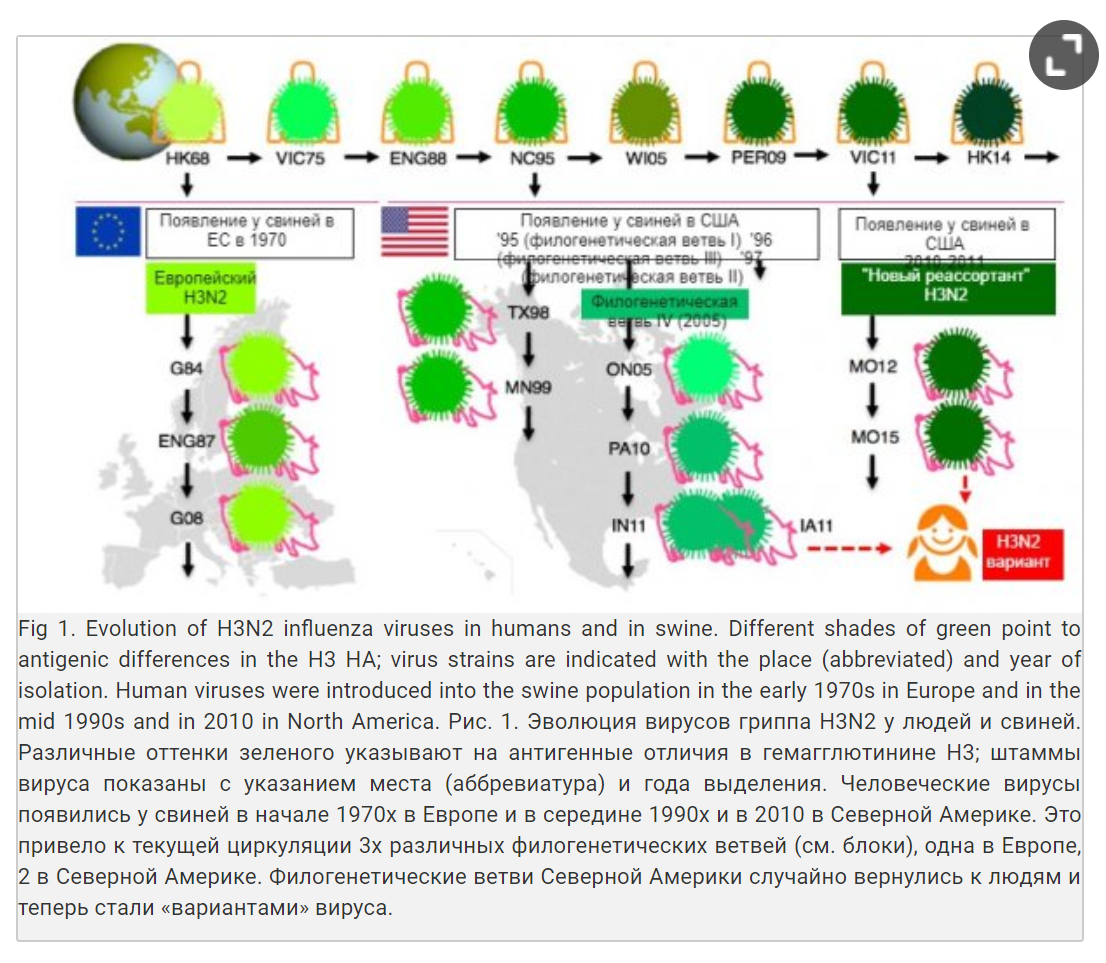
Подтипы свиного гриппа H1N1 и H1N2 еще более многообразны. Три клеточных линии H1, циркулирующих одновременно во многих странах Европы: птичье подобный, человекоподобный и пандемический H1 2009 года. Аминокислотная последовательность из гемагглютинина различается на 20-25% и между ними существует минимальная серологическая перекрестная реактивность. Более того, превалирующие клеточные линии и филогенетические ветви (под классификации клеточной линии) отличаются в различных частях Европы, а в Северной Америке и Азии циркулируют другие филогенетические ветви.
Важно отметить, что в отличие от вакцин против человеческого гриппа многие из коммерческих вакцин против SwIV выказывают относительно широкую защиту против перемещающихся вариантов в указанных клеточных линиях H1 или H3. Это может быть объяснено наличием адъювантов в этих вакцинах, что увеличивает перекрестную реактивность иммунного ответа. Тем не менее, задача – как защитить свиней против многочисленной коциркуляции вирусов H1 и H3 из различных клеточных линий и филогенетических ветвей. Это может потребовать применение мультивалентных вакцин, состоящих, по крайней мере, из 5 различных штаммов свиного гриппа H1 и H3. Подходящие штаммы не только будут различаются в разных странах и регионах, но и потребуют регулярных обновлений. Такие поливалентные вакцины против SwIV сложны как с технической, так и с экономической точки зрения. Развитие вакцин, которые могут предложить более широкую перекрестную защиту клеточных линий и филогенетических ветвей может стать более предпочтительным подходом.
Гетерологическая прайм-буст вакцинация может предложить более широкую защиту, чем соответствующая поливалентная вакцина
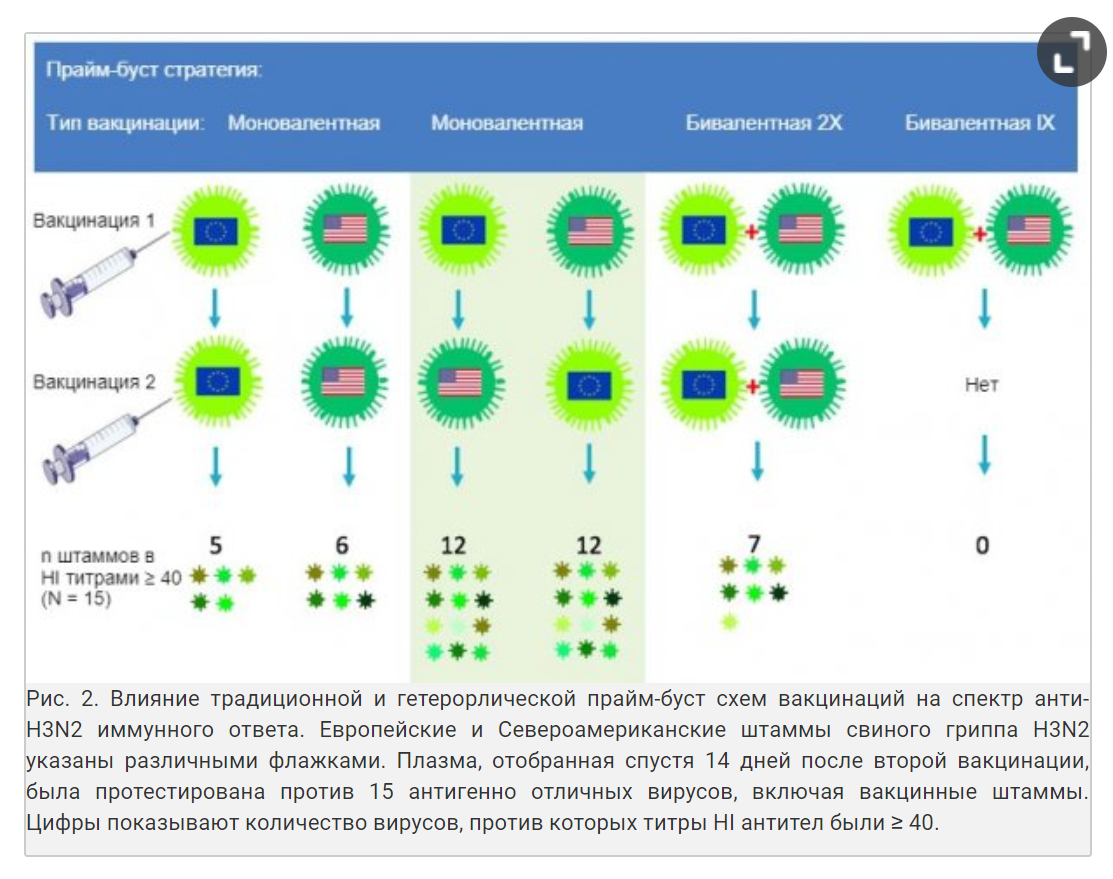
Исследователи гриппа пытаются стимулировать иммунный ответ на части гемагглютинина, которые наименее всего меняются от штамма к штамму. Антигенные детерминанты в таких частях в большой степени игнорируются традиционными вакцинами и вакционными стратегиями так как они «субдоминантные». Один подход, кажущийся многообещающим, выбирает два сильно различающихся по антигенным свойствам штамма с подтипами Н1 и Н3 для первичной и вторичной вакцинации. Так как у этих штаммов небольшое перекрытие в самых вариабельных ключевых антигенных детерминантах, антитела, продуцирующие клетки будут перенаправлены на законсервированные субдоминантные антигенные детерминанты. Наша исследовательская группа в Гентском университете продемонстрировала потенциал данной «гетерологической прайм-буст» стратегии при изучении свиней с экспериментально инактивированной вакциной против свиного гриппа Н3N2. Чистым по гриппу свиньям сначала сделали инъекцию с европейским штаммом Н3N2, а затем 4 недели спустя штаммом Н3N2 из Северной Америки или наоборот, как показано на Рис 2.
Полученные антитела дали перекрестную реакцию с около 80% панели с 15 различными штаммами вируса H3N2 как человеческого, так и свиного происхождения, по сравнению с менее 40% в контрольной группе с гомологической прайм-буст вакцинацией (Ван Рит и др., 2017). Антитела против обоих вакцинных штаммов были обнаружены только после гетерологической прайм-буст вакцинации или после 2 инъекций бивалентной вакциной, содержащей оба штамма, но степень перекрестной реакции была намного больше в первых группах. Использование различных вакцин для первой и бустерной вакцинации не только кажется более иммунногенной, чем любая из существующих вакцин против SwIV, это также может сократить общее количество необходимых вакцин.
Важно, что не любая комбинация антигенно отличных штаммов свиного гриппа H3N2 и H1N1 хорошо сработают. Также, порядок введения вакцинных штаммов оказывает огромный эффект на иммунный ответ. В настоящий момент мы пытаемся вывести научную базу для этих наблюдений и в дальнейшем улучшить прайм-буст схемы как с вирусами H3N2, так и H1N1 и H1N2.
От эксперимента к практике
К сожалению, эффекты первичной и последующей вакцинации различными коммерческими вакцинами против SwIV пока не были изучены, и пока мы еще не можем рекомендовать определенные прайм-буст схемы для использования на практике. Данный альтернативный подход потребует либерального отношения со стороны вакцинаторов. Маловероятно, что одна прайм-буст схема будет подходить для животных всех возрастов. Хотя мы считаем, что несколько выбранных схем могут смягчить некоторые из самых серьезных препятствий эффективной вакцинации против SwIV. Вакцинация маленьких поросят штаммами, которые отличаются от используемых на практике и от применяемых для вакцинации свиноматок смогут, в определенной степени, преодолеть ингибирующий эффект материнских антител. В дополнении, повторяющиеся вакцинации свиноматок альтернативными штаммами скорее всего будут более иммунногенными, чем использование раз за разом одинаковых штаммов. В идеале, имеющийся активный иммунитет также следует рассматривать при планировании схем вакцинации. Действительно, свинки и свиноматки обычно являются зараженными одним или более штаммами SwIV. Имеющийся иммунитет, как было выявлено, увеличивает и во многих случаях расширяет иммунный ответ на мертвую вакцину, особенно если вакцинные штаммы отличаются от тех, которые вызвали инфекцию.
Политика регулярного обновления штаммов вакцин не только непрактична для вакцин против свиного гриппа, у нее есть свои ограничения. Нам не стоит забывать, что успех вакцинации будет зависеть от многих факторов, отличных от соответствия вакцинных штаммов, таких как история заражения гриппом, адъювант и доза антигена в вакцине (Ван Рит и Ма, 2013). Эти прочие факторы кажутся более важными в свиноводстве, нежели в ситуации с людьми.
Автор: Sharon Chepkwony, Kristien Van Reeth
Безопасность и эффективность гетерологичной вакцины prime-boost COVID-19 на основе Спутник V: промежуточный анализ исследования фазы 3 в России
Пандемия COVID-19 привела к более чем 98 миллионам подтвержденных случаев заболевания и более чем 2 миллионам смертей (на момент публикации). Существует несколько временно лицензированных вакцин против COVID-19, и глобальные усилия сосредоточены на разработке безопасных и эффективных вакцин для профилактики COVID-19. Согласно проекту ВОЗ «ландшафт вакцин-кандидатов COVID-19», 64 кандидата находятся на клинической оценке (в том числе 13 на этапе 3), а 173-на доклиническом анализе.
Аденовирусные векторные вакцины
Безопасность аденовирусных векторных вакцин широко изучена, и терапевтические препараты на основе аденовирусных векторов используются в клинической практике. Известно, что аденовирусные вектор-доставляемые антигены индуцируют как клеточный, так и гуморальный иммунитет после однократной иммунизации, что позволяет использовать их в качестве средства экстренной профилактики в условиях пандемии. Кроме того, использование двух иммунизаций дает прочный и длительный иммунный ответ.
Эти характеристики делают вакцины на основе рекомбинантного аденовируса с дефицитом репликации (rAd) подходящими кандидатами для профилей целевых продуктов ВОЗ для долгосрочной защиты людей с высоким риском заражения COVID-19 в условиях вспышки, поскольку они стимулируют быстрое наступление защитного иммунитета. Хотя аденовирусные векторы могут индуцировать иммунные реакции против компонентов вектора и ослаблять антиген-индуцированные реакции, гетерологичная вакцинация прайм-бустом с двумя различными векторами позволяет минимизировать этот эффект.
Таким образом, наиболее эффективным подходом для генерирования мощного и длительного иммунного ответа, не зависящего от наличия уже существующего иммунного ответа на вектор, является гетерологичный подход к вакцинации прайм-бустом. Этот подход был использован при разработке вакцины для профилактики COVID-19.
Gam-COVID-Vac—это комбинированная векторная вакцина, основанная на rAd type 26 (rAd26) и rAd type 5 (rAd5)-оба из которых несут ген полноразмерного гликопротеина S SARS-CoV-2 (rAd26-S и rAd5-S). рАд26-С и рАд5-С вводят внутримышечно раздельно с интервалом 21 день. Фаза 1/2 клинических испытаний вакцины была завершена в августе 2020 года.
Результаты показали, что вакцина хорошо переносится и обладает высокой иммуногенностью у здоровых участников. В результате кандидат на вакцину был предварительно одобрен в России в соответствии с национальным законодательством. Такая регистрация позволяет использовать вакцину в группах высокого риска, с усиленным фармаконадзором, при этом проводится постмаркетинговое исследование эффективности. Здесь мы представляем предварительные результаты эффективности и безопасности многоцентрового исследования фазы 3 с использованием Gam-COVID-Vac у взрослых с субанализом взрослых старше 60 лет.
Вакцина prime-boost COVID-19 на основе Спутник V
Гетерологичная рекомбинантная вакцина на основе аденовируса (rAd) Gam-COVID-Vac (Sputnik V) показала хороший профиль безопасности и индуцировала сильные гуморальные и клеточные иммунные реакции у участников клинических испытаний фазы 1/2. Здесь сообщаются предварительные результаты эффективности и безопасности Gam-COVID-Vac из промежуточного анализа исследования фазы 3.
Зарегистрированные участники были разделены на пять возрастных групп (18-30 лет, 31-40 лет, 41-50 лет, 51-60 лет и >60 лет) и распределены в две исследовательские группы с использованием стратифицированной (размер блока 4) интерактивной веб-системы реагирования (IWRS) рандомизации в соотношении 3:1 к группе вакцины или группе плацебо. Участникам исследования были присвоены уникальные рандомизационные номера, которые оставались неизменными на протяжении всего исследования. Статистик сгенерировал последовательность, в соответствии с которой препарат был маркирован. Препарат и плацебо были внешне неразличимы (упаковка, этикетка и содержание). Следователи, участники и весь исследовательский персонал были замаскированы для группового задания.
Процедуры
Все участники, давшие согласие на участие, прошли скрининговый визит для физического обследования, проверки жизненно важных показателей (например, кровяного давления, частоты сердечных сокращений и температуры), а также анализов крови на инфекции (ВИЧ, гепатиты В и С, сифилис) и сбора исходных характеристик иммуногенности. У всех добровольцев были проведены анализы мочи на наркотики и алкоголь, а у женщин-тесты на беременность. ПЦР-анализ мазков SARS-CoV-2 также был проведен при скрининге центральной лабораторией в Москве, чтобы исключить участников с COVID-19. При скрининге информация о наличии сопутствующих заболеваний и группе риска инфицирования SARS-CoV-2 заносилась в бланки историй болезни участников. Высокий риск-это те, чья работа связана с взаимодействием с пациентами с подтвержденным диагнозом COVID-19; средний риск-это те, кто имеет профессиональный контакт с большим количеством людей, таких как врачи общей практики, социальные работники и продавцы; а общий риск-это те, у кого нет дополнительных рисков, связанных с их профессиональной деятельностью. Предполагаемая продолжительность участия индивидуумов в исследовании составляла 180 дней после первой дозы вакцины или плацебо. В ходе исследования было запланировано одно скрининговое посещение и пять выездов на клиническую площадку.
Вакцина состоит из двух векторных компонентов: rAd26-S и rAd5-S. Полная доза вакцины составляла 1011 вирусных частиц на дозу для каждого рекомбинантного аденовируса; 0·5 мл/доза для внутримышечного введения. Плацебо состоит из вакцинного буферного состава, но без рекомбинантных аденовирусов, составленных до равного объема вакцины. Вакцина и плацебо были разработаны, изготовлены и сохранены компанией Gamaleya NRCEM (Москва, Россия) в соответствии с Надлежащей производственной практикой. Вакцину и плацебо использовали в жидком виде (замороженном). Составы вакцины и плацебо описаны в приложении (стр. 1). Вакцину (первая доза rAd26, вторая доза rAd5) или плацебо вводили внутримышечно в дельтовидную мышцу с интервалом между дозами 21 день.
Последующие наблюдательные визиты были запланированы на 28-й день (±2 дня), 42-й день (±2 дня) и 180-й день (±14 дней). Во время наблюдательных визитов у всех участников исследования оценивались жизненные показатели и регистрировались изменения в состоянии и самочувствии участников по сравнению с предыдущим визитом. ПЦР-тест проводился в сочетании с клиническим обследованием в день приема второй дозы (21-й день) для диагностики симптоматических и бессимптомных случаев COVID-19. При наличии клинических признаков респираторной инфекции и положительного ПЦР-теста участник не был вакцинирован второй дозой и был направлен к медицинскому персоналу для лечения COVID-19. Участники без признаков респираторной инфекции были вакцинированы до получения результатов ПЦР. В случае положительного результата ПЦР-теста участники были классифицированы как бессимптомные и не учитывались как случаи COVID-19 в анализе эффективности, согласно протоколу. Во время исследования, кроме скринингового визита и дня приема второй дозы, никаких дополнительных ПЦР-тестов не проводилось, за исключением случаев, когда участники сообщали о симптомах COVID-19.
Спонсор организовал несколько дополнительных наблюдательных визитов дистанционно в качестве телемедицинских консультаций. Внеплановые телемедицинские консультации поощрялись в случае жалоб или вопросов участников о процедурах исследования. Все участники получили контакты исследовательской группы при подписании информированного согласия и были проинструктированы связываться с группой по мере необходимости, но в первую очередь сообщать о любых признаках или симптомах, которые могут свидетельствовать о неблагоприятном событии. Всем участникам также предлагалось установить электронные дневники на свои смартфоны для мониторинга состояния своего здоровья. Информация от тех участников, которые решили не использовать электронные дневники, была собрана сотрудниками сайта с помощью технологии телеконсультации. Данные, собранные в ходе этих телемедицинских консультаций, были внесены исследователями сайта непосредственно в медицинскую карту участника.
Исследование было организовано и контролировалось московским филиалом голландской контрактной исследовательской организации Crocus Medical. Управление данными осуществляется с помощью ДМ 365 MainEDC системы (разработчик-управление данными 365), мощная облачная платформа комплексной включать в себя функции сбора данных, передовые методы рандомизации, полный контроль над лекарственного обеспечения и отпуска, и пациент электронных дневников (электронного захвата данных, приложения, лекарственного обеспечения и электронного пациентов исходы). Система соответствует всем применимым международным нормам, включая Кодекс федеральных правил, Раздел 21 Часть 11, Надлежащую клиническую практику, Надлежащую автоматизированную производственную практику 5, Переносимость и подотчетность Медицинского страхования и Общие Правила защиты данных. Система позволяет собирать и валидировать клинические данные в высоконагруженных клинических испытаниях и поддерживает процессы централизованного мониторинга и риск-ориентированного мониторинга, автоматизированное кодирование с помощью Медицинского словаря для регуляторной деятельности (MedDRA), WHODrug и Логических идентификаторов наблюдений, а также мгновенное сопоставление экспортированных данных со стандартной моделью табуляции данных исследований Консорциума Стандартов обмена клиническими данными.
Забор крови проводился в день вакцинации непосредственно перед введением исследуемого препарата. Забор крови для оценки параметров иммуногенности проводился только в некоторых исследовательских центрах, отобранных на основе логистической цепочки доставки биоматериала в центральную лабораторию, где проводилась первичная обработка крови (сбор сывороток, аликвотирование и замораживание). Забор крови на антиген-специфические IgG в анализе планируется принять от до 9520 участников судебного процесса до окончания судебного разбирательства.
Полученные данные
В период с 7 сентября по 24 ноября 2020 года 21 977 взрослых были разделены в группу вакцинации (n=16 501) или группу плацебо (n=5476). 19 866 получили две дозы вакцины или плацебо и были включены в первичный анализ результатов. С 21 дня после первой дозы вакцины (день введения дозы 2), 16 (0·1%) из 14 964 участников в группе вакцины и 62 (1·3%) из 4902 в группе плацебо было подтверждено наличие COVID-19; эффективность вакцины составила 91·6% (95% ДИ 85·6-95·2). Большинство зарегистрированных нежелательных явлений были 1-й степени (7485 [94·0%] из 7966 общих событий). 45 (0·3%) из 16 427 участников в группе вакцинации и 23 (0·4%) из 5435 участников в группе плацебо имели серьезные побочные эффекты; ни один из них не был признан связанным с вакцинацией, что было подтверждено независимым комитетом по мониторингу данных. В ходе исследования было зарегистрировано четыре смерти (три [
Вывод
Этот промежуточный анализ фазы 3 исследования Gam-COVID-Vac показал 91·6% эффективность против COVID-19 и хорошо переносился в большой когорте.