Что вовлекается в первые реакции кетогенеза
Кетогенез, типы кетоновых тел, синтез и деградация
cetogénesis это процесс, с помощью которого получают ацетоацетат, β-гидроксибутират и ацетон, которые вместе называют кетоновыми телами. Этот сложный и тонко регулируемый механизм осуществляется в митохондриях, от катаболизма жирных кислот.
Получение кетоновых тел происходит, когда организм подвергается истощающим периодам голодания. Хотя эти метаболиты синтезируются в основном в клетках печени, они обнаруживаются в качестве важного источника энергии в различных тканях, таких как скелетные мышцы и ткани сердца и головного мозга..
Hydro-гидроксибутират и ацетоацетат являются метаболитами, используемыми в качестве субстратов в сердечной мышце и коре почек. В мозгу кетоновые тела становятся важными источниками энергии, когда организм исчерпал свой запас глюкозы.
Общие характеристики
Кетогенез считается очень важной физиологической функцией или метаболическим путем. Как правило, этот механизм осуществляется в печени, хотя было показано, что он может осуществляться в других тканях, способных метаболизировать жирные кислоты..
Образование кетоновых тел является основным метаболическим производным ацетил-КоА. Этот метаболит получают из метаболического пути, известного как β-окисление, которое является разложением жирных кислот.
Наличие глюкозы в тканях, где происходит β-окисление, определяет метаболическую судьбу ацетил-КоА. В особых ситуациях окисленные жирные кислоты почти полностью направляются на синтез кетоновых тел..
Типы и свойства кетоновых тел
Основным кетоновым телом является ацетоацетат или ацетоуксусная кислота, которая синтезируется главным образом в клетках печени. Другие молекулы, которые составляют кетоновые тела, происходят из ацетоацетата.
Восстановление ацетоуксусной кислоты приводит к образованию D-β-гидроксибутирата, второго кетонового тела. Ацетон представляет собой соединение, которое трудно разлагать, и он образуется в результате спонтанной реакции декарбоксилирования ацетоацетата (поэтому он не требует вмешательства какого-либо фермента), когда он присутствует в высоких концентрациях в крови.
Обозначение кетоновых тел было принято условно, поскольку, строго говоря, β-гидроксибутират не имеет кетонной функции. Эти три молекулы растворимы в воде, что облегчает их транспорт в крови. Его основная функция заключается в обеспечении энергией определенных тканей, таких как скелетные и сердечные мышцы..
Ферменты, участвующие в образовании кетоновых тел, в основном находятся в клетках печени и почек, что объясняет, почему эти два места являются основными продуцентами этих метаболитов. Его синтез происходит только и исключительно в митохондриальном матриксе клеток..
Как только эти молекулы синтезируются, они попадают в кровоток и попадают в ткани, которые в них нуждаются, где они разлагаются до ацетил-КоА..
Синтез кетоновых тел
Условия для кетогенеза
Метаболическая судьба ацетил-КоА от β-окисления зависит от метаболических потребностей организма. Это окисляется до СО2 и H2Или через цикл лимонной кислоты или синтез жирных кислот, если метаболизм липидов и углеводов в организме стабилен.
Когда организму требуется образование углеводов, оксалоацетат используется для производства глюкозы (глюконеогенез) вместо запуска цикла лимонной кислоты. Это происходит, как уже упоминалось, когда организм имеет некоторую неспособность получить глюкозу в таких случаях, как длительное голодание или наличие диабета..
В связи с этим ацетил-КоА, полученный в результате окисления жирных кислот, используется для производства кетоновых тел..
механизм
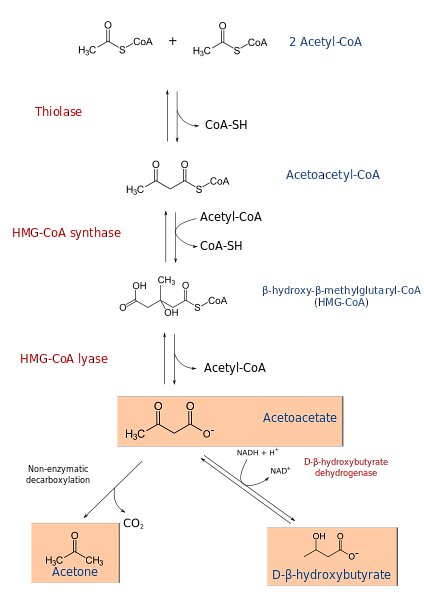
Процесс кетогенеза начинается с продуктов β-окисления: ацетацетил-КоА или ацетил-КоА. Когда субстратом является ацетил-КоА, на первом этапе происходит конденсация двух молекул, реакция, катализируемая ацетил-КоА-трансферазой, с образованием ацетацетил-КоА.
Ацетацетил-КоА конденсируется с третьим ацетил-КоА под действием синтазы ГМГ-КоА с образованием ГМГ-КоА (β-гидрокси-β-метилглутарил-КоА). HMG-CoA разлагается до ацетоацетата и ацетил-КоА под действием лиазы HMG-CoA. Таким образом получается первое кетоновое тело..
Ацетоацетат восстанавливается до β-гидроксибутирата путем вмешательства β-гидроксибутиратдегидрогеназы. Эта реакция зависит от НАДН.
Основным ацетоацетатным кетоновым телом является β-кетокислота, которая подвергается неферментативному декарбоксилированию. Этот процесс прост и производит ацетон и СО2.
Таким образом, эта серия реакций приводит к образованию кетоновых тел. Они, будучи растворимыми в воде, могут легко транспортироваться через кровоток без необходимости прикрепления к структуре альбумина, как в случае жирных кислот, которые нерастворимы в водной среде..
Β-окисление и кетогенез связаны между собой
Метаболизм жирных кислот производит субстраты для кетогенеза, поэтому эти два пути функционально связаны.
Ацетоацетил-КоА является ингибитором метаболизма жирных кислот, поскольку он останавливает активность ацил-КоА-дегидрогеназы, которая является первым ферментом β-окисления. Кроме того, он также оказывает ингибирование на ацетил-КоА-трансферазу и синтазу HMG-КоА..
Фермент синтаза HMG-CoA, подчиненный СРТ-I (фермент, участвующий в производстве ацилкарнитина при β-окислении), представляет важную регуляторную роль в образовании жирных кислот.
Регуляция β-окисления и его влияние на кетогенез
Питание организмов регулирует сложный набор гормональных сигналов. Углеводы, аминокислоты и липиды, потребляемые в рационе, откладываются в форме триацилглицеринов в жировой ткани. Инсулин, анаболический гормон, участвует в синтезе липидов и образовании триацилглицеринов.
На уровне митохондрий β-окисление контролируется поступлением и участием некоторых субстратов в митохондриях. Фермент CPT I синтезирует ацилкарнитин из цитозольного ацил-КоА.
Когда организм питается, активируется ацетил-КоА-карбоксилаза, и цитрат повышает уровень СРТ I, а его фосфорилирование уменьшается (циклическая АМФ-зависимая реакция).
Это вызывает накопление малонил-КоА, который стимулирует синтез жирных кислот и блокирует их окисление, предотвращая образование бесполезного цикла..
В случае голодания активность карбоксилазы очень низка, так как уровни фермента СРТ I были снижены, и он был фосфорилирован, активируя и стимулируя окисление липидов, что впоследствии позволит образованию кетоновых тел через ацетил-КоА.
деградация
Кетоновые тела диффундируют из клеток, где они синтезируются и транспортируются кровью в периферические ткани. В этих тканях они могут окисляться через цикл трикарбоновых кислот.
В периферических тканях β-гидроксибутират окисляется до ацетоацетата. Впоследствии настоящий ацетоацетат активируется ферментом 3-кетоацил-КоА-трансферазой.
Сукцинил-КоА действует как донор КоА, становясь сукцинатом. Активация ацетоацетата происходит, чтобы предотвратить превращение сукцинил-КоА в сукцинат в цикле лимонной кислоты при сопряженном синтезе ГТФ под действием сукцинил-КоА-синтазы..
Полученный ацетоацетил-КоА подвергается тиолитическому расщеплению с образованием двух молекул ацетил-КоА, которые включаются в цикл трикарбоновых кислот, более известный как цикл Кребса..
В клетках печени отсутствует 3-кетоацил-КоА-трансфераза, предотвращающая активацию этого метаболита в этих клетках. Таким образом, гарантируется, что кетоновые тела не окисляются в клетках, где они были произведены, но что они могут переноситься в ткани, где требуется их активность..
Медицинская значимость кетоновых тел
В организме человека высокие концентрации кетоновых тел в крови могут вызывать особые состояния, называемые ацидозом и кетонемией..
Производство этих метаболитов соответствует катаболизму жирных кислот и углеводов. Одной из наиболее распространенных причин патологического состояния кетогенеза является высокая концентрация фрагментов дикарбоната уксусной кислоты, которые не разлагаются путем окисления трикарбоновых кислот..
Вследствие этого наблюдается повышение уровня кетоновых тел в крови выше 2-4 мг / 100 Н и их присутствие в моче. Это приводит к нарушению промежуточного метаболизма указанных метаболитов..
Определенные дефекты нейрогландулярных факторов гипофиза, которые регулируют деградацию и синтез кетоновых тел, наряду с нарушениями метаболизма углеводородов, являются причиной состояния гиперцетонемии..
Сахарный диабет и накопление кетоновых тел
Сахарный диабет (тип 1) является эндокринным заболеванием, вызывающим увеличение выработки кетоновых тел. Недостаточное производство инсулина препятствует транспорту глюкозы в мышцы, печень и жировую ткань, накапливаясь в крови.
Клетки в отсутствие глюкозы начинают процесс глюконеогенеза и распада жиров и белков для восстановления их метаболизма. Как следствие, концентрация оксалоацетата снижается, а окисление липидов увеличивается..
Затем происходит накопление ацетил-КоА, которое в отсутствие оксалоацетата не может следовать по пути лимонной кислоты, вызывая высокую выработку кетоновых тел, характерных для этого заболевания..
Накопление ацетона определяется его присутствием в моче и дыхании людей, которые имеют это состояние, и на самом деле является одним из симптомов, которые указывают на проявление этого заболевания.
Основные закономерности метаболических процессов в организме человека. Часть 2.
Рассматривая обмен веществ в условиях нормального функционирования организма, следует остановиться на безусловно взаимосвязанных, но в то же время достаточно специфичных составляющих метаболизма, а именно на углеводном, белковом, липидном и водно-электролитном обмене.
Очевидно, что основная роль углеводов в метаболизме определяется их энергетической функцией. Именно глюкоза крови вследствие наличия простого и быстрого пути гликолитической диссимиляции и последующего окисления в цикле трикарбоновых кислот, а также возможности максимально быстрого извлечения ее из депо гликогена, обеспечивающей экстренную мобилизацию энергетических ресурсов, является наиболее востребованным источником энергии в организме. Использование циркулирующей в плазме глюкозы разными органами неодинаково: мозг задерживает 12% глюкозы, кишечник— 9%, мышцы — 7%, почки — 5%. При этом уровень глюкозы плазмы крови является одной из важнейших гомеостатических констант организма, составляя 3, 3—5, 5 ммоль/л. Как известно снижение уровня глюкозы ниже допустимого передела имеет своим незамедлительным следствием дискоординацию деятельности ЦНС, проявляющуюся соответствующей клинической симптоматикой: головной мозг содержит небольшие резервы углеводов и нуждается в постоянном поступлении глюкозы, поскольку энергетические расходы мозга покрываются исключительно за счет углеводов. Глюкоза в тканях мозга преимущественно окисляется, а небольшая часть ее превращается в молочную кислоту.
При полном отсутствии углеводов в пище они образуются в организме из продуктов трансформации жиров и белков. В печени возможно новообразование углеводов как из собственных продуктов их распада (пировиноградной или молочной кислоты), так и из продуктов диссимиляции жиров и белков (кетокислот и аминокислот), что обозначается как глюконеогенез. В результате трансформации аминокислот образуется пировиноградная кислота, при окислении жирных кислот — ацетилкоэнзим А, который может превращаться в пировиноградную кислоту — предшественник глюкозы. Это наиболее важный общий путь биосинтеза углеводов. Между двумя основными источниками энергии — углеводами и жирами — существует тесная физиологическая взаимосвязь. Повышение содержания глюкозы в крови увеличивает биосинтез триглицеридов и уменьшает распад жиров в жировой ткани. Поступление в кровь свободных жирных кислот уменьшается. В случае возникновения гипогликемии процесс синтеза триглицеридов тормозится, ускоряется распад жиров и в кровь в большом количестве поступают свободные жирные кислоты. Гликогенез, гликогенолиз и глюконеогенез являются тесно взаимосвязанными процессами, обеспечивающими оптимальный уровень глюкозы крови сообразно степени функционального напряжения организма.
Центральным звеном регуляции углеводного и других видов обмена и местом формирования сигналов, управляющих уровнем глюкозы, является гипоталамус. Отсюда регулирующие влияния реализуются вегетативными нервами и гуморальным путем, включающим эндокринные железы. Единственным гормоном, снижающим уровень гликемии, является инсулин — гормон, вырабатываемый β-клетками островков Ланхгерганса. Снижение гликемии происходит за счет усиления инсулином синтеза гликогена в печени и мышцах и повышения потребления глюкозы тканями организма. Увеличение уровня глюкозы в крови возникает при действии нескольких гормонов. Это глюкагон, продуцируемый α-клетками островков Ланхгерганса, адреналин — гормон мозгового слоя надпочечников, глюкокортикоиды — гормоны коркового слоя надпочечников, соматотропный гормон гипофиза, тироксин и трийодтиронин — гормоны щитовидной железы. Данные гормоны в связи с однонаправленностью их влияния на углеводный обмен и функциональным антагонизмом по отношению к эффектам инсулина часто объединяют понятием «контринсулярные гормоны».
Таким образом биологическая роль углеводов для организма человека определяется прежде всего их энергетической функцией. Обладая энергетической ценностью в 16, 7 кДж (4, 0 ккал) на 1 грамм вещества, углеводы являются основным источником энергии для всех клеток организма, при этом выполняя еще пластическую и опорную функции. Суточная потребность взрослого человека в углеводах составляет около 500 г.
— пластическая (структурная) функция заключается в том, что белки являются главной составной частью всех клеточных и межклеточных структур тканей;
— ферментная (каталитическая, энзимная) функция состоит в обеспечении всех химических реакций, протекающих в ходе обмена веществ в организме (дыхание, пищеварение, выделение), деятельностью ферментов, являющихся по своей структуре белками;
— транспортная функция белков заключается в их способности к соединению с целым рядом метаболитов и переносе последних в связанном состоянии в межтканевой жидкости и плазме крови к области их утилизации;
— защитная функция белков проявляется реализацией иммунного ответа образованием иммуноглобулинов (антител) и системы комплемента при поступлении в организм чужеродного белка, а также способностью к непосредственному связыванию экзогенных токсинов; белки системы гемостаза обеспечивают свертывание крови и остановку кровотечения при повреждении кровеносных сосудов;
— регуляторная функция, направленная на сохранение гомеостаза с поддержанием биологических констатнт организма, реализуется буферными свойствами молекулы протеинов, белковой структурой клеточных рецепторов, активируемых в свою очередь регуляторными полипептидами и гормонами, также имеющими белковую структуру;
— двигательная функция, обеспечивается взаимодействием сократительных белков мышечной ткани актина и миозина;
— энергетическая роль белков состоит в обеспечении организма энергией, образующейся при диссимиляции белковых молекул; при окислении 1 г белка в среднем освобождается энергия, равная 16, 7 кДж (4, 0 ккал).
При катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы, в результате чего получаются а-кетоглутарат и аммиак. При необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты. В случае использования белков в качестве источника энергии большинство аминокислот окисляются в конечном счёте через цикл лимонной кислоты до углекислого газа и воды. Прежде, чем эти вещества вовлекаются в заключительный этап катаболизма, их углеродный скелет превращается в двухуглеродный фрагмент в форме ацетил-КоА. Именно в этой форме большая часть молекул аминокислот включается в цикл лимонной кислоты.
Таблица 1. 1. Аминокислоты, входящие в состав белков человека.
1. Незаменимые
2. Частично заменимые
3. Условно заменимые
4. Заменимые
Таблица 1. 2. Классификация липидов организма человека.
1. Гликолипиды.
Содержат углеводный компонент.
2. Жиры.
3. Минорные липиды.
4. Стероиды.
А. Стерины (спирты).
Наиболее важен холестерин.
В. Стериды.
Эфиры стеринов и высших жирных кислот. Наиболее распространены эфиры холестерина.
5. Фосфолипипы.
Одним из продуктов катаболизма жиров, имеющем важное значения для метаболизма в целом являются кетоновые тела. Кетоновые тела — группа органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обменов. К кетоновым телам относят β-оксимасляную и ацетоуксусную кислоты и ацетон, имеющие сходное строение и способные к взаимопревращениям. Главным путем синтеза кетоновых тел, происходящего в основном в печени, считается реакция конденсации между двумя молекулами ацетил-КоА, образовавшегося при β-окислении жирных кислот или при окислительном декарбоксилировании пирувата (пировиноградной кислоты) в процессе обмена глюкозы и ряда аминокислот. Данный путь синтеза кетоновых тел более других зависит от характера питания и в большей степени страдает при патологических нарушениях обмена веществ. Из печени кетоновые тела поступают в кровь и с нею во все остальные органы и ткани, где они включаются в универсальный энергообразующий цикл — цикл трикарбоновых кислот, в котором окисляются до углекислоты и воды. Кетоновые тела используются также для синтеза холестерина, высших жирных кислот, фосфолипидов и заменимых аминокислот. При голодании, однообразном безуглеводистом питании и при недостаточной секреции инсулина использование ацетил-КоА в цикле трикарбоновых кислот подавляется, так как все метаболически доступные ресурсы организма превращаются в глюкозу крови. В этих условиях увеличивается синтез кетоновых тел. Следует подчеркнуть важную роль кетоновых тел в поддержании энергетического баланса. Кетоновые тела – поставщики «топлива» для мышц, почек и действуют, возможно, как часть регуляторного механизма с обратной связью, предотвращая чрезвычайную мобилизацию жирных кислот из жировых депо. Печень в этом смысле является исключением, она не использует кетоновые тела в качестве энергетического материала.
Процесс образования, отложения и мобилизации из депо жира регулируется нервной и эндокринной системами, а также тканевыми механизмами и тесно связаны с углеводным обменом. Так, повышение концентрации глюкозы в крови уменьшает распад триглицеридов и активизирует их синтез. Понижение концентрации глюкозы в крови, наоборот, тормозит синтез триглицеридов и усиливает их расщепление. Таким образом, взаимосвязь жирового и углеводного обменов направлена на обеспечение энергетических потребностей организма. При избытке углеводов в пище триглицериды депонируются в жировой ткани, при нехватке углеводов происходит расщепление триглицеридов с образованием неэтерифицнрованных жирных кислот, служащих источником энергии. В обмене жиров одна из важнейших ролей принадлежит печени. Печень — основной орган, в котором происходит образование кетоновых тел (бета-оксимасляная, ацетоуксусная кислоты, ацетон), используемых как альтернативный глюкозе источник энергии.
Как указывалось выше метаболизм жиров контролируется нервной и эндокринной системами. Мобилизация жиров из депо происходит под влиянием гормонов мозгового слоя надпочечников — адреналина и норадреналина. Соматотропный гормон гипофиза также обладает жиромобилизирующим действием. Аналогично действует тироксин — гормон щитовидной железы. Тормозят мобилизацию жира глюкокортикоиды — гормоны коркового слоя надпочечника, вероятно, вследствие того, что они несколько повышают уровень глюкозы в крови. Действие инсулина связано с повышением активности внутриклеточной фосфодиэстеразы, что приводит к снижению концентрации цАМФ и угнетению липолиза. Таким образом, инсулин усиливает синтез жира и уменьшает скорость его мобилизации. Имеются данные, свидетельствующие о возможности прямых нервных влияний на обмен жиров. Симпатические влияния тормозят синтез триглицеридов и усиливают их распад. Парасимпатические влияния, напротив, способствуют отложению жира в депо.
Статья добавлена 31 мая 2016 г.
Публикации в СМИ
Кетоацидоз диабетический
Диабетический кетоацидоз (ДКА) — неотложное состояние, развивающееся в результате абсолютного (как правило) или относительного (редко) дефицита инсулина, характеризующееся гипергликемией, метаболическим ацидозом и электролитными нарушениями. Крайнее проявление диабетического кетоацидоза — кетоацидотическая кома. Статистические данные. 46 случаев на 10 000 пациентов, страдающих СД. Преобладающий возраст — до 30 лет.
Факторы риска • Поздняя диагностика СД • Неадекватная инсулинотерапия • Сопутствующие острые заболевания и травмы • Предшествующая дегидратация • Беременность, осложнённая ранним токсикозом.
Этиопатогенез
• Гипергликемия. Недостаток инсулина снижает утилизацию глюкозы на периферии и наряду с избытком глюкагона обусловливает усиленное образование глюкозы в печени за счёт стимуляции глюконеогенеза, гликогенолиза и ингибирования гликолиза. Распад белка в периферических тканях обеспечивает приток аминокислот к печени (субстрат для глюконеогенеза).
• В результате развиваются осмотический диурез, гиповолемия, дегидратация и избыточное выведение натрия, калия, фосфата и других веществ с мочой. Уменьшение ОЦК ведёт к освобождению катехоламинов, препятствующих действию инсулина и стимулирующих липолиз.
Клиническая картина кетоацидотической комы определяется её стадией.
• I стадия (кетоацидотическая прекома) •• Сознание не нарушено •• Полидипсия и полиурия •• Умеренная дегидратация (сухость кожных покровов и слизистых оболочек) без нарушения гемодинамики •• Общая слабость и похудание •• Ухудшение аппетита, сонливость.
• II стадия (начинающаяся кетоацидотическая кома) •• Сопор •• Дыхание типа Куссмауля с запахом ацетона в выдыхаемом воздухе •• Выраженная дегидратация с нарушением гемодинамики (артериальная гипотензия и тахикардия) •• Абдоминальный синдром (псевдоперитонит) ••• Напряжение мышц передней брюшной стенки ••• Симптомы раздражения брюшины ••• Многократная рвота в виде «кофейной гущи» обусловлен диапедезными кровоизлияниями и паретическим состоянием сосудов слизистой оболочки желудка.
• III стадия (полная кетоацидотическая кома) •• Сознание отсутствует •• Гипо- или арефлексия •• Резко выраженная дегидратация с коллапсом.
Лабораторные исследования • Повышение концентрации глюкозы в крови до 17–40 ммоль/л • Увеличение содержания кетоновых тел в крови и моче (для определения содержания кетоновых тел обычно используют нитропруссид, реагирующий с ацетоацетатом) • Глюкозурия • Гипонатриемия • Гиперамилаземия • Гиперхолестеринемия • Увеличение содержания мочевины в крови • Бикарбонат сыворотки крови 300 мосм/кг) • Увеличение анионной разницы.
Специальные исследования • ЭКГ (особенно при подозрении на ИМ). Как правило, выявляют синусовую тахикардию • Рентгенография органов грудной клетки для исключения инфекции дыхательных путей.
Дифференциальная диагностика • Гиперосмолярная некетоацидотическая кома • Кома молочнокислая диабетическая • Гипогликемическая кома • Уремия.
ЛЕЧЕНИЕ
Режим • Госпитализация в отделение интенсивной терапии. Постельный режим • Цели интенсивной терапии — ускорение утилизации глюкозы инсулинзависимыми тканями, купирование кетонемии и ацидоза, коррекция нарушений водно-электролитного баланса.
Диета. Парентеральное питание.
Осложнения • Отёк мозга • Отёк лёгких • Венозный тромбоз • Гипокалиемия • ИМ • Поздняя гипогликемия • Эрозивный гастрит • Инфекции • Респираторный дистресс-синдром • Гипофосфатемия.
Течение и прогноз • Кетоацидотическая кома — причина 14% госпитализаций больных СД и 16% летальных исходов при СД • Летальность составляет 5–15%.
Возрастные особенности • Дети. Часто возникают серьёзные психические нарушения •• Лечение — в/в болюсное введение маннитола 1 г/кг в виде 20% р-ра •• При отсутствии эффекта — гипервентиляция до рaСО2 2–28 мм рт.ст • Пожилые. Особое внимание необходимо обращать на состояние почек, возможна хроническая сердечная недостаточность.
Беременность. Риск гибели плода при кетоацидотической коме во время беременности составляет около 50%.
Профилактика • Определение концентрации глюкозы в крови при любом стрессе • Регулярное введение инсулина.
Сокращения • ДКА — диабетический кетоацидоз.
МКБ-10 • E10.1 Инсулинзависимый сахарный диабет с кетоацидозом • E11.1 Инсулиннезависимый сахарный диабет с кетоацидозом • E12.1 Сахарный диабет, связанный с недостаточностью питания с кетоацидозом • E13.1 Другие уточнённые формы сахарного диабета с кетоацидозом • E14.1 Сахарный диабет неуточнённый с кетоацидозом.
Примечание. Разница анионная — разница между суммой измеренных катионов и анионов в плазме или сыворотке, вычисленная по формуле: (Na + + K + ) — (Cl – + HCO3–) = 20 ммоль/л. Может быть увеличена при диабетическом ацидозе или молочнокислом ацидозе; не изменена или уменьшена при метаболическом ацидозе с потерей бикарбоната « катионно-анионная разница.