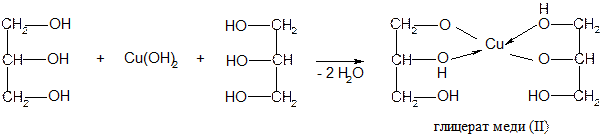Что влияет на растворимость спиртов
Физические и химические свойства одноатомных спиртов
Физические и химические свойства одноатомных спиртов отличаются от ранее рассмотренных органических соединений в связи с наличием гидроксильной группы в молекуле спирта.
Физические свойства одноатомных спиртов
Спирты с числом углеродных атомов С1 — С15 представляют собой жидкости, более С15 – твердые вещества. Имеют резкий запах. Первый член ряда – метанол очень токсичен (смертельная доза для человека — 30 г).
Температура кипения. Размер молекулы спирта определяет его температуры кипения и плавления. Обычно, чем больше размер спирта, тем выше температура кипения. Это связано с тем, что с увеличением размера молекул спирта растет сила Ван-дер-Ваальса между ними. Изменение температур кипения спиртов в гомологическом ряду составляет
Спирты и все органические гидроксилсодержащие соединения способны образовывать водородную связь и объединяться в ассоциаты:
Поэтому точки их кипения выше, чем у их исходных молекул. Причем, чем меньше алкильных групп окружают гидроксильную группу, тем легче протекает ассоциация и тем выше температура кипения вещества. Поэтому, Ткип спиртов нормального строения выше, чем у их разветвленных изомеров.
Изменение температур кипения одноатомных спиртов нормального строения отражены на рисунке ниже:
Воспламеняемость спиртов уменьшается с увеличением размера и массы молекул. При сгорании ковалентные связи молекул разрушаются, поэтому по мере того как размер и масса молекул увеличиваются, возрастает число ковалентных связей, которые нужно разрушить. Следовательно, для разрыва связей требуется больше энергии, поэтому воспламеняемость спиртов уменьшается с увеличением размера и массы молекул.
Растворимость в воде и органических растворителях. Спирты растворимы в воде. Это связано с наличием гидроксильной группы в молекуле спирта, которая способна образовывать водородные связи с молекулами воды. По мере увеличения длины углеводородной цепи спирта растворимость в воде снижается – проявляется так называемый гидрофобный эффект. Так, метиловый, этиловый и пропиловые спирты смешиваются с водой в любых соотношениях, бутанол растворяется в воде лишь на 10 %, а спирты, содержащие более 9 углеродных атомов в воде нерастворимы.
Спирты хорошо растворимы во многих органических растворителях.
Химические свойства одноатомных спиртов
Кислотные свойства спиртов уменьшается в ряду: Первичные > Вторичные > Третичные
1) Взаимодействие с щелочными металлами (образование алкоголятов). Подобно воде, спирты взаимодействуют с щелочными металлами, образуя алкоголяты (по другому их называют алкоксиды). Под действием воды алкоголяты гидролизуются с образованием спирта и основания:
Спирты не реагируют с водными растворами щелочей, однако взаимодействуют с их спиртовыми растворами, образуя также алкоголяты:
Алкоголяты щелочных металлов имеют сильно полярную связь О – Ме и диссоциируют в спиртовом растворе на алкоксид – анионы и катионы металла, например, метилат (метоксид) натрия диссоциирует на метоксид – анион и катион натрия:
2) Взаимодействие с минеральными и органическими кислотами (образование сложных эфиров). Такие реакции называются реакциями этерификации:
3) Взаимодействие с хлористым тионилом ведет к образованию галогеналканов:
4) Взаимодействие с хлорангидридами минеральных (неорганических) и органических кислот (образование сложных эфиров). Реакции с первичными спиртами:
При действии на первичные спирты PBr3 и PI3 может происходить обмен гидроксила на галоид:
Реакции со вторичными и третичными спиртами сопровождаются в основном обменом гидроксила на галоид
5) Внутримолекулярная дегидратация спиртов (образование алкенов) протекает при нагревании с кислотами или при пропускании спирта над окисью алюминия при
Наиболее легко вода отщепляется от третичных спиртов.
6) Межмолекулярная дегидратация спиртов (образование простых эфиров) происходит при слабом нагревании с кислотами или другими водоотнимающими веществами:
Простые эфиры можно получить, используя синтез Вильямсона:
7) Взаимодействие одноатомных спиртов с бихроматом или перманганатом калия приводит к их окислению. При окислении первичного спирта образуется альдегид, вторичного – кетон. При дальнейшем окислении альдегида можно получить карбоновую кислоту:
Как и другие органические соединения спирты горят с образованием углекислого газа и воды.
Таковы основные физические и химические свойства одноатомных спиртов, а в предыдущем разделе рассмотрены Способы их получения и отрасли применения
Большая Энциклопедия Нефти и Газа
Растворимость спиртов и кетонов в мыльных растворах является отрицательным явлением, поскольку она приводит к резкому увеличению доли неомыляемых компонентов в выделенных кислотах. Бороться с этим явлением весьма трудно. Раствор, образуемый высшими спиртами и кетонами, даже разбавленными натриевыми мылами карбоновых кислот, приближается, невидимому, к истинному раствору, так как при нормальных температурах он не разделяется центрифугированием и остается прозрачным. Лишь путем экстракции из водного раствора мыл серным эфиром или другими растворителями удается полностью извлечь растворенные в нем нейтральные кислородные соединения и в том числе некоторую часть углеводородов. Замечено, что наблюдаемая растворимость нейтральных кислородных соединений в мыльном растворе уменьшается при понижении концентрации применяемой щелочи и понижении их молекулярного веса. Чем концентрация щелочи больше, тем интенсивнее идет извлечение мыльным раствором нейтральных кислородных соединений из углеводородов. В связи с этим, как правило, для получения качественных кислот необходимо применять для нейтрализации карбоновых кислот слабые водные растворы едкого натра. [1]
В США определяют растворимость спирта в воде сравнением прозрачности водноспиртового раствора с прозрачностью чистой воды. Визуально сравнивают прозрачность полученного раствора с прозрачностью воды, налитой в такой же сосуд. Если прозрачность разбавленного спирта не отличается от прозрачности дистиллированной воды, то считают, что спирт выдержал испытание. [6]
Даже если мы ошиблись в оценке растворимости спирта в 10 раз, то это очень мало повлияет на конечный результат. [7]
Несмотря на то что из величин растворимости спиртов и фенолов в жидком сернистом ангидриде можно сделать заключение о наличии взаимодействия между этими органическими соединениями и сернистым ангидридом, фазовые диаграммы этих систем не изучены. Изучение УФ-спектров показало, что при взаимодействии сернистого ангидрида с простыми эфирами и спиртами 33 образуются комплексы с переносом заряда. [8]
Правда, по мере повышения молекулярного веса растворимость спиртов и кислот постепенно снижается; очевидно, однако, такое снижение вызывается встречным возрастающим влиянием углеводородных остатков, которые соответственно крайне незначительной растворимости в воде углеводородов не обладают сколько-нибудь заметно выраженным сродством к воде. Распространяя эти представления с целых молекул на их части, легко получить картину построения молекулярной пленки на поверхности воды, например из олеиновой кислоты: молекулы кислоты должны быть здесь строго ориентированы, а именно: активные группы, в данном случае карбоксилы, обращены внутрь и даже погружены в воду вследствие ярко выраженного их притяжения молекулами воды, тогда как углеводородные остатки держатся над поверхностью воды, образуя на ней нечто вроде ворса. Такая структура в настоящее время хорошо изучена на нерастворимых в воде веществах, нанесенных на ее поверхность, и может считаться совершенно несомненной. [9]
Увеличение радикала ( углеводородной части молекулы) понижает растворимость спиртов в воде, увеличение числа гидроксильных групп ее повышает. [10]
Однако если добиваются максимальной чувствительности, уменьшая объем изоамилового спирта и проводя однократное извлечение, то изменение концентрации солей будет влиять на растворимость спирта в водной фазе, заметно меняя объем. Это может привести к значительным ошибкам в определении молибдена. [14]
 Растворимость спирта в воде. Какие спирты лучше всего растворяются?
Растворимость спирта в воде. Какие спирты лучше всего растворяются?
Растворимость спиртов объясняется образованием водородных связей между молекулами спирта и воды. Молекулы воды и спирта имеют схожее строение, за счет большой электроотрицательности кислорода на его атоме появляется частично отрицательный заряд, а на атоме водорода (у спирта в гидроксогруппе) – положительный. За счет этих зарядов между молекулами и образуется водородная связь.
Все спирты легче воды (плотность ниже единицы). Температура кипения спиртов нормального строения повышается с увеличением молекулярной массы. Спирты нормального строения кипят при более высокой температуре, чем спирты с изостроением. В воде хорошо растворяются метиловый, этиловый и пропиловый спирты. С увеличением молекулярной массы растворимость спиртов снижается. Низшие спирты легче воспламеняются и горят бесцветным пламенем. Спирты с большой молекулярной массой коптят при горении. Температура кипения спиртов выше, чем галогеналкилов и углеводородов с тем же числом углеродных атомов. Это объясняется тем, что молекулы спирта, как и воды, являются ассоциированными жидкостями за счет водородных связей, возникающих между молекулами
А так же ОН-группа повышает растворимость спиртов воде, т.к. является полярной, она придает гидрофильность тому конца молекулы на котором находится. Низшие спирты (метанол,этанол) смешиваются с водой неограниченно.
Пример Вы можете посмотреть на видео
Экспериментальная часть. Опыт 1. Влияние радикала и количества гидроксильных групп на растворимость спиртов
Опыт 1. Влияние радикала и количества гидроксильных групп на растворимость спиртов.
В три пробирки внесите 4-5 капель этилового, изоамилового спиртов и глицерина. В каждую пробирку добавьте по 5-6 капель воды, взболтайте. Что наблюдали?
Опыт 2.Обнаружение воды в этиловом спирте и его обезвоживание.
В сухую пробирку внесите 10 капель этилового спирта, добавьте немного обезвоженного сульфата меди, тщательно перемешайте, дайте отстояться. Если спирт содержит воду, осадок сульфата меди окрасится в голубой цвет вследствии образования медного купороса СuSO4 · 5H2O. Сохраните обезвоженный спирт для дальнейшего опыта.
Опыт 3. Образование этилата натрия.
Поместите в сухую пробирку маленький кусочек натрия, добавьте 3 капли обезвоженного этилового спирта (из предыдущего опыта) и закройте отверстие пробирки пальцем. Тут же начинается выделение водорода.
По окончании реакции, не отрывая пальца от отверстия пробирки, поднесите ее к пламени горелки. При открытии пробирки водород воспламеняется с характерным звуком, образуя колечко голубоватого цвета. На дне пробирки остается беловатый осадок этилата натрия или его раствор.
При добавлении в пробирку 1 капли спиртового раствора фенолфталеина появляется красное окрашивание.
Напишите уравнения протекающих реакций.
Опыт 4. Окисление этилового спирта хромовой смесью.
Введите в пробирку 3-4 капли этилового спирта. Добавьте 1 каплю 2н раствора серной кислоты и 2 капли 0,5н раствора бихромата калия. Полученный оранжевый раствор нагрейте над пламенем горелки до начала изменения цвета. Обычно уже через несколько секунд цвет раствора становится синевато-зеленым. Одновременно ощущается характерный запах уксусного альдегида, напоминающий запах яблок. Метод можно применять для распознавания первичных и вторичных спиртов.
Напишите уравнения реакций.
Опыт 5. Получение этилацетата.
В сухую пробирку поместите немного порошка обезвоженного ацетата натрия (высота слоя около 2мм) и 3 капли этилового спирта. Добавьте 2 капли концентрированной серной кислоты и нагрейте осторожно над пламенем горелки. Через несколько секунд появляется характерный приятный освежающий запах уксусноэтилового эфира.



Опыт 6.Реакция глицерина с гидроксидом меди (II) в щелочной среде.
Поместите в пробирку 3 капли 0,2н раствора СuSO4, 2 капли 2н раствора NаОН и перемешайте. Появляется студенистый осадок гидроксида меди (II):
При нагревании в щелочной среде до кипения полученный гидроксид
меди (II) разлагается. Это обнаруживается по выделению черного осадка оксида меди (II):
Повторите опыт, но перед кипячением гидроксида меди (II) добавьте в пробирку 1 каплю глицерина. Взболтайте. Нагрейте до кипения полученный раствор и убедитесь в том, что раствор глицерата меди при кипячении не разлагается. Здесь образуется хелатное соединение
Опыт 7. Образовавние акролеина из глицерина.
Поместите в пробирку 3-4 кристалла бисульфата калия и 1 каплю глицерина. Нагрейте на пламени горелки. Признаком начавшегося разложения глицерина служит побурение жидкости в пробирке и появление тяжелых паров образующегося акролеина, обладающего очень резким запахом.
Опыт 8.Растворимость фенола в воде.
Поместите в пробирку 1 каплю жидкого фенола, добавьте 1 каплю воды и
взболтайте. Получится мутная жидкость – эмульсия фенола. При стоянии
такая эмульсия расслаивается, причем внизу будет раствор воды в феноле,
или жидкий фенол, а вверху – раствор фенола в воде, или карболовая вода.
Прибавляйте по каплям воду, каждый раз встряхивая пробирку, пока не
получится прозрачный раствор фенола в воде. Сохраните полученную
фенольную воду для последующих опытов.
Опыт 9.Цветные реакции на фенольную воду.
Поместите в пробирку 3 капли прозрачной фенольной воды и добавьте 1 каплю 0,1н раствора FeCl3 – появляется фиолетовое окрашивание.
Более чувствительной реакцией на фенол является цветная индофеноловая
Поместите в пробирку 1 каплю прозрачной карболовой воды. Добавьте к ней 3 капли 2н раствора NН4ОН и затем 3 капли насыщенного раствора бромной воды. Через несколько секунд на белом фоне бумаги можно заметить синее окрашивание, постепенно увеличивающееся за счет образования красящего вещества – индофенола.
Опыт 10.Образование трибромфенола.
Поместите в пробирку 3 капли бромной воды и добавьте 1 каплю прозрачной карболовой воды. Фенолы со свободными орто- и пара-положениями обесцвечивают бромную воду и образуют при этом продукты замещения, которые обычно выпадают в осадок.
Опыт 11.Доказательство кислотного характера фенола.
К остатку фенольной воды добавьте еще 1 каплю фенола и встряхните. К вновь полученной эмульсии добавьте 1 каплю 2н раствора NаОН. Моментально образуется прозрачный раствор фенолята натрия, так как он хорошо растворяется в воде.
§10. Задачи для самостоятельного решения.
1. Напишите структурные формулы следующих соединений:
3-метил-2-пентанол; 2-метил-3-бутин-2-ол; 1-фенилпропанол-1.
2. Реакцией Гриньяра получите следующие спирты:
3. Получите гидратацией соответствующих этиленовых углеводородов
а) 2-метилпентанол-2; б) 3,3-диметилбутанол-2.
4. Напишите реакции окисления вторичного бутилового спирта;
5. Подвергните 2-пентанол дегидратации, затем продукт реакции окислите водным раствором перманганата калия. Полученное соединение обработайте уксусной кислотой. Напишите уравнения реакций и назовите все продукты.
6. Получите фенол из бензола и 1-бутена через стадию образования гидроперекиси втор.бутила.
7. Опишите схему следующих превращений:
8. Расположите следующие соединения в порядке убывания кислотных свойств:
§ 23. Предельные одноатомные спирты. Гомологический ряд. Состав, строение и физические свойства (окончание)
Проблема. Чем объяснить, что вода, вещество с меньшей молекулярной массой, чем у метилового и этилового спиртов, имеет более высокую температуру кипения по сравнению со спиртами? Для решения проблемы обратимся к строению молекулы воды.

Водородные связи образуются как между молекулами воды, так и между молекулами спиртов, точнее, между атомами водорода и атомами кислорода молекул (рис. 38).
Водородная связь оказывает большое влияние на физические свойства спиртов.

Водородные связи могут возникать между молекулами разных полярных соединений, например между молекулами спирта (растворяемое вещество) и молекулами воды (растворителем). Это обеспечивает их хорошую растворимость друг в друге, что подтверждает правило «подобное растворяется в подобном» (рис. 39).
Если углеводородный радикал в молекуле спирта небольшой, то водородные связи между молекулами спирта и воды устанавливаются легко, растворимость спирта в воде (например, метанола и этанола) является неограниченной. С увеличением углеводородного радикала растворимость спиртов в воде уменьшается.
1. Спирты отличаются друг от друга по составу на гомологическую разность — СН2—. Общая формула спиртов R—ОН.
2. Строение и состав углеводородного радикала влияет на физические свойства одноатомных спиртов. С увеличением числа атомов углерода в радикале и молекулярной массы спиртов повышается их температура кипения, плотность, изменяется их агрегатное состояние (спирты с числом атомов углерода С1-12 — бесцветные жидкости, С13-20 — вязкие, сиропообразные вещества, С21 и выше — твердые вещества).
3. Спирты легче воды. Растворимость спиртов в воде различная. Первые три гомолога (метиловый, этиловый и пропиловый спирты) смешиваются с водой в любых отношениях. По мере увеличения Мr спиртов их растворимость быстро уменьшается.
4. Спирты обладают запахом: метиловый и этиловый имеют специфический алкогольный запах, другие жидкие спирты — удушливый неприятный, но есть спирты с приятным запахом розы, жасмина и др.
Предельные одноатомные спирты. Гомологический ряд метанола. Общая формула гомологов. Строение молекулы спирта. Водородная связь









 Растворимость спирта в воде. Какие спирты лучше всего растворяются?
Растворимость спирта в воде. Какие спирты лучше всего растворяются?