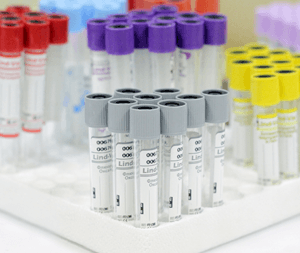
Вторичная пробирка что это
Типы и устройство вакуумных пробирок
Вакуумная система для забора крови, или вакутейнер, – это одноразовое приспособление для быстрого и безопасного взятия венозной крови. Изделие содержит добавки и реагенты для проведения анализа в строгом соответствии с необходимой дозировкой. Для изготовления используется прочный пластик, препятствующий газообмену.
Устройство вакуумных пробирок
В комплектацию изделий входит пробирка, стерильная игла, держатель. Емкость используется для забора, перевозки и хранения биоматериала. Внутри – вакуум и разные реагенты для получения необходимого материала (цельная кровь, плазма, сыворотка).
Крышка включает пробку и пластиковый корпус, защищает от проникновения воздуха. На ней выполняется маркировка, указывающая на назначение. По цвету крышки вакуумных пробирок определяют тип наполнителя. Этикетка вакутайнера содержит информацию для проведения исследований
Популярность продукции объясняется следующими преимуществами:
Благодаря герметичности устройства, взятие материала проводится максимально безопасно – лаборант не контактирует напрямую с содержимым. Толстые прочные стенки изделия выдерживают падения без нарушения целостности.
Виды вакуумных пробирок
Цвета крышек указывают на состав реагентов, находящихся внутри и тип исследования, для которого предназначено изделие.
Компания «Корвэй» предлагает ассортимент одноразовых пробирок. Мы консультируем по выбору пробирок, быстро комплектуем заказы и осуществляем доставку по адресу в Санкт-Петербурге и Ленинградской области, а также до терминала транспортной компании при отправке в другие регионы России.
Химическая посуда общего назначения (пробирки, воронки, стаканы)
Содержание
Пробирки
Пробирки представляют собой узкие цилиндрической формы сосуды с закругленным дном. Они бывают различной величины и диаметра, могут быть изготовлены из различного стекла или пластика. Обычные лабораторные пробирки изготовляют из легкоплавкого стекла, но для особых работ, когда требуется нагревание до высоких температур, пробирки изготовляют из тугоплавкого стекла или кварца.
По наличию расширения возле горловины пробирки разделяют на химические с развернутым краем (тип П1 по ГОСТ 25336-82) и биологические без развернутого края (тип П2 по ГОСТ 25336-82). Кроме обычных, простых пробирок, применяют также градуированные, центрифужные и конические (остродонные) пробирки.
Рис. 1. Пробирки лабораторные (a – цилиндрическая с развернутым краем (тип П1); б – цилиндрическая (тип П2); в – коническая (тип П3); г – градуированная с взаимозаменяемым конусом (тип П4); д – с отводом; е – пластиковая с завинчивающейся крышкой).
Для хранения пробирок, находящихся в работе, служат специальные пластмассовые или металлические штативы.
Рис. 2. Штативы для пробирок (a – пластмассовый, б – металлический).
Пробирки применяют для проведения главным образом аналитических или микрохимических работ. При проведении реакций в пробирке реактивы не следует применять в слишком большом количестве. Совершенно недопустимо, чтобы пробирка была наполнена до краев. Реакцию проводят с небольшими количествами веществ (достаточно бывает 1/4 или даже 1/8 емкости пробирки).
Иногда в пробирку нужно ввести твердое вещество (порошки, кристаллы и т. п.). Для этого полоску бумаги шириной чуть меньше диаметра пробирки складывают вдвое по длине и в полученный совочек насыпают нужное количество твердого вещества. Пробирку держат в левой руке, наклонив ее горизонтально, и вводят в нее совочек почти до дна. Затем пробирку ставят вертикально и слегка ударяют по ней. Когда все твердое вещество высыпется, бумажный совочек вынимают.
Для перемешивания налитых реактивов пробирку держат большим и указательным пальцами левой руки за верхний конец и поддерживают ее средним пальцем, а указательным пальцем правой руки ударяют косым ударом по низу пробирки. Этого достаточно, чтобы содержимое ее было хорошо перемешано. Совершенно недопустимо закрывать пробирку пальцем и встряхивать ее в таком виде; при этом можно не только ввести что-либо постороннее в жидкость, находящуюся в пробирке, но иногда и повредить кожу пальца, получить ожог и пр. Если пробирка наполнена жидкостью больше чем на половину, содержимое перемешивают стеклянной палочкой.
Если пробирку нужно нагреть, ее следует зажать в держателе. При неумелом и сильном нагревании пробирки жидкость быстро вскипает и выплескивается из нее, поэтому нагревать нужно осторожно. Когда начнут появляться пузырьки, пробирку следует отставить и, держа ее не в пламени горелки, а около него или над ним, продолжать нагревание горячим воздухом. При нагревании открытый конец пробирки должен быть обращен в сторону от работающего и от соседей по столу.
Рис. 3. Нагрев пробирки в держателе.
Когда не требуется сильного нагрева, пробирку с нагреваемой жидкостью лучше опустить в горячую воду. Если работают с маленькими пробирками (для полумикроанализа), то нагревают их только в горячей воде, налитой в стеклянный стакан соответствующего размера (емкостью не больше 100 мл).
Воронки
Воронка — приспособление для переливания жидкостей и пересыпания порошков через узкие приёмные отверстия, фильтрования, а также дозирования различных веществ. Имеет форму полого конуса, сужение которого продолжает трубка.
Цветовая кодировка вакуумных пробирок VACUETTE
Цветовая кодировка вакуумных пробирок VACUETTE
В современном мире все больше внимания уделяется лабораторным исследованиям и качеству их проведения.
На что больше всего обращает внимания любой человек, увидевший пробирку? Яркий цвет колпачка! Это не просто дизайнерское решение, это удобство медсестер и лаборантов. Данные требования отражены в ГОСТ ISO 6710-2011 «Контейнеры для сбора образцов венозной крови одноразовые. Технические требования и методы испытаний» и ГОСТ Р 53079.4-2008 «Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа».
Итак, что же означают эти яркие колпачки. Каждая пробирка имеет определенный реагент или же не имеет его, что тоже кодируется определенным цветом. Рассмотрим подробнее, каждый цвет и реагент.
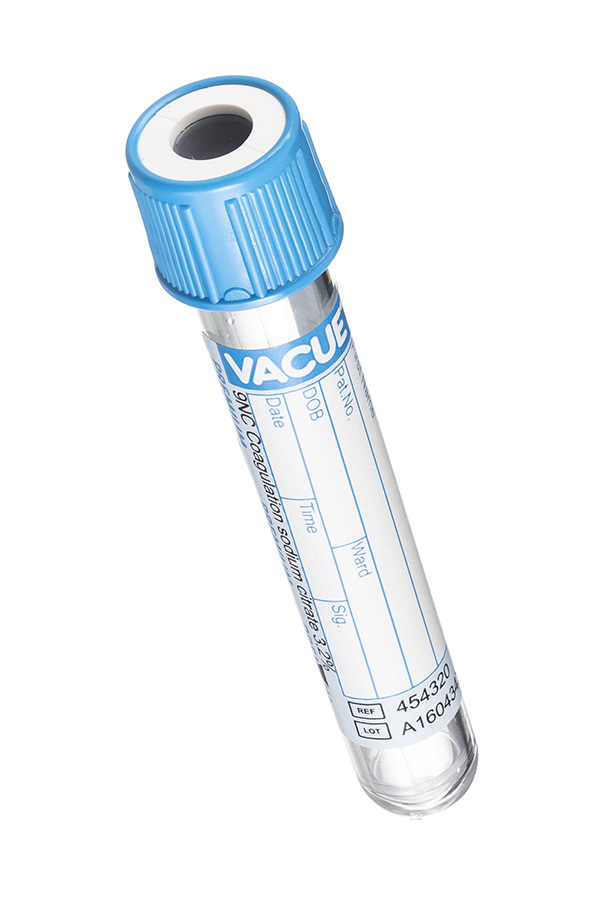
1. Пробирка с голубой крышкой (с цитратом натрия).
В данной пробирке имеется забуференный раствор натрия цитрата в возможных процентных соотношениях 3,2 и 2,8. Этот тип пробирок используется для исследования системы гемостаза (коагулограмма). В данный тип исследования входят такие показатели, как: АЧТВ, протромбин, фибриноген, тромбиновое время и другие.
Также пробирки с голубой крышкой могут содержать в себе реагент CTAD. Настоящий реагент используется для тех же исследований, но его применяют при исследовании пациентов, получающих антикоагулянтную терапию. В состав реагента входит забуференный цитрат натрия, теофиллин, аденозин и дипиридамол.
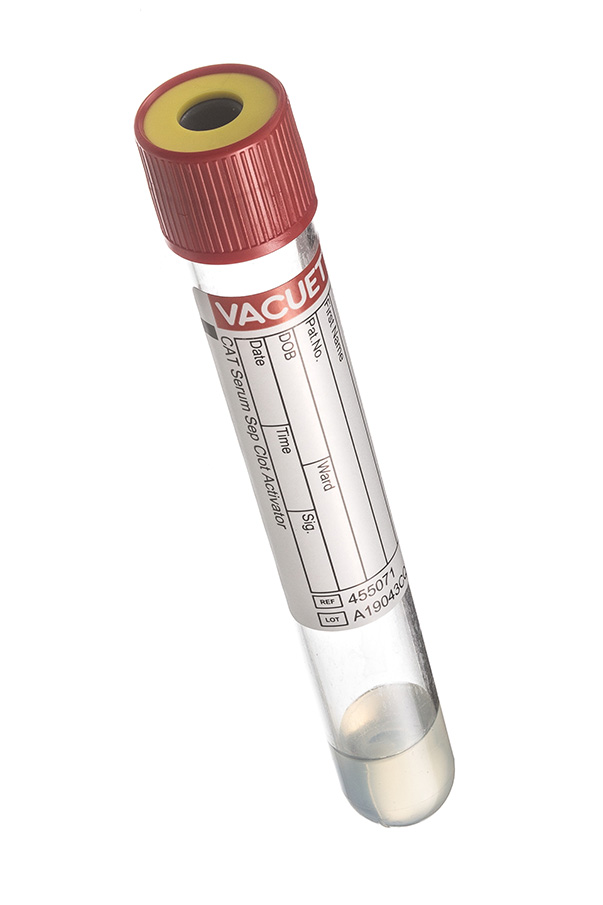
2. Пробирка с красной крышкой (с диоксидом кремния и разделительным гелем).
Данные пробирки используют для исследования сыворотки крови. Сыворотка крови, в отличие от плазмы, не содержит фибриногена, следовательно, чтобы получить пробу сыворотки, нужно активировать процесс свертывания пробы.
В пробирках с красной крышкой происходит активация данного процесса за счет диоксида кремния (SiО2) нанесенного на внутренние стенки в виде микрочастиц. Помимо реагента, в пробирках данного типа может содержаться разделительный гель. Он создает надежный барьер между сгустком и сывороткой, что важно во время хранения и транспортировки пробы. Пробирки с активатором свертывания используют для исследований в: биохимии, иммунологии, микробиологии, серологии и другие.
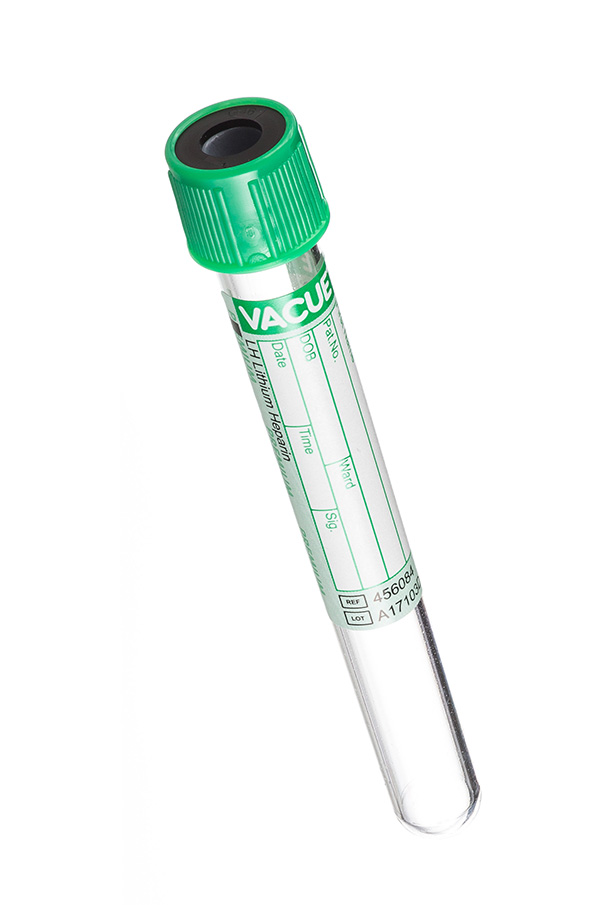
3. Пробирка с зеленой крышкой (с гепарином).
В отличие от пробирок с красной крышкой, служат для получения плазмы.
В них должен содержаться реагент, блокирующий процесс свертывания. В пробирках с зелеными крышками содержится антикоагулянт гепарин (натрий гепарин, литий гепарин, аммоний гепарин). В пробирках этого типа, также может содержаться гель для большей стабильности образца. Он создает надежный барьер между плазмой и форменными элементами во время транспортировки. Пробирки с антикоагулянтом могут использоваться для таких исследований как: электролитный состав крови, газовый состав крови, содержание алкоголя в крови.
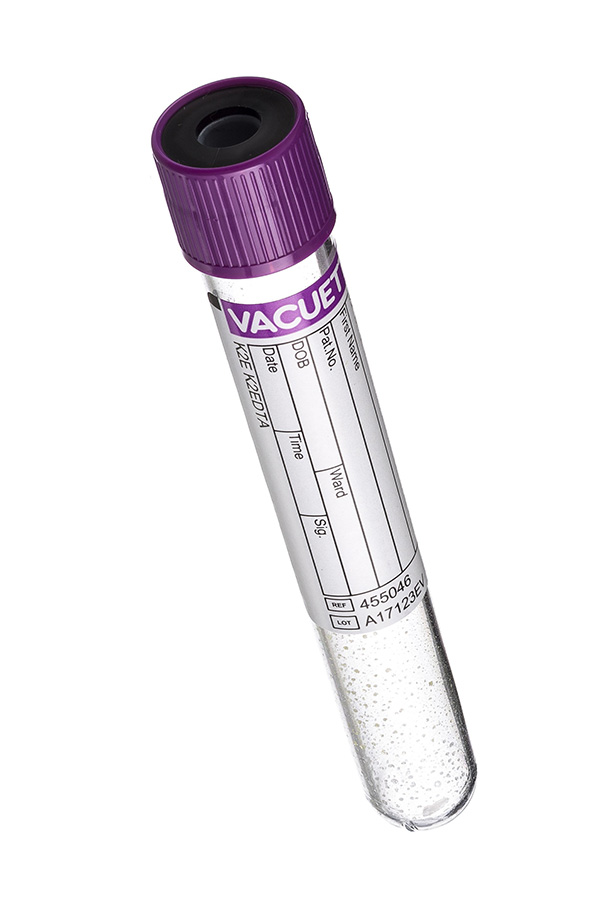
4. Пробирка с фиолетовой крышкой (ЭДТА).
Реагент, содержащийся в данных пробирках связывает ионы кальция и блокирует процесс свертывания. Реагент состоит из этилендиаминуксусной кислоты (ЭДТА). ЭДТА-к2 или ЭДТА-к3 нанесена на внутренние стенки пробирки. Эти пробирки переназначены для гематологических исследований (качественный и количественный состав крови). Для молекулярно-генетических исследований и определения вирусной нагрузки применяются пробирки с ЭДТА и разделительным гелем.
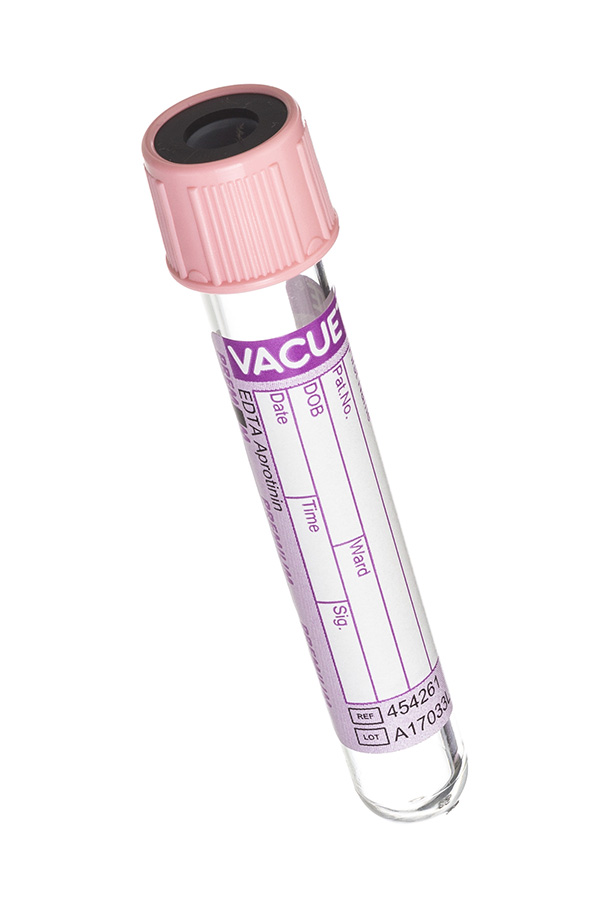
5. Пробирка с розовой крышкой (с апротинином и КЭДТА)
В данной пробирке содержится реагент КЭДТА и апротинин (устойчивый белок, выделенный из бычьих легких) – ингибитор тканевых и сывороточных протеолитических ферментов (трипсин, хемитрипсин, плазмин, калликреин). Этот реагент помогает стабилизировать нестабильные и проблемные аналиты (например, некоторые гормоны).
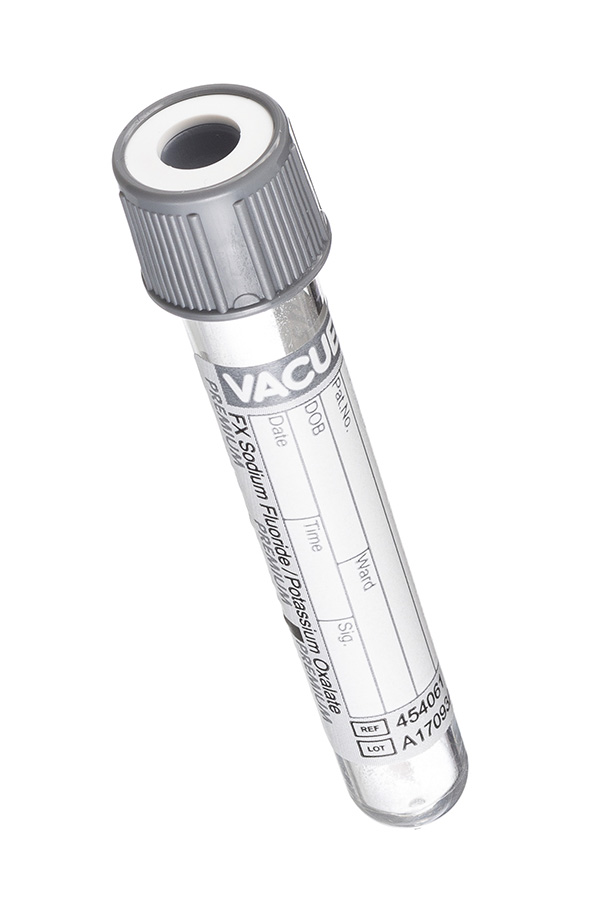
6. Пробирка с серой крышкой (с разными реагентами: лития гепарин и монойодацетат или натрия фторид и калия оксалат).
Специальные пробирки для исследования глюкозы с несколькими вариантами реагентов: монойодацетат и лития гепарин, натрия фторид и калия оксалат, натрия фторид и КзЭДТА. Благодаря тому, что реагент в своем составе содержит не только антикоагулянт, но и стабилизатор уровня глюкозы, проба может сохранять свою стабильность до 48 часов при комнатной температуре.
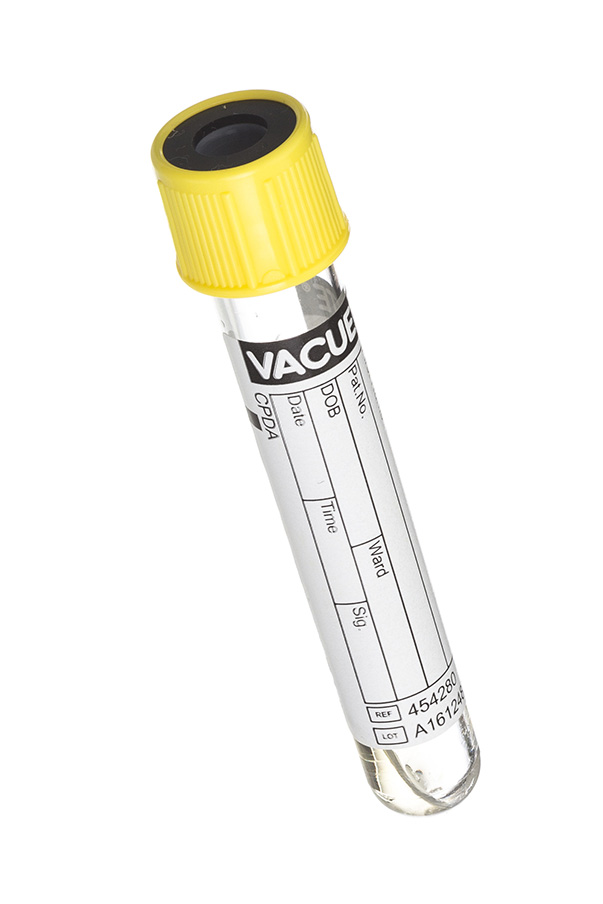
7. Пробирки с желтой крышкой (с лимонной кислотой, натрия цитратом, декстрозой).
8. Пробирки с черной крышкой (с цитратом натрия).
Используются для определения СОЭ и в составе реагента имеют 3,2% цитрат натрия.
Данный материал носит ознакомительный характер и не может использоваться в качестве обучающего.
Вторичная пробирка что это
Организация преаналитического этапа при централизации лабораторных исследований
Доктор медицинских наук А. А. Кишкун, доктор медицинских наук, профессор А. Ж. Гильманов, доктор медицинских наук, профессор Т. И. Долгих, Д. А. Грищенко, Т. Г Скороходова
Продолжение. Начало читайте в номере 2, 2014 г.
“Современной лабораторной диагностики”
7. Приспособления, используемые для взятия проб крови
7.1. Общие положения
7.1.1. Для взятия проб крови на лабораторные исследования предпочтительно использовать вакуумные системы. Использование вакуумных систем для взятие проб крови на лабораторные исследование регламентировано целым рядом руководящих документов:
• Национальный стандарт Российской Федерации ГОСТ Р 53079.4 – 2008. “Технологии медицинские лабораторные. Обеспечение качества клинических лабораторных исследований. Часть 4.
Правила ведения преаналитического этапа”. Введен в действие с 01.01.2010 года.
• “Правила и методы исследований и правила отбора образцов донорской крови, необходимые для применения и исполнения технического регламента о требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии”, утверждены постановлением Правительства Российской Федерации от 31 декабря 2010 г. № 1230.
• Национальный стандарт Российской Федерации ГОСТ Р ИСО 6710 – 2009. “Контейнеры для сбора образцов венозной крови одноразовые”. Утвержден и введен в действие Приказом Федерального агентства по техническому регулированию и метрологии от 3 июля 2009 г. № 232-ст.
7.2. Общие характеристики вакуумных систем для взятия проб крови
7.2.1. Вакуумная система для взятия крови состоит из трех основных элементов, соединяющихся между собой в процессе взятия крови (рис. 7):
• стерильной одноразовой пробирки с крышкой и дозированным содержанием вакуума;
• стерильной одноразовой двусторонней иглы с визуальной камерой (или без камеры), закрытой с обеих сторон защитными колпачками;
• одно- или многоразового иглодержателя.
7.2.2. Под действием вакуума кровь втягивается через иглу напрямую из вены в пробирку.
7.2.3. В течение 2-3 суток перед использованием вакуумные системы для взятия крови должны храниться при комнатной температуре.
7.2.4. Оптимальной для хранения вакуумных систем является температура +4 – +25°С.
7.2.5. При хранении вакуумных систем избегайте воздействия прямого солнечного света, особенно при высоких температурах (выше +25°С). Избегайте складирования вблизи отопительных приборов.
7.2.7. Если пробирки хранились ниже 0°С, то перед использованием их необходимо выдержать при комнатной температуре в течение как минимум 48 часов.
7.2.8. При длительном хранении при температурах +40 – +50°С может произойти деформация пробирок. Следует иметь в виду, что большие перепады температур могут снизить эффективность пробирок за счет потери вакуума и спровоцировать неверные результаты анализов.
Таблица 1. Выбор кодированных цветом вакутейнеров с антикоагулянтом
Цвет головки пробирки
Ничего не добавлено
Для получения сыворотки
Для получения сыворотки, разделяет форменные элементы крови и сыворотку
Для получения плазмы и форменных элементов крови
Для получения цельной крови
(связывается кальций)
Черный/розовато-лиловый
Для определения СОЭ по Вестергрену
Бледно-голубой/зеленый
3,13 % забуференный цитрат натрия
Для исследования системы гемостаза
7.3. Общие характеристики вакуумных пробирок
Вакуумные пробирки производятся из пластика и стекла. Пластиковые пробирки не бьются, поэтому предпочтительнее для взятия проб крови при централизации лабораторных исследований. В пластиковых пробирках удобнее транспортировать образцы и их легче утилизировать. Недостатком пластиковых пробирок является то, что при длительном хранении некоторые жидкие наполнители в них могут испаряться, поэтому в таких случаях необходимо использовать только стеклянные пробирки.
Все вакуумные пробирки стерильные, предназначены для одноразового использования, выпускаются разных объемов и размеров от 1,8 до 10 мл. Объем забираемой пробы обеспечивается точно дозированным вакуумом, под действием которого кровь поступает в пробирку в процессе венепункции. В пробирках используются различные химические наполнители для проведения разных видов анализов. В качестве наполнителей в вакуумных пробирках используются активаторы свертывания (тромбин, кремнезем), антикоагулянты (ЭДТА, цитрат натрия, гепарин и т.д.), разделительные гели и др.
Верхний колпачок вакуумной пробирки закодирован цветом, который говорит о том, какой специфический антикоагулянт имеется в вакутейнере, или вакутейнер специально предназначен для взятия крови на определенные параметры. В табл. 1 приведен список антикоагулянтов и цветная кодировка вакутейнеров для наиболее распространенных видов лабораторных исследований.
7.3.1. Вакуумные пробирки для гематологических исследований
В качестве антикоагулянта в вакуумных пробирках для гематологических исследований цельной крови используется калиевая соль ЭДТА. В вакуумных пробирках антикоагулянт находится в виде порошка K2 ЭДТА или раствора K3 ЭДТА, концентрация которого достигает 1,8 мг/мл в полностью заполненных кровью пробирках.
Порошок K2 ЭДТА наносится распылением на внутреннюю поверхность пластиковых пробирок. K3 ЭДТА добавляется в стеклянные или пластиковые пробирки в виде 7,5% раствора, если объем пробы 3 мл (1,1 % разбавление пробы).
Для обеспечения правильного соотношения кровь/антикоагулянт пробирка с ЭДТА должна заполняться точно до указанного объема (+10% от указанного на этикетке). Недостаток ЭДТА в пробе приводит к ее коагуляции, а избыточная концентрация ведет к сморщиванию клеток крови и искажению таких клинических показателей, как гематокрит, размер клеток и т.д.
При централизации гематологических исследований предпочтительно использовать вакуумные пробирки с К2 ЭДТА. Сразу после взятия крови в вакуумную пробирку с ЭДТА ее необходимо тщательно перемешать, переворачивая 8–10 раз. Недостаточное перемешивание также может привести к агрегации тромбоцитов, образованию микросгустков или коагуляции.
7.3.2. Вакуумные пробирки для измерения СОЭ
Для измерения СОЭ используются стерильные стеклянные вакуумные пробирки 120 мм длиной и диаметром 10,25 мм, с черной или розовато-лиловой крышкой. Наполнитель – раствор цитрата натрия 1,25 мл, концентрация 0,105 моль/л. При полном заполнении пробирки кровью (5,2 мл) достигается соотношение кровь: антикоагулянт, равное 4:1. Измерение СОЭ проводится в закрытой первичной вакуумной пробирке, то есть пробу не нужно переливать и дополнительно разбавлять. В полностью заполненной пробирке высота пробы составляет 100 мм.
7.3.3. Вакуумные пробирки для получения сыворотки
Сыворотка крови – наиболее часто используемый материал в КДЛ. Для получения сыворотки кровь должна полностью свернуться. Полное свертывание крови у пациентов, не принимающих антикоагулянты, происходит в среднем в течение 1 часа. Дальнейшее уплотнение сгустка происходит при центрифугировании. Для получения качественной пробы важно выдержать полное время свертывания крови. Если же кровь свернулась не полностью, то оставшийся после центрифугирования фибрин может изменять оптическую плотность пробы, а также засорять зонды анализаторов. Для ускорения процесса коагуляции используются активаторы свертывания – кремнезем и тромбин. В стеклянных пробирках функцию активатора свертывания выполняет непосредственно сама стеклянная стенка пробирки, так как в состав стекла входит кремний, ускоряющий процесс коагуляции.
В пластиковые пробирки добавляются активаторы свертывания: кремнезем и/или тромбин. Внутренние стенки пробирок, как правило, покрыты силиконом для предотвращения адгезии клеток крови к поверхности стенок.
Микронизированный кремнезем – активатор свертывания, действующий на тромбоцитарное звено и плазменный гемостаз. Активатор свертывания используется в сывороточных пластиковых пробирках с гелем и без геля. Кремнезем – порошок, распыленный на внутренние стенки пробирки, который визуально определяется в виде мутного напыления внутри пробирки. Частицы кремнезема нерастворимы. Они наносятся на поверхность пробирки в виде спрея водного раствора с поверхностно-активным веществом (ПАВ). ПАВ улучшает дисперсию частиц кремнезема, а также способствует снижению адгезии клеток на стенки пробирки. Пробирки с активатором свертывания кремнеземом требуют обязательного перемешивания (5–6 раз). Перемешивание уменьшает время свертывания и усиливает стягивание сгустка и, следовательно, увеличивает объем получаемой сыворотки. Перемешивание также уменьшает концентрацию ПАВ и кремнезема в сыворотке (они остаются внутри сгустка).
Для получения сыворотки используются вакуумные пробирки без геля (имеют красно/белую кодировку крышек) и гелем (имеют желтую кодировку крышек).
7.3.3.1. Вакуумные пробирки для получения сыворотки без геля
Вакуумные пробирки для получения сыворотки имеют красно/белую кодировку крышек различаются и бывают двух видов – стеклянные и пластиковые. Кремнезем добавляется только в пластиковые пробирки, стеклянные вообще не содержат наполнителя. После взятия пробы крови в пластиковые пробирки, ее следует перемешать путем переворачивания 5–6 раз для лучшего контакта с активатором свертывания. Прежде чем центрифугировать пробирки с сывороткой, необходимо дождаться полного свертывания крови. Минимальное время полного свертывания в пробирках этого типа – 60 минут. Условия центрифугирования: 1300 g в течение 10 минут.
7.3.3.2. Вакуумные пробирки с гелем для получения и отделения сыворотки
Вакуумные пробирки с гелем производятся только из пластика, и их можно отличить по желтой крышке. С целью лучшего отделения сгустка крови от сыворотки в пробирки добавлен гель – специальный материал, предназначенный для образования стойкого барьера между клеточными компонентами крови и сывороткой во время центрифугирования). Гель специально расположен в пробирке таким образом (под наклоном), чтобы во время центрифугирования облегчалось его механическое движение и отделение сгустка крови от сыворотки. Специфический удельный вес геля подобран таким образом (между плотностью форменных элементов крови и плотностью сыворотки), что при центрифугировании гель “всплывает” над эритроцитами и располагается между форменными элементами крови и сывороткой. Гель твердеет, и образуется барьер между форменными элементами крови и сывороткой. Устойчивый барьер образуется через 5 минут после окончания центрифугирования пробы. В пробирку с гелем добавлен кремнезем в количестве, обеспечивающем полное свертывание крови в течение 30 мин. После взятия пробы крови в вакуумные пробирки с гелем, ее следует перемешать путем переворачивания 5–6 раз. Условия центрифугирования: 1500–2000 g в течение 10 мин. пробирки с гелем нельзя центрифугировать повторно, во избежание гемолиза пробы. При центрифугировании вакутейнеров с гелем нельзя пользоваться центрифугами с угловыми роторами, так как часть эритроцитов может попасть в сыворотку.
Преимущества вакуумных пробирок с гелем в отношении повышения эффективности выполнения анализов:
• сокращается время проведения анализа (нет необходимости ждать 1 час для завершения образования сгустка);
• “выход” сыворотки при центрифугировании больше (особенно важно это в педиатрии);
• центрифугировать надо только один раз;
• после центрифугирования пробу можно спокойно транспортировать без отделения от форменных элементов крови;
• возможно проведение анализа в первичной пробирке;
• можно переливать сыворотку в другие пробирки без применения пипеток;
Преимущества вакуумных пробирок с гелем в отношении повышения стабильности аналитов и чистоты образца:
• снижается вероятность гемолиза при центрифугировании;
• снижается вероятность присутствие латентного фибрина в сыворотке;
• увеличивается срок хранения образца;
• повышается стабильность аналитов (ферментов, электролитов, гормонов и др.) с 2 часов до 3 и более дней; например, стабильность АСТ, ЛДГ и калия сохраняется в течение 6 суток при температуре 4°C;
• возможно использование сыворотки для специальных анализов, особенно для исследования гормонов, таких как эстрадиол и прогестерон;
• возможно проведение лекарственного мониторинга в отношении целого ряда фармакологических препаратов;
• отсутствие воздействия на пробу факторов окружающей среды (микроорганизмы, окисление и т.д.);
• более точное соответствие полученных in vitro результатов исследования состоянию внутренней среды организма пациента (состоянию in vivo).
В силу приведенных преимуществ, использование вакуумных пробирок с гелем приводит к значительному снижению числа ошибок на преаналитическом этапе, поэтому их предпочтительно использовать при централизации лабораторных исследований.
7.3.3.3. Вакуумные пробирки для получения сыворотки с тромбином
Тромбин является природным активатором свертывания и значительно сокращает время образования сгустка до 3–5 минут. Тромбин используется в пробирках с оранжевой крышкой и может применяться для проведения всех исследований сыворотки, но чаще всего используется для экспресс-анализов. В пробирках с тромбином получается более очищенная сыворотка, чем в обычных пробирках. Производятся стеклянные пробирки, в которых содержится только тромбин, и пластиковые пробирки, в которых используется комплексный наполнитель – тромбин с кремнеземом. Также производятся пробирки с тромбином и гелем, время свертывания крови в которых 3–5 минут. После заполнения пробирки с тромбином кровью, ее следует обязательно перемешать путем переворачивания 5–6 раз. Полное свертывание крови происходит за 5 минут. Условия центрифугирования: пробирки без геля 1300 g в течение 10 минут, пробирки с гелем 1300–1500 g в течение 10 минут.
Пробирки с гелем нельзя повторно центрифугировать. При использовании пробирок с тромбином повышается качество пробы и снижается время, затрачиваемое на проведение теста в лаборатории. Эти пробирки являются идеальным решением для пациентов, находящихся на гемодиализе и получающих терапию гепарином.
7.3.4. Вакуумные пробирки для получения плазмы
В практике КДЛ для получения плазмы использую вакуумные пробирки с гепарином (наиболее часто для исследования биохимических показателей и показателей клеточного иммунитета) и с жидким трехзамещенным цитратом натрия (для исследования показателей гемостаза).
Основное действие гепарина – блокирование активности тромбина и, следовательно, торможение перехода растворимого фибриногена в нерастворимый фибрин. Гепаринизированную плазму обычно используют для биохимического и иммунологического анализа. Основное преимущество использования гепаринизировнной плазмы перед сывороткой заключается в сокращении времени на проведение анализа, поскольку в случае плазмы не нужно выжидать время полного свертывания крови. Пробирки с гепарином рекомендуется использовать в лабораториях с большим ежедневным потоком биохимических и/или иммунологических анализов. В вакуумных пробирках используется литиевая или натриевая соль гепарина, распыленная на внутреннюю поверхность пробирки. Гепарин лития используется для клинических анализов крови, гепарин натрия – при подборе дозы и мониторинге терапии препаратами лития. Концентрация гепарина – 17 МЕ на 1 мл пробы.
Крышки в вакуумных пробирках с гепарином имеют цветовую кодировку зеленый/оранжевый и бывают без геля и с гелем.
При взятии образцов крови для исследования системы гемостаза стандартным антикоагулянтом является цитрат натрия, механизм действия которого основан на связывании ионизированного кальция крови, что ведет к обратимому блокированию процесса коагуляции.
7.3.4.1. Вакуумные пробирки для коагулологических исследований
В вакуумных пробирках для исследования системы гемостаза используется жидкий трехзамещенный цитрат натрия в концентрации:
• 0,105 моль/л; 3,13% (31,3 г/л);
• 0,109 моль/л; 3,20% (32,0 г/л);
• 0,129 моль/л; 3,80% (38,0 г/л).
При централизации исследований показателей гемостаза предпочтительнее использовать 0,109 моль/л (3,20%) тринатрийцитрат лимонной кислоты. Дозировка вакуума в пробирках для коагулологических исследований подобрана таким образом, чтобы обеспечивалось смешивание цитрата натрия с образцом в объемных долях 1:9 (1 часть цитрата и 9 частей крови). Выпускаются как стеклянные, так и пластиковые пробирки с цитратом натрия и крышкой бледно голубого/зеленого цвета.
Для предотвращения испарения цитрата натрия при хранении пластиковые пробирки производятся рядом компаний по особой технологии и имеют двойные стенки. Для проведения некоторых коагулологических анализов также могут использоваться пробирки с комплексным наполнителем Цитрат натрия/Теофиллин/Аденозин/Дипиридамол). Пробирки с этим наполнителем используются для обычных рутинных коагуляционных тестов, мониторинга терапии гепарином, анализе антигепаринового фактора тромбоцитов IV, β-тромбоглобулина. Пробирки с комплексным наполнителем не используются для анализа агрегации тромбоцитов. Соотношение антикоагулянт/кровь в этих пробирках остается 1:9 при концентрации раствора цитрата 0,109 М. Пробирки с комплексным наполнителем обеспечивают стабильность гепаринизированных образцов до 4 часов при комнатной температуре и соответствие результатов “in-vitro” концентрациям антикоагулянта “in-vivo”.
При взятии проб крови в несколько пробирок у одного пациента пробирка с цитратом должна заполняться до пробирки с активатором свертывания. Очень важно соблюдать правильное соотношение кровь-антикоагулянт в пробе с цитратом. Недостаток цитрата в пробе ведет к образованию микросгустков и/или коагуляции пробы, а избыток цитрата – к искажению результатов анализа за счет связывания кальция из реагентов. Сразу после взятия образца пробирку с цитратом необходимо аккуратного перемешать не менее 5 раз для предотвращения образования микросгустков.
• стеклянные пробирки: 1500 g в течение 15 мин.
• пластиковые пробирки: 2000–2500 g в течение 10–15 мин.
7.3.4.2. Вакуумные пробирки с гепарином без геля
Вакуумные пробирки с гепарином без геля производятся как с гепарином лития, так и с гепарином натрия, цвет крышки – зеленый/оранжевый. Сразу же после заполнения пробирки и извлечения ее из держателя пробу необходимо тщательно перемешать путем переворачивания 8–10 раз. Центрифугирование следует производить сразу после взятия крови. Условия центрифугирования: 1300 g в течение 10 мин.
7.3.4.3. Вакуумные пробирки с гепарином и гелем
В пробирках с гелем используется только литиевая соль гепарина, цвет крышки – светло-зеленый. Сразу же после заполнения пробирки и извлечения ее из держателя пробу необходимо тщательно перемешать путем переворачивания 8–10 раз. Центрифугирование следует производить сразу после взятия крови. Условия центрифугирования: 1500–2000 g в течение 10 мин.
Преимущества использования вакуумных пробирок с гепарином и гелем:
• гелевый барьер способствует стабилизации большинства аналитов в течение 24 ч при комнатной температуре (кроме СО2 и глюкозы);
• после центрифугирования наблюдается существенное снижение количества эритроцитов, лейкоцитов и тромбоцитов в плазме;
• после центрифугирования наблюдается уменьшение количества видимых невооружен-
ным глазом агрегатов клеток/фибрина в плазме;
• после центрифугирования плазму можно транспортировать в первичной пробирке без дополнительного аликвотирования пробы.
7.3.5. Вакуумные пробирки для исследования ферментов и гормонов (с апротинином)
Для сохранения нестабильных ферментов и гормонов белковой природы в вакуумных пробирках вместе с антикоагулянтом ЭДТА используется ингибитор протеиназы апротинин. Апротинин ингибирует следующие протеолитические ферменты: каликреин, химотрипсин, плазмин, лизосомальные ферменты. Активность апротинина выражается в каликреин ингибирующих единицах (KИЕ). Апротинин содержится в количестве
250 KИЕ в пробирках объемом 5 мл и 500 KИЕ в пробирках объемом 10 мл с розовой пробкой. Апротинин применяется для стабилизации таких гормонов и ферментов, как, например, ренин, АКТГ (адренокортикотропный гормон), глюкогон, соматостин, кальцитонин, остеокальцин, β-эндорфин, секретин, нейротензин, вазоактивный интестинальный пептид.
7.3.6. Вакуумные пробирки для стабилизации глюкозы
Концентрация глюкозы в пробе цельной крови уменьшается при хранении каждый час на 10%. Если центрифугирование и отделение образца от клеток крови для анализа глюкозы не может быть проведено в течение 2 часов после взятия крови, то необходимо наряду с антикоагулянтом использовать стабилизатор глюкозы, который предотвращает ее утилизацию эритроцитами. Для стабилизации глюкозы используются вакуумные пробирки с серой крышкой и следующими наполнителями:
• фторид натрия и оксалат калия;
• йодоацетат и лития гепарин;
• фторид натрия и ЭДТА.
Оксалат калия, гепарин или ЭДТА используются как антикоагулянты. Механизм действия оксалата калия схож с ЭДТА (связывание кальция). При наличии стабилизатора концентрация глюкозы остается стабильной в пределах 24 часов (фторид натрия) и до 48 часов (йодацетат). Фторид ингибирует гликолиз путем блокирования активности энзима энолазы. Если этот метаболический процесс не подавлять, то он продолжается in vitro вследствие потребления красными кровяными клетками глюкозы плазмы, что приводит к снижению ее концентрации в крови. Пробирки со стабилизатором глюкозы должны заполняться полностью до указанного на них объема, избыток оксалата в пробе может вызвать гемолиз. После взятия пробы пробирки следует перемешать, переворачивая 6–8 раз. Поскольку пробирки с фторидом/оксалатом особенно подвержены гемолизу, их необходимо перемешивать с особой осторожностью. Центрифугирование следует производить сразу после взятия крови. Условия центрифугирования: 1300 g в течение 10 мин.
7.3.7. Вакуумные пробирки для анализа микроэлементов
Микроэлементы находятся в крови в крайне малых количествах, поэтому материалы, используемые для взятия, хранения и транспортировки пробы, должны исключать возможность загрязнения образца инородными примесями. Специальные вакуумные пробирки для определения микроэлементов с крышкой синего цвета снижают вероятность попадания в пробу инородных микроэлементов из внешней среды и расходных материалов. Вакуумные пробирки для анализа микроэлементов крови выпускаются двух видов:
• пробирки без наполнителя;
• пробирки с К2 ЭДТА.
Вакуумные пробирки для анализа микроэлементов предназначены для:
• исследования цинка, железа, меди, кальция, селена в крови;
• токсикологических исследований свинца, кадмия, мышьяка, сурьмы.
Важно отметить, что при производстве обычных пробирок антикоагулянт ЭДТА обычно загрязняется ионами металлов, которые могут исказить результаты анализа. Технология производства пробирок для определения микроэлементов с ЭДТА не допускает загрязнения антикоагулянта посторонними примесями, что обеспечивает высокое качество исследований. Однако следует помнить, что пробирки не стандартизуются по содержанию алюминия, так как этот элемент содержится в материале, из которого сделана пробирка, а также в пробках и иглах. Загрязнение образца во время взятия крови может также происходить за счет иглы, так как иглы, сделанные из нержавеющей стали, могут содержать примеси хрома и марганца. Использование силиконизированных игл значительно снижает вероятность загрязнения пробы через иглу. При анализе сыворотки на наличие микроэлементов в следовых количествах не рекомендуется использовать стандартные вакуумные пробирки для получения сыворотки с красно/белой кодировкой крышек, так как они содержат повышенную концентрацию цинка и других микроэлементов. Следует также избегать использования капиллярной крови, так как при ее взятии повышается вероятность загрязнения образца инородными микроэлементами и другими примесями. Взятие образца крови и пробоподготовка производятся в соответствии с используемым наполнителем. При взятии крови у одного пациента сразу в несколько вакуумных пробирок необходимо соблюдать порядок их заполнения: пробирку для микроэлементов следует заполнять последней для снижения вероятности загрязнения пробы через иглу. Центрифугирование следует производить сразу после взятия крови. Условия центрифугирования: 1300 g в течение 10 минут.
7.3.8. Вакуумные пробирки для получения плазмы и проведения анализов методами молекулярной диагностики
Пластиковые стерильные вакуумные пробирки для получения плазмы и проведения анализов методами молекулярной диагностики используются для взятия проб крови, пробоподготовки, транспортировки и хранения образца неразбавленной плазмы.
Вакуумные пробирки для получения плазмы и проведения анализов методами молекулярной диагностики имеют крышку жемчужно-белого цвета и применяются для определения вирусной нагрузки при ВИЧ-инфекции и вирусных гепатитах. Они также используются для проведения анализов методами молекулярной диагностики, например, ПЦР. Такие пробирки идеально подходят в случае необходимости хранения и транспортировки плазмы. Вакуумные пробирки для получения плазмы и проведения анализов методами молекулярной диагностики содержат антикоагулянт К2 ЭДТА в виде порошка, распыленного на стенках пробирки. Концентрация антикоагулянта в образце – 1,8 мг/мл при полном заполнении кровью объема, указанного на этикетке. В пробирках также содержится полиэстерный гель, позволяющий отделить плазму от клеток крови во время центрифугирования. Супернатант (плазма) практически свободен от эритроцитов и гранулоцитов, концентрация лимфоцитов и моноцитов в нем незначительна. Следует отметить, что в плазме, приготовленной в таких пробирках, концентрация тромбоцитов может быть выше, чем в цельной крови.
Преимущества использования вакуумных пробирок для получения плазмы и проведения анализов методами молекулярной диагностики:
• возможность хранения образца в первичной пробирке;
• повышается качество образца за счет более полного осаждения клеток крови;
• повышается воспроизводимость результатов анализов РНК вирусов СПИД и гепатита;
• снижается риск контаминации образца в стерильных закрытых пробирках;
• повышается безопасность медицинских работников за счет исключения контакта с кровью пациента.
Вакуумные пробирки для получения плазмы и проведения анализов методами молекулярной диагностики считаются “золотым стандартом” при исследовании вирусной нагрузки методами молекулярной диагностики.
Взятие образца и пробоподготовка.
1. Кровь в вакуумные пробирки для получения плазмы и проведения анализов методами молекулярной диагностики берется из вены с помощью вакуумной системы.
2. Сразу же после заполнения пробирки и извлечения ее из держателя кровь необходимо тщательно перемешать с антикоагулянтом во избежание образования микросгустков. Для этого пробирку следует аккуратно перевернуть 8–10 раз. Нельзя встряхивать пробирку, так как это может вызвать пенообразование и гемолиз.
3. Образец до центрифугирования следует хранить при комнатной температуре не более 2-х часов, вдали от солнечного света и отопительных приборов.
4. Центрифугировать образец крови в вакуумных пробирках для получения плазмы и проведения анализов методами молекулярной диагностики нужно в течение 10 минут при относительной центробежной силе 1100 g при комнатной температуре. Если до центрифугирования пробирка хранилась в холодильнике, ее следует нагреть до комнатной температуры, поскольку динамические свойства геля ухудшаются при низких температурах. Во время центрифугирования формируется устойчивый гелевый барьер между слоем клеток и плазмой. Эритроциты и лимфоциты остаются под слоем геля, а плазма с тромбоцитами над ним.
5. Для дальнейшего исследования неразбавленной плазмы необходимо снять с пробирки крышку и осторожно перелить плазму во вторичную пробирку или перенести ее с помощью пипетки, не нарушая целостности гелевого барьера.
При использовании вакуумных пробирок для получения плазмы и проведения анализов методами молекулярной диагностики плазму после центрифугирования можно транспортировать непосредственно в первичной пробирке. Важно помнить, что поскольку при центрифугировании не все форменные элементы осаждаются полностью и часть их остается в плазме, продукты продолжающегося метаболизма клеток крови могут оказать влияние на показатели и свойства исследуемых аналитов. Поэтому при выборе условий хранения и транспортировки плазмы в вакуумных пробирках для получения плазмы и проведения анализов методами молекулярной диагностики следует придерживаться международных и российских рекомендаций для конкретных аналитов.
7.3.9. Вакуумные пробирки для иммуногематологических исследований
Вакуумные пробирки для иммуногематологических исследований – это пробирки для стабилизации цельной крови. Они содержат комбинированный наполнитель ACD, состоящий из активного антикоагулянта тринатрия цитрата, лимонной кислоты, которая обеспечивает буферный раствор с тринатрия цитратом, и декстрозы, являющейся питательным веществом для эритроцитов. Существуют только стеклянные пробирки с ACD, которые имеют светло-желтую крышку. Пробирки с ACD обычно используются в отделениях иммунной гематологии для анализа поверхностных антигенов лейкоцитов (HLA-типирование, некоторые приложения проточной цитометрии, исследование функций лейкоцитов и специальные иммунологические тесты). В пробирках наполнитель ACD присутствует в двух видах: раствора ACD – А и раствора ACD – В, различающихся концентрацией составляющих наполнителя. В растворе ACD-А используется соотношение консерванта к крови 1:5,67, в растворе ACD-В соотношение консерванта к крови составляет 1:3. Цельная кровь смешивается с образцом в соотношении 1:6 (1 часть ACD обеих концентрации к 6 частям образца). Сразу же после заполнения пробирки с ACD пробу необходимо тщательно перемешать путем переворачивания 8–10 раз. Условия центрифугирования: 1300 g в течение 10 минут.
7.3.10. Вакуумные пробирки для выделения моноцитов и лимфоцитов
Вакуумные пробирки для выделения моноцитов и лимфоцитов – это специальные пробирки, которые позволяют отделить мононуклеарные клетки периферической крови в один прием, за 20 минут центрифугирования, при этом цельная кровь набирается, центрифугируется и обрабатывается в одной первичной пробирке. Внутренние стенки пробирок покрыты силиконом для минимизации неспецифической активации клеток.
Вакуумные пробирки для выделения моноцитов и лимфоцитов содержат:
• антикоагулянт (натрия цитрат или натрия гепарин);
• специальную жидкость фиколл, создающую градиент плотности, для разделения мононуклеаров.
Вакуумные пробирки для выделения моноцитов и лимфоцитов выпускаются двух видов с сине-черной пестрой пробкой (пробирки с натрия цитратом) и с красно-зеленой пестрой пробкой (пробирки натрия гепарином).
В практике КДЛ вакуумные пробирки для выделения моноцитов и лимфоцитов применяют в целях исследования:
• количественных и функциональных характеристик мононуклеарных клеток;
• пролиферативной активности мононуклеарных клеток;
• РНК/ДНК клеток и вирусов;
• обнаружения злокачественных новообразований;
• провирусной ДНК ВИЧ, РНК ВИЧ и др. вирусов.
Преимущества использования вакуумных пробирок для выделения моноцитов и лимфоцитов:
• значительно облегчается процесс отделения мононуклеарных клеток, экономится время лаборанта и повышается эффективность работы лаборатории;
• гарантируется стандартизация процесса отделения мононуклеарных клеток, повышается точность исследований при использовании образцов, доставленных из различных ЛПУ;
• снижается вероятность ошибок, которые происходят при отделении мононуклеарных клеток вручную.
Взятие образца и пробоподготовка.
1. Кровь в вакуумные пробирки для выделения моноцитов и лимфоцитов берется из вены с помощью вакуумной системы.
2. Так как в пробирке содержится химический наполнитель, то нужно обращать особое внимание на предотвращение обратного тока крови: во время взятия крови рука пациента должна находиться в опущенном состоянии, пробирку необходимо поддерживать в вертикальном положении и контролировать, чтобы содержимое пробирки не касалось крышки и мембраны иглы.
3. Сразу же после заполнения пробирки и извлечения ее из держателя кровь необходимо тщательно перемешать с антикоагулянтом, для этого пробирку следует аккуратно перевернуть 8–10 раз. Нельзя встряхивать пробирку, так как это может вызвать пенообразование и гемолиз.
4. Пробу крови до центрифугирования следует хранить при комнатной температуре не более 2-х часов, вдали от солнечного света и отопительных приборов.
5. Центрифугировать пробу крови нужно строго в течение 20 минут в горизонтальной центрифуге при относительной центробежной силе 1500–1800 g. Меньшее время и/или относительная центробежная сила отрицательно сказывается на эффективности действия пробирки. Большее время и/или относительная центробежная сила может привести к уменьшению выхода моноядерных клеток. Во время центрифугирования формируется устойчивый гелевый барьер между слоем беловатого цвета, содержащим мононуклеарные клетки, распределенные в градиенте плотности над гелем, и слоем эритроцитов и гранулоцитов под гелем.
После центрифугирования моноядерные клетки можно транспортировать и хранить непосредственно в первичной пробирке, в этом случае плазма служит для клеток питательной средой. В таком виде мононуклеарные клетки могут храниться до 48 часов при комнатной температуре. Нужно учитывать, что точное время хранения определяется типом проводимого исследования. Для максимального выхода мононуклеарных клеток закрытую пробирку нужно сразу же после центрифугирования аккуратно перевернуть 5–10 раз, чтобы равномерно распределить клетки в плазме. Гелевый барьер при этом не нарушается. Затем суспензию плазмы и клеток над гелевым барьером следует осторожно перелить или перенести пипеткой во вторичную пробирку для промывания клеток и добавить в нее буферный раствор, доведя общий объем до 15 мл. Нельзя использовать буферы, содержащие кальций и/или магний. При промывании клеток следует придерживаться стандартного протокола, принятого в лаборатории. Если помимо анализа моноядерных клеток необходимо провести дополнительное исследование плазмы, ее нужно осторожно отобрать пипеткой над поверхностью клеточного слоя, а затем добавить в вакуумную пробирку 3–5 мл буферного раствора для промывания клеток.
7.4. Иглы для взятия проб венозной крови
7.4.1. Стерильная одноразовая двусторонняя игла с визуальной камерой (или без камеры), закрытая с обеих сторон защитными колпачками является важнейшей составляющей вакуумной системы для взятия проб венозной крови. Иглы могут быть покрыты или непокрыты силиконом. Снимаемый колпачок иглы закодирован цветом, который говорит о ее размере. Для взятия проб венозной крови используют следующие иглы:
• иглы 20G – желтая маркировка колпачка: диаметр 0,9 мм, длина – 25 мм (1 дюйм) или 38 мм (1,5 дюйма);
• иглы 21G – зеленая маркировка колпачка: диаметр 0,8 мм, длина – 25 мм (1 дюйм);
• иглы 22G – черная маркировка колпачка: диаметр 0,7 мм, длина – 25 мм (1 дюйм) или 32 мм (1,25 дюйма).
7.4.2. Выбор размера иглы для взятия проб крови определяется состоянием вен у каждого конкретного пациента. Наиболее широко используются иглы 21G. При необходимости взять у пациента несколько проб крови для анализа предпочтение следует отдавать иглам с большим диаметром (20G), а в трудных случаях (склерозированные вены, тонкие вены, ожирение), у детей, иглам с меньшим диаметром (22G).
7.4.3. Для взятия проб венозной крови предпочтительно использовать иглы с визуальной камерой, которые позволяют осуществлять контроль попадания в вену при проведении венепункции, и покрытые силиконом, что обеспечивает свободный ток крови по игле в вакуумную пробирку и снижает риск гемолиза.
7.4.5. У детей и в трудных случаях у взрослых (склерозированные вены, тонкие вены, ожирение) для взятия проб венозной крови необходимо использовать одноразовые стерильные иглы- “бабочки” с гибким катетером. Игла соединена с катетером при помощи люер-адаптера. “Бабочки” игл закодированы цветом, который говорит о ее размере. Для взятия проб венозной крови используют следующие иглы-“бабочки” с катетером:
• иглы 21G – зеленая маркировка бабочки: диаметр 0,8 мм, длина – 19 мм (0,75 дюйма), длина катетера 178 мм (7 дюймов) или 305 мм (12 дюймов);
• иглы 23G – голубая маркировка бабочки: диаметр 0,6 мм, длина – 19 мм (0,75 дюйма), длина катетера 178 мм (7 дюймов) или 305 мм (12 дюймов);
• иглы 25G – синяя маркировка бабочки: диаметр 0,5 мм, длина – 19 мм (0,75 дюйма), длина катетера 178 мм (7 дюймов) или 305 мм (12 дюймов).
8. Оптимальный объем пробы крови на лабораторные анализы
Технические усовершенствования анализаторов в КДЛ за последние 15 лет привели к существенному сокращению необходимого объема крови для выполнения лабораторных анализов. Существующая практика в ЛПУ РФ в отношении взятия проб крови на анализы в стеклянные пробирки приводит к избыточности объема взятых проб крови. Проведенными исследованиями установлено, что у пациентов за время его пребывания в терапевтическом отделении для выполнения назначенных ему 42 лабораторных анализов берут 208 мл крови и более. При лечении в отделении реанимации количество крови, взятой для 125 анализов, составляет 550 мл и более. Установлено, что у 50% пациентов, которым проводится переливание крови, более 180 мл крови идут на восполнение кровопотери связанной с взятием проб крови на лабораторные анализы.
Согласно рекомендациям ВОЗ, объем пробы крови (Vol b), необходимой для выполнения лабораторных анализов определяется:
1. Объемом пробы для анализа (Vol ά);
2. Объемом “мертвого” пространства анализатора (Da), измеряемого в мл плазмы/сыворотки.
3. Объемом “мертвого” пространства первичной пробирки (Dp), измеряемого в мл крови.
4. Объемом “мертвого” пространства вторичной пробирки (Ds), измеряемого в мл плазмы/сыворотки.
5. Количеством пробы для 1 анализа (N) и числом лабораторных анализов (х).
6. Величиной гематокрита.
Принимая во внимание все эти факторы и исходя из того, что плазма/сыворотка составляют примерно 50% объема крови, общий необходимый объем пробы рассчитываю по следующей формуле:
Vol b = 2 х [N х [(Vol ά + Da) + Ds] + Dp
Необходимый объем крови = 2 х [число тестов х (объем пробы для анализа + мертвое пространство анализатора) + мертвое пространство вторичной пробирки] + мертвое пространство первичной пробирки.
8.1. Определение оптимального объема пробы крови для взятия на лабораторные исследования
При использовании современных автоматизированных лабораторных анализаторов рекомендуются следующие стандартные объемы проб крови на лабораторные исследования. Эти объемы могут быть достаточны в 95% случаев для выполнения назначенных лабораторных анализов:• биохимические исследования: 4-5 мл крови (при использовании гепаринизированной плазмы – 3-4 мл);
• гематологическиеи исследований (общий анализ крови): 2-3 мл крови с ЭДТА;
• коагулология: 2-3 мл цитратной крови;
• иммунологические исследования, включая белки, гормоны, онкомаркеры и т.д.: 1 мл цельной крови на 3-4 иммунологических анализа;
• СОЭ: 2-3 мл цитратной крови;
• Газы крови: капиллярная кровь – 50 мкл; артериальная или венозная кровь – 1 мл гепаринизированной крови.
При централизации лабораторных исследований должны использоваться вакуумные пробирки унифицированного объема (например, вакуумные пробирки объемом 4-5 мл для биохимических и серологических исследований и объемом 3-4 мл для исследования гемостаза). При выборе вакуумных пробирок необходимо учитывать тот факт, что длина пробирок, должны быть, по меньшей мере, в 4 раза больше диаметра. Этим критериям соответствуют стандартные вакуумные пробирки размером 75х13 мм (длина х диаметр).
8.2. Максимально допустимые объемы крови для взятия на лабораторные исследования
При взятии крови на исследования важно знать максимальные нормы крови (особенно у детей), которые можно брать у пациента за один раз и за все время госпитализации. Незнание таких норм может в конечном счете (при частых и обширных исследованиях) привести к развитию у пациента изменений в показателях крови (снижение гемоглобина, гематокрита, эритроцитов и др.) без влияния патологического процесса. Проведенные исследования показали, что при взятии крови на рутинные исследования в обычные стеклянные пробирки взятый объем крови у пациента в среднем в 45 раз превышал необходимый для анализов, при взятии крови в вакуумные пробирки только в 7 раз.
Максимальные нормы взятия крови за один раз и за все время госпитализации у детей до 14 лет приведены в табл. 2. У взрослых людей рекомендуется брать вдвое больше крови, чем необходимо для выполнения лабораторных анализов.
8.3. Меры по снижению необходимого объема пробы на лабораторные анализы
Меры по снижению необходимого объема пробы на лабораторные анализы при централизации лабораторных исследований должны включать:
• использование первичной вакуумной пробирки в анализаторах;
• использование вакуумных пробирок меньшего диаметра;
• использование в централизованной КДЛ анализаторов с меньшим объемом аналитичес-
• хранение проб в первичных вакуумных пробирках, например, с использованием геля для сыворотки;
• использование в централизованной КДЛ для анализа плазмы вместо сыворотки.
Таблица 2. Максимальные нормы взятия крови за один раз и за все время госпитализации у детей до 14 лет