Впр ссс плода что это такое
ПЕРВИЧНАЯ ПРОФИЛАКТИКА ВРОЖДЕННЫХ ПОРОКОВ РАЗВИТИЯ

Дородовой скрининг как способ выявления ВПР
Прохождение пренатального скрининга показано всем беременным. Но в обязательном порядке его назначают в следующих случаях:
— рождение предыдущих детей с патологией;
— беременности заканчивались выкидышами;
— первые роды пришлись на возраст старше 35 лет;
— кровное родство в браке.
С высокой степенью вероятности методы скрининга позволяют выявлять у эмбриона его общее недоразвитие, отклонения в деятельности ЖКТ, сердца и почек, дефекты нервной трубки и синдромы Дауна и Эдвардса. Но результаты исследования не являются окончательным диагнозом – его фиксируют только после проведения дополнительных тестов.
Разновидности пренатального скрининга согласно видам исследований подразделяются на три методики:
ультразвуковая – выявление ВПР с помощью УЗИ;
биохимическая – анализ крови, выявляющий свободный эстриол, альфа-фетопротеин и др. важные для беременности показатели;
комбинированная – поочередное проведение первых двух диагностических методик.
Скрининг проводят с 10 – 13 недели беременности и до 16 – 18 недели (иногда до 20 недели).
Профилактика врожденных пороков у будущего ребенка
Во всех мерах профилактики против ВПР главная роль отводится фолиевой кислоте. Вещество предотвращает преждевременное родоразрешение и не допускает прорыва околоплодной оболочки. Формирующемуся организму фолиевая кислота нужна для таких целей, как:
— правильное деление клеток;
— развитие органов и тканей;
— стабилизация кроветворных процессов.
Полезный витамин контролирует скорость роста и развития плода на ранних сроках. Его дефицит негативно отражается на развитии будущего малыша и приводит к гидроцефалии, дефекту нервной трубки и анэнцефалии.
Предотвратить неправильное развитие нервной трубки женщина может путем ежедневного приёма 0,8 мг фолиевой кислоты. Принимать препарат рекомендуется до планируемого зачатия и на протяжении всех месяцев беременности.
При посещении школы для беременных женщина получает знания о причинах ВПР и способах их предотвращения. На занятиях будущей матери разъясняют необходимость употребления поливитаминных комплексов, а в некоторых школах компенсируют около 80 % их стоимости. В составе всех препаратов содержится фолиевая кислота.
Если повседневный рацион беременной богат витаминами и микроэлементами, она может отказаться от дополнительного назначения мультивитаминных средств. Но данные европейских исследований гласят, что витаминная недостаточность встречается у трети будущих матерей даже при самом разнообразном рационе питания. Поэтому во избежание ВПР полезные препараты рекомендуется принимать курсом.
Исследование плода и плаценты при врожденных пороках развития, несовместимых с жизнью
Целью исследования было выявить структуру врожденных пороков развития плода, несовместимых с жизнью, приведших к индуцированному прерыванию беременности по медицинским показаниям, структурные изменения в последе при наличии пороков развития. Проведено ран
The aim of the study was to reveal the structure of fatal congenital malformations of the fetus, leading to the induced interruption of pregnancy due to medical indications, structural changes in the afterbirth in the presence of malformations. The randomized comparative study was conducted in 2 stages (retrospective and prospective).
Врожденные пороки развития (ВПР) плода считают важнейшей медицинской и социальной проблемой, поскольку они занимают ведущее место в структуре причин перинатальной, неонатальной и младенческой заболеваемости, смертности и инвалидности [1]. Также актуальной является проблема прерывания беременности в поздние сроки по медицинским показаниям со стороны плода, так как на ее долю приходится около 20% от общего числа абортов, а количество осложнений возрастает в 3–4 раза при прерывании беременности во втором триместре по сравнению с первым [2]. Согласно данным ВОЗ, ВПР отмечают у 4–6% детей. В России ежегодно более 50 000 детей рождаются с ВПР, число пациентов с ВПР превышает 1,5 млн человек. При наличии у плода ВПР, несовместимых с жизнью, или сочетанных пороков с неблагоприятным прогнозом для жизни и здоровья, при ВПР, приводящих к стойкой потере функций вследствие тяжести и объема поражения при отсутствии методов эффективного лечения, женщине предоставляется информация о возможности искусственного прерывания беременности по медицинским показаниям [3]. При отказе женщины прервать беременность из-за наличия ВПР, несовместимых с жизнью, или иных сочетанных пороков беременность ведется в соответствии с разделом I настоящего порядка. Высокие затраты на лечение, уход и реабилитацию детей с ВПР обусловливают необходимость разработки и совершенствования не только методов контроля, диагностики и профилактики ВПР у детей, но и изучения патоморфологии плода и последа [4].
В последние десятилетия интенсивно изучаются многочисленные антенатальные факторы, приводящие к повреждению нервной системы плода — внутриутробные инфекции, генетические дефекты, проблемы резус-конфликта, воздействие на плод лекарственных веществ и целый ряд других факторов. Нередко причинами врожденных пороков развития плода и последа являются инфекционные причины: инфекционные фетопатии формируются с 16-й недели, когда происходит генерализация инфекции у плода, вследствие чего могут возникать такие пороки развития, как фиброэластоз эндокарда, поликистоз легких, микро- и гидроцефалия (ранние фетопатии) [5].
Большое количество работ посвящено методам прерывания беременности в позднем сроке по медицинским показаниям со стороны плода — врожденным порокам развития плода, реабилитации женщин после элиминации плода [6–11]. В то же время недостаточно описаны результаты патологоанатомического исследования плода и плаценты при врожденных пороках, несовместимых с жизнью. Наше исследование посвящено прерыванию беременности во втором триместре по медицинским показаниям со стороны плода. Данная публикация посвящена вопросам патологоанатомического исследования плода и последа.
Целью данного исследования было выявить структуру врожденных пороков развития плода, несовместимых с жизнью, приведших к прерыванию беременности по медицинским показаниям, их сочетания со структурными изменениями в последе.
Материалы и методы исследования
Исследование одобрено локальным этическим комитетом ФГБОУ ВО ОмГМУ МЗ РФ, Омск (№ 63 от 09.10.2014 г.) и выполнено на базе БУЗОО ГКПЦ, Омск. Прерывание беременности во II триместре по медицинским показаниям проводилось согласно Распоряжению Министерства здравоохранения Омской области № 308-р от 17.09.2013 г. в указанном учреждении, где был создан центр по прерыванию беременности второго триместра и женщине выдавалось заключение перинатального консилиума специалистами (акушер-гинеколог, перинатолог, неонатолог и др.). Гистологическое исследование элиминированных плодов и плацент проведено согласно рекомендациям А. П. Милованова и осуществлялось в патологоанатомическом отделении БУЗОО ОДКБ, Омск.
Основным показанием к прерыванию беременности на всех этапах являлись ВПР плода, несовместимые с жизнью. При наличии у плода ВПР, несовместимого с жизнью, или наличии сочетанных пороков с неблагоприятным прогнозом для жизни и здоровья, при ВПР, приводящих к стойкой потере функций вследствие тяжести и объема поражения при отсутствии методов эффективного лечения, предоставлялась информация о возможности искусственного прерывания беременности по медицинским показаниям. Искусственное прерывание беременности проводилось при наличии информированного добровольного согласия женщины.
На первом ретроспективном этапе (до внедрения в практику регламентирующих документов [3, 12]) проведен анализ гистологического исследования плацент после прерывания беременности у 150 женщин, которые в зависимости от метода прерывания были разделены на две группы: группу А составили 75 женщин, которым проведено прерывание беременности в поздние сроки методом трансвагинального трансцервикального амниоцентеза: амниоинфузия 10% раствором хлорида натрия. Группу Б составили 75 женщин, которым с целью прерывания беременности в поздние сроки для возбуждения и стимуляции родовой деятельности использовали гель динопростон для эндоцервикального введения. Более подробно методы прерывания беременности, их эффективность и исходы описаны в наших предыдущих публикациях [13–15]. Критериями включения пациенток в группы А и Б были следующие: срок беременности 18–21 неделя 6 дней, возможность родоразрешения через естественные родовые пути и отсутствие противопоказаний к применению гипертонического раствора хлорида натрия (10% NaCl) и простагландинов. Пациентки обеих групп были идентичны по возрасту, особенностям менструальной функции, наличию экстрагенитальных и гинекологических заболеваний, паритету. Все пациентки были консультированы в медико-генетическом отделе.
На втором этапе под проспективным наблюдением было 195 беременных, разделенных на две группы. Основную группу составили 98 женщин, которым проведено прерывание беременности в поздние сроки следующим комбинированным методом: мифепристон перорально и введение ламинарий в цервикальный канал. В группу сравнения были включены 97 женщин, прерывание беременности которым проводилось по схеме ВОЗ. Критерии включения в группы: пациентки, которым дано заключение консилиума врачей для прерывания беременности по медицинским показаниям со стороны плода в сроки гестации 18–21 неделя согласно приказам МЗСР РФ № 736 от 03 декабря 2007 г. [16] и № 572н от 01.11.2012 [3].
На проспективном этапе исследования материалом для изучения послужили результаты патоморфологического исследования плодов (аутопсийного материала) и последов (макроскопическое и микроскопическое). В работе использованы антропометрические, органометрические, гистологические методы. С целью уточнения гестационного возраста плода и дополнительных скрытых аномалий развития в соответствии с имеющимися стандартами использовали антропометрические и органометрические исследования [17–20]. Гистологические исследования органов плода, плодных оболочек, пуповины и плаценты проводили на парафиновых срезах, изготовленных по общепринятой методике и окрашенных гематоксилином и эозином, а также избирательно пикрофуксином по методу Ван Гизона. Для гистологического исследования предварительно материал фиксировали в 10% нейтральном формалине, после промывки и стандартной проводки заливали в парафин. Парафиновые срезы толщиной 3–5 мкм окрашивали гематоксилином и эозином. Элементы соединительной ткани определяли пикрофуксином по методу Ван-Гизона. Методы гистологического исследования выполнялись по прописям, изложенным в классических руководствах по гистологической технике и гистохимии. Обследование элиминированных плодов включало тщательную визуальную оценку имеющихся стигм эмбриогенеза, врожденных пороков. Для гистологического исследования отбирали фрагменты органов с целью изучения их гистоархитектоники [17].
Использовался способ статистической обработки результатов по критерию t таблиц Стьюдента, позволяющий вычислить степень достоверности различий при небольшом числе наблюдений. Перед каждым вычислением достоверности различий между количественными признаками, а также для выбора критерия корреляции оценивали нормальность их распределения по критерию Колмогорова–Смирнова. В случае ненормального распределения количественных признаков или неравенстве дисперсий применялся U-критерий Манна–Уитни. Для факторов, имеющих биноминальное распределение, дополнительно были рассчитаны 95% доверительные интервалы.
Результаты исследования
Пациентки всех групп были идентичны по возрасту, особенностям менструальной функции, наличию экстрагенитальных и гинекологических заболеваний, паритету. Эффективность прерывания беременности в поздние сроки методом амниоцентеза составила 93,3%, при применении простагландинов — 92%, на проспективном этапе не имела достоверных различий и составила 99,0% в основной группе и 96,9% — в группе сравнения.
В структуре выявленных ВПР плода на первом месте в основной группе были врожденные пороки сердечно-сосудистой системы (34 наблюдения — 34,7%), на втором — пороки центральной нервной системы (ЦНС) (29 наблюдений — 29,6%), на третьем — множественные пороки развития (13–13,3%), на четвертом — пороки мочевыводящей системы (9–9,2%) (табл. 1). В остальных наблюдениях выявлены ВПР опорно-двигательного аппарата (7–7,1%) и другие (6–6,1%): кожи и мышц, желудочно-кишечного тракта, легких, шеи и лица, прочие. В группе сравнения на первом месте также были врожденные пороки сердечно-сосудистой системы (32 наблюдения — 33,0%), на втором — пороки ЦНС (30 наблюдений — 30,9%), на третьем — множественные пороки развития (15–15,5%), на четвертом — пороки мочевыводящей системы (10–10,3%). В остальных наблюдениях выявлены ВПР опорно-двигательного аппарата (8–8,2%) и другие (2–2,1%): кожи и мышц, желудочно-кишечного тракта, легких, шеи и лица, прочие.
Среди пороков сердечно-сосудистой системы в обеих группах чаще наблюдались транспозиция магистральных сосудов, дефекты межжелудочковой и межпредсердной перегородок, общий артериовенозный канал, тетрада Фалло, сочетанные пороки сердца, аномалии Эбштейна, гипоплазия левого отдела, прочие врожденные пороки сердечно-сосудистой системы.
В структуре пороков ЦНС чаще наблюдалась гидроцефалия, анэнцефалия, синдром Арнольда–Киари и Денди–Уокера, микроцефалия, агенезия мозолистого тела, акрания, spina bifida (спинномозговая грыжа). Гидроцефалия — заболевание, характеризующееся избыточным накоплением цереброспинальной жидкости в желудочках и подоболочечных пространствах головного мозга, сопровождающееся их расширением и атрофией мозгового вещества.
В ходе ретроспективной оценки исследования последов в группе А в подавляющем большинстве наблюдений (78,7%) определялись серозно-гнойный и гнойно-некротический децидуит и лишь в небольшом проценте случаев (21,3%) наблюдался серозный децидуит. Также в этой группе отмечалось наличие дисциркуляторных нарушений (выраженный отек стромы ворсин, тромбоз межворсинчатого пространства, ретроплацентарные гематомы). В группе Б серозный париетальный децидуит определялся в большинстве случаев (54,7%), воспалительные изменения не определялись в 38,7% наблюдений, серозно-гнойный париетальный децидуит обнаружен в 6,6% случаев.
На ретроспективном этапе при исследовании последа в большей степени были обнаружены патологическое строение и пороки развития пуповины, чем в плаценте. Так, на первом месте среди признаков патологического строения пуповины была тощая пуповина: 19 наблюдений в основной группе (19,4%) и 21 (21,6%) в группе сравнения (табл. 2). На втором месте определялись ложные узлы пуповины: 16 (16,3%) и 17 (17,5%) соответственно исследуемым группам, на третьем месте — истинные узлы пуповины: 14 (14,2%) и 15 (15,5%). Нередко в структуре патологических вариантов строения пуповины было оболочечное прикрепление пуповины: 12 (12,2%) и 9 (9,3%) соответственно. Реже были выявлены гипо- и гиперизвитая пуповина: 8 (8,2%) и 7 (7,2%) соответственно исследуемым группам; единственная артерия пуповины: 6 (6,1%) и 4 (4,1%); гематома пуповины: 1 (1,0%) в основной группе и 2 (2,1%) в группе сравнения. Всего при исследовании нарушения строения пуповины были выявлены в 76 случаях основной группы и в 75 — группы сравнения, в целом в исследовании — в 77,4% наблюдениях.
При гистологическом исследовании плаценты отмечалась относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения (23 наблюдения — 23,5% в основной группе и 29–30,0% в группе сравнения). Серозный париетальный децидуит определялся в 17,3% наблюдений основной группы и 16,5% группы сравнения. Такие скудные изменения в плаценте, выявленные при исследовании, свидетельствуют о том, что ВПР плода, несовместимые с жизнью, чаще сочетаются с патологией строения пуповины, чем с нарушениями строения и пороками развития плаценты. Также относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения указывают на то, что прерывание беременности проводилось современным медикаментозным способом, который имитирует спонтанную сократительную деятельность матки и не вызывает грубых изменений в плаценте.
Таким образом, в структуре выявленных ВПР плода, несовместимых с жизнью, в исследуемых группах на первом месте были врожденные пороки сердечно-сосудистой системы, на втором — пороки ЦНС, на третьем — множественные пороки развития, на четвертом — пороки мочевыводящей системы. В остальных наблюдениях выявлены ВПР опорно-двигательного аппарата и другие: желудочно-кишечного тракта, дыхательной системы, шеи и лица, прочие.
При гистологическом исследовании плаценты ретроспективного этапа (до внедрения в акушерскую практику современных методов производства позднего индуцированного аборта) при проведении амниоинфузии гипертоническим раствором в подавляющем большинстве определялись серозно-гнойный и гнойно-некротический мембранит, при применении динопростона чаще наблюдался серозный париетальный децидуит. После внедрения в работу акушерско-гинекологической службы регламентирующего Приказа 572н при гистологическом исследовании плаценты у пациенток второго этапа обеих групп отмечалась относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения.
При исследовании последа чаще встречались пороки развития пуповины, чем плаценты. На первом месте среди признаков патологического строения пуповины была тощая пуповина, на втором месте — ложные узлы пуповины, на третьем — истинные узлы. Реже определялось оболочечное прикрепление пуповины. Значительно реже были выявлены гипо- и гиперизвитая пуповина, единственная пупочная артерия; гематома пуповины. При гистологическом исследовании плаценты отмечалась относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения. Скудные изменения в плаценте (в сравнении с изменениями в пуповине), выявленные при исследовании, свидетельствуют о том, что врожденные пороки развития плода, несовместимые с жизнью, чаще сочетаются с патологией строения пуповины, чем с плацентарными пороками. Также относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения указывают на то, что прерывание беременности проводилось современным медикаментозным способом, который имитирует спонтанную сократительную деятельность матки и не вызывает грубых изменений в плаценте.
Литература
* ФГБОУ ВО ОмГМУ МЗ РФ, Омск
** БУЗОО ОДКБ, Омск
Врожденные пороки развития плода
Врожденные пороки развития плода – одно из самых опасных осложнений беременности
Статистика пугает, на фоне снижающейся детской смертности рост количества врожденных пороков развития наблюдается в большинстве стран мира. Если в странах Европы частота ВПР составляет 3-4 случая на 1000 родов, то в России она достигает 5-6 случаев на 1000.
Причины возникновения ВПР плода
Причины, вызывающие формирование врожденных пороков развития различны. Эта патология может быть наследственной, если у будущих родителей есть отклонения в хромосомном наборе. В других случаях источником проблемы являются различные вредные факторы: инфекции, частое употребление алкоголя, наркотики.
Одна из причин – недостаток витаминов в питании беременной женщины, в частности – фолиевой кислоты. Рекомендуемая норма микронутриентов для беременной женщины в полтора раза больше, чем для женщин детородного возраста. И это не случайно – от этого зависит здоровье ребенка и когда он находится в утробе матери, и уже после его рождения.
Педиатры считают, что, помимо ВПР, такие заболевания новорожденных, как железодефицитная анемия, рахит или отставание в развитии, нередко связаны с тем, что будущей матери не хватало витаминов и минералов во время беременности.
Другие нарушения могут дать знать о себе гораздо позже – уже в детском саду и школе: это заболевания желудочно-кишечного тракта и болезни обмена веществ, в первую очередь, а также, сахарный диабет и ожирение.
Важно помнить, что образ жизни будущей мамы, ее питание, вредные привычки создают основу здоровья ее будущего малыша. А недостаток витаминов может послужить причиной нарушений физического и умственного развития ребенка. Это в значительной степени увеличивает риск рождения детей с различными отклонениями в развитии и малой массой тела.
Ключевой фактор: фолиевая кислота
Главенствующая роль в профилактике предупреждения возникновения врожденных пороков развития у плода является фолиевая кислота. Она необходима для деления клеток, роста и развития всех органов и тканей, нормального развития зародыша, процессов кроветворения. Фолиевая кислота предотвращает вероятность возникновения преждевременных родов и прорыва околоплодной оболочки.
Этот витамин обеспечивает необходимую скорость роста и развития будущего ребенка, особенно на ранних сроках беременности. Дефицит фолиевой кислоты при беременности существенно повышает риск развития у плода врожденных пороков, в частности дефектов нервной трубки, гидроцефалии и анэнцефалии. Для предотвращения нарушений развития нервной трубки у эмбриона женщина должна ежедневно принимать не менее 800 мкг (0,8 мг) фолиевой кислоты как до, так и в течение всей беременности.
Сегодня медики уверены в необходимости масштабных просветительских мероприятий, пропагандирующих планируемую беременность и профилактические меры, способные значительно уменьшить риск рождения ребенка с ВПР – в частности, прием препаратов, содержащих фолиевую кислоту.
Витамины – для жизни
Бытует мнение, что хорошо сбалансированный ежедневный рацион беременной женщины содержит достаточное количество витаминов, микроэлементов и в этом случае не требуется дополнительного назначения мультивитаминных комплексов. Однако, по европейским данным, витаминная недостаточность у беременных составляет 20-30% даже при самом сбалансированном и разнообразном рационе питания.
Современные исследования, регулярно проводимые в последние годы РАМН, показали, что рацион современной женщины, составленный из натуральных продуктов, вполне адекватный нашим энергозатратам и даже избыточный по калорийности, оказывается не в состоянии обеспечить организм необходимым количеством витаминов при беременности и кормлении.
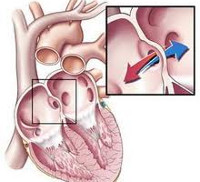
Врожденные пороки сердца
Врожденные пороки сердца – группа заболеваний, объединенных наличием анатомических дефектов сердца, его клапанного аппарата или сосудов, возникших во внутриутробном периоде, приводящих к изменению внутрисердечной и системной гемодинамики. Проявления врожденного порока сердца зависят от его вида; к наиболее характерным симптомам относятся бледность или синюшность кожных покровов, шумы в сердце, отставание в физическом развитии, признаки дыхательной и сердечной недостаточности. При подозрении на врожденный порок сердца выполняется ЭКГ, ФКГ, рентгенография, ЭхоКГ, катетеризация сердца и аортография, кардиография, МРТ сердца и т. д. Чаще всего при врожденных пороках сердца прибегают к кардиохирургической операции – оперативной коррекции выявленной аномалии.
Общие сведения
Многие виды врожденных пороков сердца встречаются не только изолированно, но и в различных сочетаниях друг с другом, что значительно утяжеляет структуру дефекта. Примерно в трети случаев аномалии сердца сочетаются с внесердечными врожденными пороками ЦНС, опорно-двигательного аппарата, ЖКТ, мочеполовой системы и пр.
К наиболее частым вариантам врожденных пороков сердца, встречающимся в кардиологии, относятся дефекты межжелудочковой перегородки (ДМЖП – 20%), дефекты межпредсердной перегородки (ДМПП), стеноз аорты, коарктация аорты, открытый артериальный проток (ОАП), транспозиция крупных магистральных сосудов (ТКС), стеноз легочной артерии (10-15% каждый).
Причины врожденных пороков сердца
Этиология врожденных пороков сердца может быть обусловлена хромосомными нарушениями (5%), генной мутацией (2-3%), влиянием факторов среды (1-2%), полигенно-мультифакториальной предрасположенностью (90%).
Различного рода хромосомные аберрации приводят к количественным и структурным изменениям хромосом. При хромосомных перестройках отмечаются множественные полисистемные аномалии развития, включая врожденные пороки сердца. В случае трисомии аутосом наиболее частыми пороками сердца оказываются дефекты межпредсердной или межжелудочковой перегородок, а также их сочетание; при аномалиях половых хромосом врожденные пороки сердца встречаются реже и представлены, главным образом, коарктацией аорты или дефектом межжелудочковой перегородки.
Врожденные пороки сердца, обусловленные мутациями единичных генов, также в большинстве случаев сочетаются с аномалиями других внутренних органов. В этих случаях сердечные пороки являются частью аутосомно-доминантных (синдромы Марфана, Холта-Орама, Крузона, Нунана и др.), аутосомно-рецессивных синдромов (синдром Картагенера, Карпентера, Робертса, Гурлер и др.) или синдромов, сцепленных с Х-хромосомой (синдромы Гольтца, Аазе, Гунтера и др.).
Среди повреждающих факторов внешней среды к развитию врожденных пороков сердца приводят вирусные заболевания беременной, ионизирующая радиация, некоторые лекарственные препараты, пагубные привычки матери, производственные вредности. Критическим периодом неблагоприятного воздействия на плод являются первые 3 месяца беременности, когда происходит фетальный органогенез.
В структуру эмбриофетального алкогольного синдрома обычно входят дефекты межжелудочковой и межпредсердной перегородки, открытый артериальный проток. Доказано, что тератогенное действие на сердечно-сосудистую систему плода оказывает прием амфетаминов, приводящий к транспозиции магистральных сосудов и ДМЖП; противосудорожных средств, обусловливающих развитие стеноза аорты и легочной артерии, коарктации аорты, открытого артериального протока, тетрады Фалло, гипоплазии левых отделов сердца; препаратов лития, приводящих к атрезии трехстворчатого клапана, аномалии Эбштейна, ДМПП; прогестагенов, вызывающих тетраду Фалло, другие сложные врожденные пороки сердца.
У женщин, страдающих преддиабетом или диабетом, дети с врожденными пороками сердца рождаются чаще, чем у здоровых матерей. В этом случае у плода обычно формируются ДМЖП или транспозиция крупных сосудов. Вероятность рождения ребенка с врожденным пороком сердца у женщины с ревматизмом составляет 25 %.
Кроме непосредственных причин, выделяют факторы риска формирования аномалий сердца у плода. К ним относят возраст беременной младше 15-17 лет и старше 40 лет, токсикозы I триместра, угрозу самопроизвольного прерывания беременности, эндокринные нарушения у матери, случаи мертворождения в анамнезе, наличие в семье других детей и близких родственников с врожденными пороками сердца.
Классификация врожденных пороков сердца
Существует несколько вариантов классификаций врожденных пороков сердца, в основу которых положен принцип изменения гемодинамики. С учетом влияния порока на легочный кровоток выделяют:
В практической кардиологии используется деление врожденных пороков сердца на 3 группы: пороки «синего» (цианотического) типа с веноартериальным шунтом (триада Фалло, тетрада Фалло, транспозиция магистральных сосудов, атрезия трехстворчатого клапана); пороки «бледного» типа с артериовенозным сбросом (септальные дефекты, открытый артериальный проток); пороки с препятствием на пути выброса крови из желудочков (стенозы аорты и легочной артерии, коарктация аорты).
Нарушения гемодинамики при врожденных пороках сердца
В результате выше названных причин у развивающего плода может нарушаться правильное формирование структур сердца, что выражается в неполном или несвоевременном закрытии перепонок между желудочками и предсердиями, неправильном образовании клапанов, недостаточном повороте первичной сердечной трубки и недоразвитии желудочков, аномальном расположении сосудов и т. д. После рождения у части детей остаются открытыми артериальный проток и овальное окно, которые во внутриутробном периоде функционируют в физиологическом порядке.
Ввиду особенностей антенатальной гемодинамики, кровообращение развивающегося плода при врожденных пороках сердца, как правило, не страдает. Врожденные пороки сердца проявляются у детей сразу после рождения или через какое-то время, что зависит от сроков закрытия сообщения между большим и малым кругами кровообращения, выраженности легочной гипертензии, давления в системе легочной артерии, направления и объема сброса крови, индивидуальных адаптационных и компенсаторных возможностей организма ребенка. Нередко к развитию грубых нарушений гемодинамики при врожденных пороках сердца приводит респираторная инфекция или какое-либо другое заболевание.
При врожденных пороках сердца бледного типа с артериовенозным сбросом вследствие гиперволемии развивается гипертензия малого круга кровообращения; при пороках синего типа с веноартериальным шунтом у больных имеет место гипоксемия.
Около 50% детей с большим сбросом крови в малый круг кровообращения погибают без кардиохирургической помощи на первом году жизни от явлений сердечной недостаточности. У детей, перешагнувших этот критический рубеж, сброс крови в малый круг уменьшается, самочувствие стабилизируется, однако постепенно прогрессируют склеротические процессы в сосудах легких, обусловливая легочную гипертензию.
При цианотических врожденных пороках сердца венозный сброс крови или ее смешение приводит к перегрузке большого и гиповолемии малого круга кровообращения, вызывая снижение насыщения крови кислородом (гипоксемию) и появление синюшности кожи и слизистых. Для улучшения вентиляции и перфузии органов развивается коллатеральная сеть кровообращения, поэтому, несмотря на выраженные нарушения гемодинамики, состояние больного может длительное время оставаться удовлетворительным. По мере истощения компенсаторных механизмов, вследствие длительной гиперфункции миокарда, развиваются тяжелые необратимые дистрофические изменения в сердечной мышце. При цианотических врожденных пороках сердца оперативное вмешательство показано уже в раннем детском возрасте.
Симптомы врожденных пороков сердца
Клинические проявления и течение врожденных пороков сердца определяется видом аномалии, характером нарушений гемодинамики и сроками развития декомпенсации кровообращения.
У новорожденных с цианотическими врожденными пороками сердца отмечается цианоз (синюшность) кожных покровов и слизистых оболочек. Синюшность усиливается при малейшем напряжении: сосании, плаче ребенка. Белые пороки сердца проявляются побледнением кожи, похолоданием конечностей.
Дети с врожденными пороками сердца обычно беспокойные, отказываются от груди, быстро устают в процессе кормления. У них появляется потливость, тахикардия, аритмии, одышка, набухание и пульсация сосудов шеи. При хроническом нарушении кровообращения дети отстают в прибавлении веса, росте и физическом развитии. При врожденных пороках сердца обычно сразу поле рождения выслушиваются сердечные шумы. В дальнейшем обнаруживаются признаки сердечной недостаточности (отеки, кардиомегалия, кардиогенная гипотрофия, гепатомегалия и др.).
Осложнениями врожденных пороков сердца могут стать бактериальный эндокардит, полицитемия, тромбозы периферических сосудов и тромбоэмболии сосудов головного мозга, застойные пневмонии, синкопальные состояния, одышечно-цианотические приступы, стенокардитический синдром или инфаркт миокарда.
Диагностика врожденных пороков сердца
ЭКГ позволяет выявить гипертрофию различных отделов сердца, патологическое отклонение ЭОС, наличие аритмий и нарушений проводимости, что в совокупности с данными других методов клинического обследования позволяет судить о тяжести врожденного порока сердца. С помощью суточного холтеровского ЭКГ-мониторирования обнаруживаются скрытые нарушения ритма и проводимости. Посредством ФКГ более тщательно и детально оценивается характер, длительность и локализация сердечных тонов и шумов. Данные рентгенографии органов грудной клетки дополняют предыдущие методы за счет оценки состояния малого круга кровообращения, расположения, формы и размеров сердца, изменений со стороны других органов (легких, плевры, позвоночника). При проведении ЭхоКГ визуализируются анатомические дефекты перегородок и клапанов сердца, расположение магистральных сосудов, оценивается сократительная способность миокарда.
При сложных врожденных пороках сердца, а также сопутствующей легочной гипертензии, с целью точной анатомической и гемодинамической диагностики, возникает необходимость в выполнении зондирования полостей сердца и ангиокардиографии.
Лечение врожденных пороков сердца
Наиболее сложной проблемой в детской кардиологии является хирургическое лечение врожденных пороков сердца у детей первого года жизни. Большинство операций в раннем детском возрасте выполняется по поводу цианотических врожденных пороков сердца. При отсутствии у новорожденного признаков сердечной недостаточности, умеренной выраженности цианоза операция может быть отложена. Наблюдение за детьми с врожденными пороками сердца осуществляют кардиолог и кардиохирург.
Специфическое лечение в каждом конкретном случае зависит от разновидности и степени тяжести врожденного порока сердца. Операции при врожденных дефектах перегородок сердца (ДМЖП, ДМПП) могут включать пластику или ушивание перегородки, рентгенэндоваскулярную окклюзию дефекта. При наличии выраженной гипоксемии детям с врожденными пороками сердца первым этапом выполняется паллиативное вмешательство, предполагающее наложение различного рода межсистемных анастомозов. Подобная тактика улучшает оксигенацию крови, уменьшает риск осложнений, позволяет провести радикальную коррекцию в более благоприятных условиях. При аортальных пороках выполняется резекция или баллонная дилатация коарктации аорты, пластика аортального стеноза и др. При ОАП производится его перевязка. Лечение стеноза легочной артерии заключается в проведении открытой или эндоваскулярной вальвулопластики и т. д.
Анатомически сложные врожденные пороки сердца, при которых радикальная операция не представляется возможной, требуют выполнения гемодинамической коррекции, т. е. разделения артериального и венозного потоков крови без устранения анатомического дефекта. В этих случаях могут проводиться операции Фонтена, Сеннинга, Мастарда и др. Серьезные пороки, не поддающиеся оперативному лечению, требуют проведения пересадки сердца.
Консервативное лечение врожденных пороков сердца может включать в себя симптоматическую терапию одышечно-цианотических приступов, острой левожелудочковой недостаточности (сердечной астмы, отека легких), хронической сердечной недостаточности, ишемии миокарда, аритмий.
Прогноз и профилактика врожденных пороков сердца
В структуре смертности новорожденных врожденные пороки сердца занимают первое место. Без оказания квалифицированной кардиохирургической помощи в течение первого года жизни погибает 50-75% детей. В периоде компенсации (2-3 года) смертность снижается до 5%. Ранее выявление и коррекция врожденного порока сердца позволяет существенно улучшить прогноз.
Профилактика врожденных пороков сердца требует тщательного планирования беременности, исключения воздействия неблагоприятных факторов на плод, проведения медико-генетического консультирования и разъяснительной работы среди женщин групп риска по рождению детей с сердечной патологией, решения вопроса о пренатальной диагностике порока (УЗИ, биопсия хориона, амниоцентез) и показаниях к прерыванию беременности. Ведение беременности у женщин с врожденными пороками сердца требует повышенного внимания со стороны акушера-гинеколога и кардиолога.
_575.gif)