какую слизь выделяет желудок
Какую слизь выделяет желудок
Органическим компонентом желудочного сока является слизь.
Нерастворимая слизь (муцин) является продуктом секреторной активности добавочных клеток и клеток поверхностного эпителия. Муцин выделяется через апикальную мембрану мукоцита, образует слой слизи толщиной 0,5—1,5 мм, он обволакивает слизистую оболочку желудка и препятствует повреждающему воздействию соляной кислоты и пепсинов на клетки слизистой оболочки и раздражающих веществ, поступивших с пищей. Этими же клетками одновременно с муцином продуцируется и бикарбонат. Образующийся при взаимодействии муцина и бикарбоната мукозобикарбонатный барьер предохраняет слизистую оболочку от аутолиза под воздействием соляной кислоты и пепсинов.
Слой слизи является преградой для обратной диффизии ионов водорода из полости желудка; он нейтрализует соляную кислоту благодаря буферным свойствам из-за наличия гидрокарбонатов, а также адсорбирует ферменты. Под влиянием длительного воздействия желчных кислот (при забрасывании их из двенадцатиперстной кишки), салицилатов, масляной и пропионовой кислот, алкоголя происходит нарушение слизистого барьера. Это приводит к обратной диффизии ионов водорода из полости желудка, контакту слизистой оболочки с пепсинами и ее повреждению в результате аутолиза. Так формируются пептические язвы желудка. Возникновению язвенного процесса способствуют продукты жизнедеятельности микроорганизма Helicobacter pylori, которые усиливают секрецию соляной кислоты.
Слизистый след раковых заболеваний
Слизистый след раковых заболеваний
Автор
Редактор
Статья на конкурс «био/мол/текст»: Муцины — главные гликопротеины слизи, покрывающей дыхательные, пищеварительные и мочеполовые пути. Слизистый слой защищает от инфекций, обезвоживания, физических и химических повреждений, а также играет роль смазки и способствует прохождению веществ по тракту. Но интересно другое: оказывается, по изменению уровня продукции муцинов в эпителиальных клетках различных органов — легких, простаты, поджелудочной железы и других — можно судить о развитии скрытых до поры до времени онкологических процессов. Особенно это актуально при затруднениях в диагностике рака и в определении источника опухолевых клеток при метастазировании.
Обратите внимание!
Эта работа опубликована в номинации «лучшее новостное сообщение» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
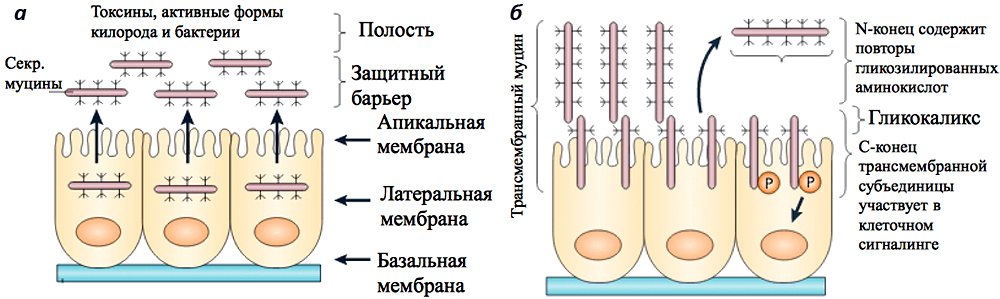
Муцины (от лат. mucus — слизь), или мукопротеины — семейство высокомолекулярных гликопротеинов, содержащих кислые полисахариды. Это семейство очень гетерогенно: молекулярный вес его представителей варьирует в пределах от 0,2 до 10 миллионов дальтон [1]. В своей структуре муцины содержат тандемные повторы из таких аминокислот, как пролин, треонин и серин; именно по двум последним идет гликозилирование [2]. У человека выделяют до 21 вида мукопротеинов, обозначаемых как MUC1, MUC2 и так далее (табл. 1), которые по месту своего расположения в слизи делятся на мембранные и секретируемые формы (рис. 1) [3].
Рисунок 1. Секретируемые и мембранные формы муцинов в защитном барьере эпителия. а — Секретируемые муцины формируют поверхностный защитный гель над эпителиальными клетками. MUC2 — самый распространенный муцин слизистой оболочки желудочно-кишечного тракта. б — Трансмембранные муцины экспонируются на поверхности клеток эпителия, где они представляют собой часть гликокаликса. Участки с тандемными повторами аминокислот на N-конце жестко закреплены над гликокаликсом, и при их отрыве у MUC1 и MUC4 открываются субъединицы муцинов, способные передать в клетку стрессовый сигнал. Рисунок из [2].
| Мембранно-связанные муцины: | Секретируемые муцины: |
|---|---|
| MUC1 — желудок, грудная клетка, желчный пузырь, шейка матки, поджелудочная железа, дыхательные пути, двенадцатиперстная кишка, толстая кишка, почки, глаза, B-клетки, T-клетки, дендритные клетки, эпителий среднего уха | MUC2 — тонкая и толстая кишки, дыхательные пути, глаза, эпителий среднего уха |
| MUC3A/В — тонкая и толстая кишки, желчный пузырь, эпителий среднего уха | MUC5B — дыхательные пути, слюнные железы, шейка матки, желчный пузырь, семенная жидкость, эпителий среднего уха |
| MUC4 — дыхательные пути, желудок, толстая кишка, шейка матки, глаза, эпителий среднего уха | MUC5AC — дыхательные пути, желудок, шейка матки, глаза, эпителий среднего уха |
| MUC12 — желудок, тонкая и толстая кишки, поджелудочная железа, легкие, почки, простата, матка | MUC6 — желудок, двенадцатиперстная кишка, желчный пузырь, поджелудочная железа, семенная жидкость, шейка матки, эпителий среднего уха |
| MUC13 — желудок, тонкая и толстая кишки (включая аппендикс), трахея, почки, эпителий среднего уха | MUC7 — слюнные железы, дыхательные пути, эпителий среднего уха |
| MUC16 — перитонеальный мезотелий, репродуктивные пути, дыхательные пути, глаза, эпителий среднего уха | MUC19 — сублингвальные и субмандибулярные слюнные железы, дыхательные пути, глаза, эпителий среднего уха |
| MUC17 — тонкая и толстая кишки, желудок, эпителий среднего уха | MUC20 — почки, плацента, толстая кишка, легкие, простата, печень, эпителий среднего уха (в некоторых источниках этот муцин относят к мембранно-связанным [1]) |
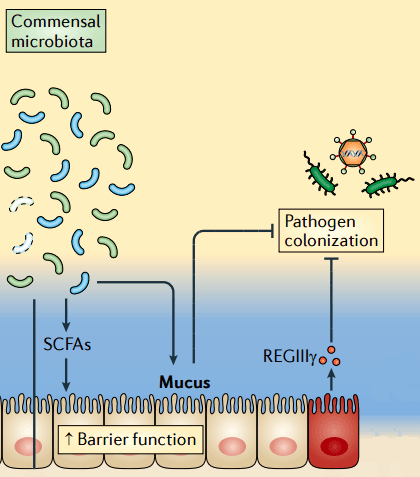
В слизистой оболочке муцины выполняют важную защитную функцию. Они помогают организму очищаться от ненужных субстанций, держать дистанцию от патогенных организмов и даже регулировать поведение микробиоты. В кишечнике, например, мукопротеины участвуют в диалоге между бактериями и эпителиальными клетками слизистой. Микробиота через эпителиальные клетки влияет на продукцию муцинов (рис. 2), а те, в свою очередь, могут участвовать в передаче воспалительных сигналов [4, 5]. К гликанам муцинов прикрепляются бактериофаги, которые тоже вносят свою лепту в регуляцию численности бактерий [6]. Углеводные цепи мукопротеинов прекрасно связывают воду, образуя плотный слой и удерживая таким образом антимикробные белки от смывания в просвет кишечника [7]. Конечно, в слизистой желудочно-кишечного тракта (и не только его) мукопротеины не являются основным защитным механизмом. Помимо муцинов в защите участвуют антимикробные пептиды, секретируемые антитела, гликокаликс и другие структуры.
Рисунок 2. Влияние микробиоты на секрецию слизи. Бактерии — комменсалы толстой кишки в ходе катаболизма неперевариваемых в тонкой кишке углеводов образуют короткоцепочечные жирные кислоты (SCFA, short-chain fatty acids), такие как ацетат, пропионат и бутират, которые повышают продукцию муцинов и защитную функцию эпителия. Рисунок из [5].
При длительном стрессовом воздействии на клетку возможна ее раковая трансформация. Под действием стресса клетка может потерять полярность, в результате чего ее апикальные трансмембранные молекулы, среди которых присутствуют и муцины, начнут экспонироваться на базолатеральных поверхностях. В этих местах муцины — нежелательные гости, так как их неспецифическое связывание с другими молекулами и рецепторами может привести к нарушению межклеточных и базальных контактов. MUC4, например, содержит EGF-подобный домен, способный связываться с тирозинкиназным рецептором соседней клетки и приводить к нарушению плотных контактов [2]. Лишенная связи с окружением, деполяризованная клетка имеет все шансы превратиться в раковую, если уже не является ею.
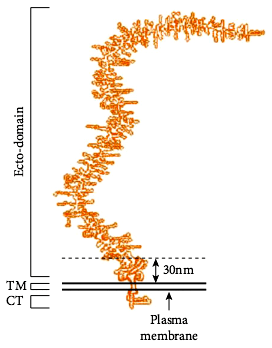
Рисунок 3. Структура мукопротеина MUC1. СТ — цитоплазматический домен, ТМ — трансмембранный домен. Рисунок из [12].
В диагностике некоторых видов злокачественных опухолей изучают профиль производимых клетками муцинов. Дело в том, что экспрессия генов разных типов мукопротеинов во время развития организма имеет специфические пространственно- временные рамки. Однако при онкологических заболеваниях часто наблюдают нерегулируемую экспрессию некоторых из этих генов. Например, MUC1 (рис. 3) в определенном количестве является маркером рака мочевого пузыря [8]. При патологии концентрация MUC1 значительно увеличивается, изменяется и структура мукопротеина. Путем воздействия на клеточный метаболизм через тирозинкиназные и другие рецепторы MUC1 усиливает продукцию факторов клеточного роста [8].
Однако оценка сывороточного уровня MUC1 — не слишком чувствительный, хотя и высокоспецифичный метод диагностики рака мочевого пузыря, для скрининга не подходящий, но для слежения за прогрессией пригодный. Установлено также, что благоприятный исход заболевания связан с гиперпродукцией рецептора к эпидермальному фактору роста HER3 на фоне повышенного содержания MUC1. Только с помощью совокупного анализа этих маркеров можно строить какие-то прогнозы [9].
Дальнейшие исследования, связанные с этим муцином, будут посвящены изучению влияния взаимодействий MUC1 с различными факторами и рецепторами на течение болезни. Кроме того, уже идентифицирован генный локус, ответственный за синтез молекулы MUC1. Этот локус рассматривают в качестве возможной мишени для проведения генной терапии в целях уменьшения риска развития первичной опухоли и ее метастазирования*.
* — Подробно о генетической терапии рассказано в статье «Генная терапия против рака» [10].
Другое исследование выявило, что аномальная экспрессия гена, кодирующего MUC4, является маркером рака поджелудочной железы. Ген этого муцина заметно экспрессировался именно в раковых клетках, но не в тканях нормальной или даже воспаленной железы (при хроническом панкреатите). В качестве основного диагностического метода ученые использовали ПЦР с обратной транскрипцией. Этим же способом они оценили и уровень синтеза мРНК MUC4 в моноцитарной фракции периферической крови пациентов: ведь именно по крови в случае успеха было бы легче всего проводить скрининг в клиниках. Такой анализ оказался достоверным способом выявления панкреатической аденокарциномы на ранних стадиях. У здоровых людей и при опухолях других органов экспрессию гена MUC4 не фиксировали [11].
Открытие того факта, что трансмембранные муцины ассоциированы с клеточной трансформацией и могут способствовать развитию опухоли, положило начало новому направлению в изучении противораковых агентов — пока в доклинических исследованиях.
Увеличение продукции муцинов можно наблюдать при самых разных болезнях, затрагивающих слизистые. Однако в некоторых случаях профиль экспрессии генов разных муцинов, возможно, удастся связать с конкретной патологией. Да и среди многочисленных структурных трансформаций муцинов, характерных для рака, можно выделить те, которые станут наиболее специфичными маркерами для рутинного выявления той или иной опухоли.
Какую слизь выделяет желудок
Желудок выполняет ряд пищеварительных и не пищеварительных функций, нарушение которых в условиях патологии может привести к расстройствам не только желудочного и кишечного пищеварения, но и к развитию анемий, к гормональному дисбалансу, нарушению кислотно-основного состояния, электролитного баланса и другим сдвигам. Основными функциями желудка являются секреторная, моторная, эвакуаторная, резервуарная, экскреторная, всасывательная и инкреторная [1, 2, 4, 5, 7, 8, 9].
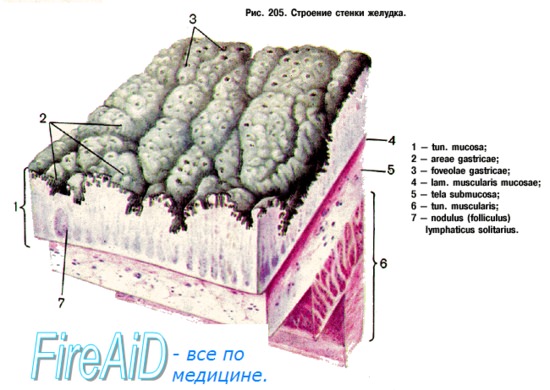
Основными анатомическими отделами желудка, отличающимися своими структурными и функциональными особенностями, являются: кардиальный отдел, дно и тело желудка, пилорический отдел. Касаясь секреторной функции желудка, следует отметить способность слизистой секретировать соляную кислоту, бикарбонаты, пепсиногены, гастрин, слизь, однако в различных отделах желудка имеются особенности секреции [7, 8, 9].
Внутренняя поверхность желудка покрыта однослойным высокопризматическим эпителием, непрерывно выделяющим мукоидный секрет, или так называемую видимую слизь, а также бикарбонаты. Барьер видимой слизи составляет 0,5-1,5 мм и обеспечивает защиту подлежащих слоев слизистой от агрессивного действия кислотно-пептического фактора [1, 2, 4, 5, 7, 8, 9].
Кардиальный отдел представляет собой узкое (шириной в 1-4 см) кольцо ниже отверстия пищевода и содержит железы, вырабатывающие мукоидный секрет, здесь же обнаружены париетальные клетки, продуцирующие HCl и внутренний фактор Кастла. Основное количество париетальных или обкладочных клеток, секретирующих НCl и внутренний фактор Кастла, представлено в дне и теле желудка, составляющих 75 % всего желудка. Кроме того, в теле и дне желудка имеются главные зимогенные клетки, вырабатывающие пепсиногены, мукозные клетки, а также аргентофинные клетки. Железы пилорического отдела, составляющего 15-20 % желудка, содержат клетки, вырабатывающие слизь. Особенностью этого отдела является наличие в нем G-клеток, продуцирующих гастрин [7, 8, 9].
В различных отделах желудка выделяют так называемые промежуточные клетки, выделяющие мукоидный секрет и бикарбонаты. Эти клетки обладают высокой митотической активностью и являются камбием для всего эпителия желудка. Главные и часть париетальных клеток не обладают митотической активностью, их восполнение обеспечивается за счет пролиферации и созревания камбиальных клеток. По всей территории желудка в глубоких слоях слизистой располагаются аргентофинные клетки, продуцирующие 5-окситриптамин (предшественник серотонина) и другие биологически активные вещества. Тучные клетки соединительной ткани продуцируют гистамин, серотонин, гепарин, фактор активации тромбоцитов (ФАТ), фактор хемотаксиса эозинофилов (ФХЭ), фактор хемотаксиса моноцитов (ФХМ) и другие цитокины [4, 5, 6].
Иннервация желудка обеспечивается экстрамуральными нервами (блуждающим, чревным, диафрагмальным) и интрамуральной нервной системой [7, 8, 9].
Парасимпатическая иннервация осуществляется блуждающими нервами, содержащими преганглионарные волокна и оканчивающимися в миэнтеральном сплетении на клетках Догеля I типа – втором нейроне парасимпатической иннервации.
Симпатическая иннервация осуществляется волокнами, идущими в составе ваго-симпатических стволов блуждающих нервов и волокон чревных нервов, достигающих желудка совместно с брыжеечными нервами [7, 8, 9].
Метасимпатическая система регуляции основных функций желудка представлена подслизистым сплетением (мейснерово), слизистым, межмышечным (ауэрбахово) и субсерозным.
В свою очередь, активность метасимпатической системы желудка находится под преимущественным регулирующим влиянием n.vagus.
Характеристика фаз желудочной секреции
Различают базальную (голодную) и стимулированную (пищеварительную) секрецию. Секреция желудочного сока натощак составляет у взрослого человека 10 % того количества, которое образуется при максимальной стимуляции. Перерезка блуждающего нерва или удаление антрального отдела, содержащего G-клетки, приводит к прекращению базальной секреции, из чего следует, что она стимулируется гастрином и зависит от тонуса блуждающего нерва [1, 2, 4, 5, 7, 8, 9].
В процессе желудочной секреции выделяют три фазы:
1) сложнорефлекторную (цефалическую);
Клетки желудочных желез ежесуточно секретируют 2-3 литра желудочного сока. По своему составу желудочный сок на 99-99,5 % состоит из воды и 1-0,5 % составляет плотный остаток, представленный неорганическими (хлориды, сульфаты, фосфаты, бикарбонат натрия, ионы калия, кальция, магния) и органическими (ферменты, мукоиды) веществами. В небольшом количестве в желудочном соке находятся азотсодержащие вещества небелковой природы (мочевина, мочевая кислота, молочная кислота) [5, 7, 8, 9].
Афферентная стимуляция цефалической фазы желудочной секреции осуществляется при участии различных анализаторов – вкусового, обонятельного, зрительного, слухового.
Эфферентное звено регуляции первой фазы желудочной секреции обеспечивается холинэргическими нервными волокнами, ацетилхолином, освобождаемым интрамуральными нервными сплетениями. Латентный период первой фазы составляет 5-10 минут. В цефалическую фазу выделяется около 45 % желудочного сока, богатого ферментами.
Основными эфферентными регуляторами сложнорефлекторной фазы являются: холинергические нервные влияния, ацетилхолин, а также гастрин, высвобождающийся при активации n. vagus [5, 7, 8, 9].
Стимуляторами желудочной фазы секреции являются механические факторы (растяжение желудка поступающей в него пищей) и химические раздражения слизистой желудка, приводящие к активации холинергических влияний и усилению продукции ацетилхолина и гастрина.
Различают гастрин 17 и гастрин 34. Гастрин 17 обладает наибольшей активностью, гастрин 34 имеет более продолжительный период существования, но в шесть раз меньшую активность. Гастрин 17 в большей мере оказывает местный стимулирующий эффект на секреторную активность желудка при участии антрофундального кровотока. Гастрин 34, всасываясь в системный кровоток, регулирует оксигенацию и трофику слизистой желудочно-кишечного тракта. Гастрин 34 синтезируется клетками 12-перстной кишки и поджелудочной железы и при триптическом гидролизе расщепляется с образованием гастрина 17, 14, 13. Гастрин 14 и гастрин 13 обнаруживаются в небольших количествах, и биологическая значимость их неясна. Стимулируют инкрецию гастрина ацетилхолин, механическое растяжение антрального отдела, продукты протеолиза, катехоламины через a-адренорецепторы, ионы кальция, магния, алкоголь, кофеин [1, 2, 4, 5, 7, 8, 9].
Третья фаза желудочной секреции – кишечная – продолжается 1-3 часа развивается при переходе пищи из желудка в кишечник. Кишечная фаза поддерживается механическим растяжением тонкого кишечника и химическим раздражением хеморецепторов слизистой 12-перстной кишки продуктами гидролиза пищи и сопровождается освобождением различных биологически активных соединений – гастрина, энтерогастрона, соматостатина, секретина, холецистокинина, гастроингибирующего пептида, мотилина, нейротензина и другие [1, 2, 4, 5, 7, 8, 9].
К числу медиаторов, играющих роль первых посредников в индукции секреции желудочного сока, относятся ацетилхолин, гистамин и гастрин.
Как известно, важнейшими компонентами желудочного сока являются НСl, пепсиногены и слизь.
НСl вырабатывается париетальными клетками, расположенными в перешейке, шейке и верхнем отделе тела железы. Эти клетки характеризуются исключительным богатством митохондрий вдоль секреторных внутриклеточных канальцев. В состоянии покоя париетальных клеток секреторные канальцы выражены слабо, вместо них имеются особые пузырчатые образования – тубуловезикулы. В периоды секреторной активности в процессе пищеварения количество секреторных канальцев увеличивается, их мембрана сливается с плазматической мембраной, увеличивая тем самым ее площадь. Кислотопродуцирующие клетки желудка активно используют собственный гликоген для нужд секреторного процесса. Секреция НСl – ярко выраженный цАМФ-зависимый процесс, активация которого протекает на фоне усиления гликогенолитической и гликолитической активности. Кислотообразующая функция обкладочных клеток характеризуется наличием в них процессов фосфорилирования-дефосфорилирования, существованием митохондриальной окислительной цепи, транспортирующей ионы водорода из матриксного пространства, а также (Н-К)-АТФазы секреторной мембраны, перекачивающей протоны из клетки в просвет железы за счет энергии АТФ. Вода поступает в канальцы клетки путем осмоса [5, 7, 8, 9].
В полости желудка НСl стимулирует секреторную активность желез желудка, способствует превращению пепсиногена в пепсин, создает оптимальное рН для действия протеолитических ферментов желудочного сока, вызывает денатурацию и набухание белков. Кроме того, HCl стимулирует продукцию секретина в двенадцатиперстной кишке, обеспечивает антибактериальное действие вместе с лизоцимом и сиаломуцинами, а также стимулирует моторную функцию желудка и регулирует работу пилорического сфинктера [7, 8, 9].
При ахлоргидрии содержание микроорганизмов в 1 мл желудочного сока возрастает до 100000 (в норме в 1 мл содержится 100 микробных клеток).
Основным ферментативным процессом в полости желудка является начальный гидролиз белков до альбумоз и пептонов с образованием небольшого количества аминокислот. В желудочном соке выделено 7 видов пепсинов, продуцируемых главными клетками.
Основными пепсинами желудочного сока являются:
Пепсин А – группа ферментов, гидролизирующих белки при рН = 1,5- 2,0. Около 1 % пепсина переходит в кровяное русло, фильтруется в почках и выделяется с мочой (уропепсин).
Гастриксин, пепсин С, желудочный катепсин. Соотношение между пепсином А и гастриксином в желудочном соке от 1:1 до 1:5. Оптимум действия фермента при рН = 3,2-3,5.
Пепсин В, парапепсин, желатиназа – разжижает желатину, расщепляет белки соединительной ткани. Оптимум действия фермента при рН до 5,6.
Ренин, пепсин Д, химозин – расщепляет казеин молока в присутствии ионов Са, с образованием параказеина и сывороточного белка.
Пепсины не продуцируются железами антрального отдела желудка, гастриксин же присутствует во всех отделах желудка.
Желудочный сок содержит ряд непротеолитических ферментов – желудочную липазу, лизоцим, муколизин, карбоангидразу, уреазу. Лизоцим вырабатывается клетками поверхностного эпителия и придает бактерицидные свойства желудочному соку.
Желудочный сок обладает небольшой амилолитической и липолитической активностью. Не исключено, что амилаза и липаза рекретируются фундальными и пилорическими железами из крови. В желудочном соке обнаружены и другие непротеолитические ферменты: трансаминазы, аминопептидазы, щелочная фосфатаза, рибонуклеазы и другие [5, 7, 8, 9].
Важнейшим протективным фактором желудка от воздействия НСl и пепсинов является слизеобразование.
Желудочная слизь, или муцин, вырабатывается клетками поверхностного цилиндрического эпителия, добавочными клетками шеек желез дна и тела, мукоидными клетками кардиальных и пилорических желез.
Желудочная слизь состоит из нерастворимой видимой и растворимой слизи. Видимая слизь – высокогидратированный гель, содержит нейтральные мукополисахариды, сиаломуцины, гликопротеиды, протеогликаны, протеины. Растворенный муцин образуется из секрета желудочных желез и продуктов переваривания видимой слизи [5, 7, 8, 9].
Адсорбционная и антипептическая способность слизи, обусловленная наличием сиаловых кислот, обеспечивает защиту слизистой от самопереваривания. Гликопротеиды, входящие в состав видимого муцина, совершенно резистентны к протеолизу. Слизь обладает значительной буферной емкостью и способностью нейтрализовать кислоту за счет наличия бикарбонатов и фосфатов, которые секретируются вместе со слизью и адсорбируются на ней. Образующийся при взаимодействии муцина и бикарбоната мукозо-бикарбонатный барьер предохраняет слизистую от аутолиза, создает такую среду, в которой большинство макромолекул нерастворимы. Такой барьер непроницаем для бактериальных олигопептидов.
Кислые мукополисахариды – протеогликаны обеспечивают липотропную активность слизи, предотвращая ожирение печени. Биологическое действие фукомуцинов (нейтральных муцинов), составляющих основную массу видимой и растворимой слизи, связано с наличием в их составе групповых антигенов крови, фактора роста и антианемического фактора Кастла.
Сиаломуцины участвуют в синтезе НCl, они способны нейтрализовать вирусы и препятствовать вирусной гемаглютинации.
Выделение слизи стимулируют умеренные концентрации катехоламинов, гистамин, гастрин, серотонин, механическое раздражение слизистой. Усиливают образование слизи простациклин, а также простагландины (РgE1, PgE2), улучшающие кровоснабжение слизистой оболочки. Простагландины F2b стабилизируют мембраны лизосом эпителия, препятствуя его десквамации, и являются мембранопротекторами. АКТГ, глюкокортикоиды подавляют слизеобразование [3, 5, 6, 9].
Характер и механизмы нервных и гормональных влияний на желудочную секрецию
Ацетилхолин стимулирует деятельность главных, обкладочных и мукозных клеток через М-холинорецепторы, а также за счет стимуляции освобождения гастрина G-клетками. Кроме того, ацетилхолин подавляет активность D-клеток и продукцию соматостатина-ингибитора желудочной секреции. В ткани желудка под действием ацетилхолина и гастрина из ECL-клеток и тучных клеток выделяется гистамин, который через Н2 – рецепторы активирует аденилатциклазу с последующей стимуляцией (Н-К)-АТФ-азы. Этот фермент обеспечивает электронейтральный обмен ионов калия на ионы водорода. В равной степени гистамин стимулирует секрецию бикарбонатов и слизи. Стимулирующим влиянием на процесс желудочной секреции обладают простагландины F 2α, высвобождающиеся под влиянием ацетилхолина [1, 2, 4, 5, 7, 8, 9].
Эффекты катехоламинов на секреторную способность желудка, по данным ряда авторов, весьма противоречивы: через β1-адренорецепторы подавляется продукция НСI; через β2-адренорецепторы подавляется продукция пепсиногена. Действуя через α-адренорецепторы, катехоламины вызывают ограничение кровотока в слизистой желудка, активацию G-клеток и усиление продукции гастрина. Последнее приводит к повышению секреторной способности желудка.
В настоящее время очевидно значение ряда гормональных и гуморальных факторов, оказывающих модулирующее влияние на секреторную функцию желудка. Гормональными факторами, стимулирующими желудочную секрецию, являются АКТГ, глюкокортикоиды, СТГ, пролактин, инсулин, глюкагон, паратгормон. К гормональным и гуморальным ингибиторам желудочной секреции относятся вазопрессин, окситоцин, тиреокальцитонин, эндогенные опиоидные пептиды, ВИП, ГИП и другие факторы [1, 2, 4, 5, 7, 8, 9].
Важную роль в регуляции желудочной секреции играют биологически активные вещества и тканевые гормоны, причем гистамин, простагландины групп В, F оказывают стимулирующее воздействие на желудочную секрецию, в то время как простагландины типа Е, А и простациклин подавляют секрецию кислоты и пепсина [5, 7, 8, 9].
Что касается серотонина – важного медиатора воспалительных реакций – он оказывает неоднозначное действие на желудочную секрецию: стимулирует действие главных клеток и подавляет активность обкладочных [1, 2, 4, 5].
Ниже представлены особенности влияния ряда гормонов и гуморальных модуляторов секреторной, моторной и эвакуаторной функции желудка.
Холецистокинин – продуцируется в G-клетках тонкой кишки под влиянием пептидов, аминокислот, жирных кислот. Холецистокинин стимулирует секрецию секрецию желудочного сока, панкреатических ферментов, инсулина, моторику желчного пузыря, кишечника и тормозит эвакуаторную активность желудка.
Мотилин – является дигестивным пептидом, продуцируется энтерохромафинными клетками тонкого кишечника (ЕС2-клетками), стимулирует секрецию пепсиногена главными клетками желудка, вызывает тоническое сокращение желудка и кишечника. Мотилин потенцирует действие ацетилхолина на пилорический отдел желудка и ускоряет эвакуацию химуса.
Секретин – продуцируется S-клетками проксимального отдела тонкого кишечника. Секретин стимулирует секрецию пепсиногена главными клетками желудка, тормозит продукцию соляной кислоты париетальными клетками. Секретин стимулирует освобождение бикарбонатов и воды поджелудочной железой, печенью, дуоденальными железами, усиливает секрецию желчи и кишечного сока, потенцирует действие холецистокинина на моторику желчного пузыря.
Важнейшим регулятором желудочной секреции является соматостатин, продуцируемый D-клетками желудочно-кишечного тракта, а также нервными клетками центральной и периферической нервной системы. Стимуляция инкреции соматостатина происходит под влиянием пептонов, кислого содержимого. Реципрокные отношения отмечены между продукцией соматостатина, гастрина, ацетилхолина.
Соматостатин ингибирует секрецию СТГ, ТТГ, пролактина, инсулина, глюкагона, а также ряда дигестивных пептидов – гастрина, холецистокинина. Снижение содержания соматостатина в слизистой оболочке антрального отдела выявлено у больных с рецидивирующей язвой двенадцатиперстной кишки [1, 2, 4, 5].
У пациентов со соматостатинпродуцирующими опухолями выявлено снижение секреторной активности желудка.
Ингибирующим влиянием на секреторную активность желудка обладают:
Гастроингибирующий пептид (ГИП) – тормозный полипептид, синтезируется в эндокриноцитах (К-клетках) тонкой кишки под влиянием липидов, снижает секрецию НСI, угнетает реабсорбцию натрия и воды в ЖКТ, стимулирует секрецию инсулина, ингибирует моторику желудка. ГИП активирует секреторную деятельность толстого кишечника. Усиление секреции ГИП выявлено при диабете 2-типа, демпинг-синдроме.
Нейротензин образуется в N-клетках слизистой оболочки подвздошной кишки, в гипоталамусе и базальных ганглиях, высвобождение нейротензина в кишечнике происходит под влиянием липидов. Нейротензин ингибирует двигательную и секреторную функцию желудка, стимулирует секрецию бикарбонатов поджелудочной железой и освобождение глюкагона.
Пептид YY синтезируется эндокриноцитами толстой и тонкой кишки, угнетает секреторную функцию желудка и поджелудочной железы, тормозный медиатор для верхних отделов пищеварительной трубки.
Энтероглюкагон – синтезируется в ЕСI-клетках слизистой оболочки кишечника, особенно подвздошной и толстой кишки; его секреция возрастает под влиянием триглицеридов и углеводов. Энтероглюкагон угнетает моторику желудка, снижает образование соляной кислоты париетальными клетками. Энтероглюкагон обладает трофическим влиянием на слизистую кишечника.
Нейропептиды могут оказывать как активирующее, так и тормозное влияние на секреторную и моторную функции желудка.
Вазоактивный интестинальный пептид (ВИП) – содержится в больших нейросекреторных гранулах типа Р. Он подавляет секрецию соляной кислоты и пепсиногена клетками желудка, активирует кровоток в стенке кишечника, секрецию кишечного сока и бикарбоната поджелудочной железой. ВИП стимулирует инкрецию инсулина, усиливает гликогенолиз в печени. ВИП обладает выраженным вазодилятаторным и гипотензивным эффектом.
Бомбезин – гастринстимулирующий полипептид – GRP, продуцируется в нервных волокнах желудочно-кишечного тракта и клетках ЦНС. Стимулирует продукцию соляной кислоты, пепсиногена, гастрина, панкреатического сока. Бомбезин способствует выделению энтероглюкагона, холецистокинина, субстанции Р, панкреатического полипептида, соматостатина.
Субстанция Р – относится к нейропептидам, выделяется нервными окончаниями интрамускулярного нервного сплетения ЖКТ, а также клетками головного и спинного мозга. Субстанция Р усиливает слюноотделение, оказывает стимулирующее действие на моторику пищеварительного тракта, участвует в передаче информации о боли с периферии в центральную нервную систему.
Энкефалины и эндорфины – эндогенные опиоидные пептиды, образуются в гипоталамических структурах, слизистой двенадцатиперстной кишки, поджелудочной железе, надпочечниках. Они оказывают тормозное влияние на секреторную и моторную функции желудка и кишечника путем блокады освобождения ацетилхолина и субстанции Р клетками этих отделов.
Нейропептид Y образуется клетками центральной и периферической нервной системы, угнетает секрецию ацетилхолина в нервных окончаниях желудочно-кишечного тракта, а следовательно, секреторную и моторную функцию ЖКТ.
Тиролиберин – образуется в гипоталамусе, аденогипофизе, клетках ЖКТ, почках, печени, плаценте, сетчатке глаза. Тиролиберин угнетает образование НСI в желудке и моторику желудка.