как определить пол хмеля
Способ молекулярного маркирования пола хмеля обыкновенного (humulus lupulus l)
Владельцы патента RU 2272840:
Изобретение относится к области молекулярной биологии, в частности при селекции хмеля для определения пола растений на стадии проростков. Определяют пол гибридных растений хмеля на стадии сеянцев с помощью молекулярного маркирования, где используют две комбинации олигонуклеотидных праймеров для проведения полимеразной цепной реакции, которые обеспечивают амплификацию специфичных для мужских растений фрагментов ДНК. Изобретение повышает эффективность селекции и позволяет сократить затраты труда, средств, площадей и времени. 3 ил., 1 табл.
Известные способы определения пола растений хмеля:
1. По морфологии мужских и женских цветков.
Предлагаемая авторами пара олигонуклеотидных праймеров
обеспечивает амплификацию в процессе ПЦР специфичного для мужских растений фрагмента ДНК, который выявляется с помощью электрофореза в агарозном геле. В указанной статье авторы приводят следующие методики:
1. 9 г свежих листьев хмеля замораживали в жидком азоте и измельчали до порошкообразного состояния.
2. Добавляли к измельченным листьям 19 мл экстрагирующего буфера (Буфер содержит 100 мМ ацетата натрия, 50 мМ ЭДТА, 500 мМ NaCl, 2% поливинил пиролидона, 1,4% SDS, 60 мМ цистеина, рН 5,5).
3. Смесь инкубировали 30 мин при 65°С.
4. Дважды проводили очистку смесью хлороформ / изоамиловый спирт (24:1).
5. Преципитация ДНК этанолом.
6. Осажденную ДНК растворяли в буфере, содержащем 10 мМ Tris и 1 мМ ЭДТА рН 8.
Условия проведения ПЦР с STS праймерами:
Начальная денатурация: 3 мин, 94°С.
Конечный синтез: 7 мин, 72°С.
Предлагаемые нами молекулярные маркеры (две комбинации олигонуклеотидных праймеров) пригодны для определения пола у широкого спектра сортообразцов хмеля. Они были опробованы на 33 мужских линиях и 53 сортобразцах (женских растениях) хмеля. Были испытаны образцы местных популяций, сорта хмеля различного эколого-географического происхождения, в том числе российские, некоторые европейские и американские сорта (см. прилагаемую таблицу). Во всех случаях пол растений был определен правильно.
Для решения указанной задачи предлагаются две комбинации олигонуклеотидных праймеров, обеспечивающих амплификацию специфичных для мужских растений фрагментов ДНК:
11 OF 5′ GGG ACT CGG TAA CAC AGA AAG GCA
110R 5′ AGC CCC ACC TAC ACC ACG АСА АСС
(амплификация фрагмента ДНК длиной 542 пар нуклеотидов)
422F 5′ CAG TGT TTC TCT CGG GTT CTC TTG
422R 5′ ААС CAC АСА TAA TTC CCA TCT TGC
(амплификация фрагмента ДНК длиной 387 пар нуклеотидов)
Для предлагаемых комбинаций праймеров: 110F, R и 422F,R были подобраны условия проведения ПЦР, обеспечивающие хорошо воспроизводимую амплификацию специфичного фрагмента у мужских растений хмеля, проявляющегося при форезе в виде яркой полосы. На фиг.3 стрелками указаны специфичные для мужских растений (обозначены цифрами 1, 2, 3) фрагменты ДНК размером около 542пн и 387пн, полученные с комбинациями праймеров 110F,R и 422F,R соответственно. У женских растений (обозначены цифрами 4, 5, 6) указанные фрагменты ДНК не амплифицируются.
Для определения пола растений необходимо:
3) провести форез в агарозном геле.
Выделение ДНК (метод SDS).
1. Смешать измельченный образец (10-20 мг высушенных лиофилизацией листьев хмеля) с 600 мкл SDS-буфера (100 мМ Трис-PH, рН 8, 50 мМ Na2EDTA, 500 мМ NaCI, 1,25% SDS, 2% поливинил пиролидона, непосредственно перед использованием добавить в буфер 40-50 мг Na2S2O5 на каждые 10 мл). Пробирки инкубировать 45 мин в водяной бане при 60°С, переворачивая каждые 15 мин.
2. Добавить 1 объем смеси хлороформ / изоамиловый спирт (24:1), перемешивать 10-15 мин, затем центрифугировать 10 мин при 10000 об/мин.
3. К надосадочной жидкости, перенесенной в новую пробирку, добавить 0,7 объема изопропанола, центрифугировать 10 мин при 10000 об/мин.
Условия проведения ПЦР
Полимеразная цепная реакция проводилась в амплификаторе Терцик МС2 (АО ДНК-технология, Москва). Реакционная смесь для ПЦР объемом 25 мкл включает: Taq-буфер (Силекс М) (70 мМ Трис-HCl, рН 8,6 (25°С), 0,001% Тритон X 100, 16,6 мМ (NH4)2SO4, 2,5 мМ MgCl2),
0,25 мМ каждого dNTP (Силекс М),
0,5 мкМ каждого праймера (ЗАО Синтол),
100-150 нг ДНК, 1 ед. Taq-полимеразы (Силекс М),
В пробирки поверх раствора добавить 25 мкл минерального масла.
| Циклы ПЦР: | |
| начальная денатурация: 94°С | 5 мин |
| 30 циклов: | |
| 94°С | 1 мин |
| 110F, R-58° 422F,R-60°C | 1,5 мин |
| 72°С | 45 сек |
| конечный синтез: 72°С | 7 мин |
Для фореза можно использовать 1.5% агарозный гель и 0,5х Трис-борат буфер (0,089М Трис, 0,089М борная кислота, 0,002М ЭДТА).
Таким образом, способ молекулярного маркирования позволяет определять пол гибридных растений хмеля на стадии сеянцев, что повышает эффективность селекции за счет сокращения затрат труда, средств, площадей (в теплицах или в поле) и времени (1-2 года), требуемых на возделывание мужских гибридных растений хмеля до начала цветения, когда появляется возможность их отбраковки.
Способ молекулярного маркирования пола хмеля обыкновенного (Humulus lupulus L), включающий проведение полимеразной цепной реакции (ПЦР), отличающийся тем, что используют комбинацию олигонуклеотидных праймеров 5′ GGG ACT CGG TAA CAC AGA AAG GCA и 5′-AGC CCC ACC TAC ACC ACG ACA ACC, которая обеспечивает синтез специфичного для мужских растений хмеля фрагмента ДНК размером 542 пн, и комбинацию олигонуклеотидных праймеров 5’CAG TGT TTC TCT CGG GTT CTC TTG и 5′ AAC CAC ACA TAA TTC CCA TCT TGC, которая обеспечивает синтез специфичного для мужских растений хмеля фрагмента ДНК размером 387 пн.
Как определить зрелость хмеля для пивоварения
Хмель обыкновенный — это вид травянистого, вьющегося растения принадлежащее к семейству коноплевых. За свои полезные, уникальные природные качества хмель очень широко используется в народной и традиционной медицине, косметологии, в пищевой промышленности. Но особую ценность растение приобрело в производстве пива, без него невозможно сварить качественный хмельной питьевой продукт.
Хмель двудомное растение, мужские и женские соцветия растут на отдельных друг от друга кустах.
Для пивоварения используются только женские соцветия, которые имеют форму шишки с расположенными попарно чешуйками.
Это важный и один из самых основных компонентов в пивоварения. Люди которые ежегодно сами варят хмельной напиток в домашних условиях, стараются выращивать это растение самостоятельно. Хмель неприхотлив и отлично произрастает в умеренном климате. Для хорошего роста и плодоношения вьющемуся насаждению необходим хорошо освещаемый солнцем участок, регулярный полив и высокие опоры предназначенная для вьющихся лиан. Рачительные хозяева ежегодно делают обрезку кустов, что повышает урожайность.
Время сбора хмеля
Для пивоваров главным ингредиентом являются шишки хмеля. Время сбора — это очень важный и ответственный момент, от которого полностью зависит качество пива. Недозрелые шишки не годятся для варки пива, так как в них еще не накопилось достаточное количество лупулина и дубильных веществ. Перезрелые плоды с грязно — коричным налетом также не пригодны для пивоварения, потому что важные, очень нужные компоненты на такой стадии зрелости не сохраняются.
Правильно сориентироваться в сроках сбора можно путем наблюдения за внешним видом соплодий. Это следует делать с первых чисел августа и тогда невозможно будет упустить время сбора урожая.
Соплодия растения, собранные в начале созревания, с давних времен применяются в изготовлении пива. Имеющиеся в хмеле дубильные вещества способствуют брожению сусла и не допускают прокисания готового напитка. Ароматные смолы, эфирные масла, лупулин обеспечивают пивному напитку своеобразный, приятный горьковатый вкус.
Количество горьких веществ в шишках напрямую зависит от сорта хмеля, от климатических условий, от местности произрастания и способов возделывания культуры. Также от сроков уборки урожая. Наибольшее количество горьковатых веществ содержится в соплодиях собранных в начальной стадии побурения.
Хмель собирают с середины августа до конца лета, а иногда и в сентябре. Сухая, тонкая, упругая с ароматным запахом и наполненная желтой хмелевиной — это зрелая шишка. Срезка урожая производится только в сухую, солнечную погоду.
Признаки зрелого хмеля
Без этого душистого представителя флоры невозможно приготовить вкусный янтарный напиток. Поэтому следует опираться на многолетний опыт домашних мастеров пивоварения, которые безошибочно определяют зрелость хмеля по особым признакам:
Окрас соплодий
Наступивший момент сбора урожая подскажет окраска шишек, чешуйки которых должны иметь ярко выраженный золотисто — желтоватый оттенок. Если природное сырье приобрело жёлто-коричневатый окрас, то оно не годится для изготовления пива. Тяжелые, зеленоватые плоды также непригодны.
Состояние шишек
Созревшие, готовые к производству экземпляры должны быть покрыты плотно прилегающими к сердцевине шишки липкими чешуями. После сдавливания плод должен быстро принимать первоначальную форму.
Наличие желтоватого порошка
Опытные пивовары знают как определить зрелость хмеля и, чтоб удостовериться в полной зрелости шишки растирают ее между ладонями. После этой манипуляции на руках должно остаться порошкообразное вещество желтоватого цвета с приятным запахом — это лупулин. Такой хмель подходит для приготовления горьковатой влаги. Шишки, не выделяющие порошок для этой цели не подходят.
На правах совета
* Чтобы шишка при высыхании не распалась ее следует срывать вместе с цветоножкой.
Сорванный материал следует хорошо высушить. Для этого нужно подготовить специальные подходящие для этой важной операции условия. Отвести место в хорошо проветриваемом тенистом помещении. Разложить шишки тонким слоем на холщовую ткань или толстую бумагу и сушит в течении нескольких дней. В помещении, отведенном для сушки, не должно быть влажным или холодным.
Под прямыми лучами солнца сушить нельзя, так как большинство полезных веществ и приятный запах улетучатся.
Высушенные шишки можно хранить в тканевых мешках довольно продолжительный срок. При правильном хранении они не теряют своих полезных качеств на протяжении двух — трех лет.
Как определить пол хмеля
В результате изучения механизмов определения пола хмеля обыкновенного были созданы цитогенетические методы определения пола [1, 2]. Использование этих методик, однако, сопряжено с рядом неудобств. Митотические хромосомы хмеля плохо различимы, а наблюдение мейотических хромосом бессмысленно, так как возможно не ранее первого цветения растений, когда их пол будет уже и так очевиден. Кроме того, методика цитогенетических исследований трудоемка и требует специалистов соответствующего уровня. Для хмеля японского был разработан субтеломерный маркер для in situ гибридизации [6], однако набор половых хромосом японского хмеля отличается от набора половых хромосом хмеля обыкновенного, что делает этот маркер неприменимым для хмеля обыкновенного. Позднее появились тест-системы, основанные на ПЦР с Y-специфичной мишенью. Основной проблемой разработки подобных систем является малое количество Y-специфичных последовательностей в открытом доступе. Яковин с соавт. [7] произвели лазерную микродиссекцию полового бивалента с созданием библиотеки полоспецифичных ДНК-фрагментов, однако работа выполнена на другом виде хмеля (хмеле японском Humulus japonicus), у которого система детерминации пола отличается от таковой у хмеля обыкновенного. Появление геномных сиквенсов хмеля обыкновенного [8] не улучшило ситуацию, так как в этой работе были отсеквенированы женские растения. Polley с соавторами создал на основе RAPD-маркера OPJ-09 ПЦР-тест-систему [9] с обнаруженной Y-специфичной мишенью. Данная тест-система успешно применялась для научных исследований [10]. Gao с соавторами также пытались применить RAPD-маркер для полоидентификации у Humulus scandens L. [11]. Однако для массового рутинного применения использование ПЦР-тест-систем в классическом варианте (с детекцией результатов с помощью агарозного электрофореза) нежелательно из-за высокого риска развития контаминации реактивов и пластика ПЦР-продуктами, поэтому нами на основе маркера OPJ-09 была разработана новая тест-система на основе ПЦР в режиме реального времени (ПЦР-РВ), лишенная данных недостатков. Кроме того, произведена попытка создать ПЦР-РВ-тест-систему на основе фрагмента AJ831218.1 [12].
Цель исследования: изучение последовательности опубликованных молекулярных маркеров для определения пола у хмеля обыкновенного, а также разработка тест-системы для ПЦР-РВ на их основе.
Материалы и методы исследования
В работе использовались 5 образцов растений хмеля обыкновенного (Humulus lupulus L.) известного пола – 2 женских (№ 1, 2) растения и 3 мужских (№ 3, 4, 5). Эти образцы собрали в районе д. Корж (Псковская область) с пяти взрослых растений в фазе цветения. Пол определен по строению генеративных органов. Определение вида (H. lupulus) произведено по ботаническим признакам. Образцы листьев этих растений высушили и транспортировали при комнатной температуре. Кроме того, в работе использовали 8 растений неизвестного пола. Растения получены в виде семян, пророщены и укоренены. На момент исследования эти растения ещё не сформировали генеративных органов. Из них 6 сортовых растений сортов Amarillo (A1, A2, A3), Crystal (C1 и С2) и Nugget (N). ДНК этих растений выделяли из свежих листьев. Выделение ДНК производилось CTAB-методом (Doyle and Doyle, цит. по [13]).
В работе использовали праймеры STS, подобранные Polley с соавт. на основе RAPD-маркера OPJ09 [9]. Праймеры ITS [12] (универсальные праймеры на кластеры рибосомных генов растений и грибов) использовали для проверки пригодности ДНК к ПЦР, чтобы исключить ложноотрицательные результаты, которые могут быть вызваны недостаточным качеством ДНК, что при выделении ДНК из растений наблюдается нередко. Кроме того, нами произведен подбор праймеров для ПЦР-РВ на основе последовательности AJ831218.1 из работы по поиску полоспецифичных маркеров для хмеля обыкновенного [12].
Постановка ПЦР производилась в пробирках объемом 600 мкл, объем реакционной смеси – 20 мкл на пробирку. Состав реакционной смеси для ПЦР с праймерами STS [9] и ITS: 1х буфер для Taq-полимеразы, 2,5 мМ магния хлорид, 0,125 мМ трифосфаты нуклеотидов 0,25мкМ праймер прямой, 0,25 мкМ праймер обратный, 0,125 е.а./мкл Taq-полимераза, 0,2 % БСА. Состав реакционной смеси для ПЦР-РВ: 1х буфер для Taq-полимеразы, 2,5 мМ магния хлорид, 0,125 мМ трифосфаты нуклеотидов 0,25 мкМ праймер прямой, 0,25 мкМ праймер обратный, 0,125 мкМ зонд, 0,125 е.а./мкл Taq-полимераза, 0,2 % БСА.
Использовали праймеры STS (STSF: ACAGAGTACAACTCAG-AAACAAACC, STSR: AAGGTCGCACAATGACCG) [9], ITS (ITS4:TCCTCCGCTTATTGATATGC, ITS5: GGAAGTAAAAGTCGTAACAAG). [14]. HLRTF TTGGCCGTCCTCTCTATCGTA HLRTR: CCCTATTTGTGGCTGGTGTAAT HLRTPR: FAM-TCATGTGAGTGGAGAAAAACCCTAATCC-BHQ1 HLRT2F: CTATGCCAACTTGAAGAGGGAT, HLRT2R: ACCTTCCTGACTCCAACGTAGA, HLRT2Pr: FAM- TATGAAACACTTCTCTTTTAAGGTGGTGCC- BHQ1.
Реакцию с праймерами STS проводили по программе: начальная денатурация – 94 °С (5 мин), далее 45 циклов: 94 °С (15 с), 54 °С (30 с), 72 °С (60 с), финальная элонгация – 72 °С (5 мин). Реакцию с праймерами ITS4/5 проводили по программе: начальная денатурация – 94 °С (5 мин), далее 40 циклов: 94 °С (5 с), 55 °С (30 с), 72 °С (40 с), финальная элонгация – 72 °С (5 мин). Анализ результатов ПЦР произведен методом электрофореза в агарозном геле. Продукты ПЦР-реакции с праймерами STS были секвенированы. Подбор праймеров и зондов для ПЦР в режиме реального времени на основе полученных сиквенсов производился вручную в программе Vector NTI (Invitrogen). Анализ сиквенса производился путем поиска гомологичных последовательностей с помощью базы данных NCBI. Реакцию с праймерами для ПЦР-РВ ставили в приборе АНК-32 (ИАП, Санкт-Петербург) по программе: начальная денатурация – 95 °С (3 мин), далее 40 циклов: 95 °С (15 с), 60 °С (30 с), 72 °С (30 с) с детекцией флюоресценции по каналу 1.
Результаты исследования и их обсуждение
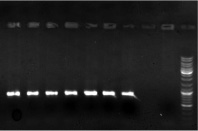
Произвели выделение ДНК c получением 13 препаратов тотальной ДНК, их ПЦР-пригодность определили с помощью реакции с праймерами «ITS4-ITS5», которая успешно прошла на всех образцах (рис. 1).
Рис. 1. Результат реакции с праймерами ITS4-ITS5 для проверки пригодности выделенной ДНК к ПЦР (первые 7 образцов). Вторая и третья дорожка справа – отрицательные контроли, первая дорожка справа – маркер молекулярного веса (Gene Ruler DNA Ladder Mix (Fermentas))
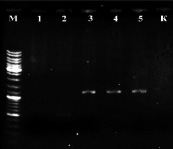
На всех образцах была поставлена ПЦР с праймерами STS [9] В результате постановки ПЦР на растениях известного пола был получен положительный результат: ПЦР-продукт ожидаемой длины (
1100 п.н.) на ДНК из растений мужского пола и отсутствие этого продукта у растений женского пола (рис. 2, а).
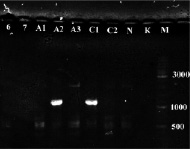
Рис. 2. а) Результат ПЦР с праймерами STS пяти образцов растений известного пола: женского (1, 2) и мужского (3, 4, 5). К – отрицательный контроль, М – маркер молекулярного веса (Gene Ruler DNA Ladder Mix (Fermentas)); б) Определение пола у 8 экземпляров H. lupulus с помощью ПЦР с праймерами STS. A-Amarillo, C-Crystal, N-Nugget. Растения А2 и С1 – мужские. К – отрицательный контроль, М – маркер молекулярного веса (Gene Ruler DNA Ladder Mix (Fermentas))
Таким образом, с помощью ПЦР на ДНК растений известного пола подтверждена работоспособность данной тест-системы и целевой характер полученных ампликонов. Также с помощью этой системы проверили все остальные растения (рис. 2, б), выявлено два мужских растения (A2 и С1), все остальные исследованные сортовые растения оказались женскими. ПЦР-продукты очистили с помощью препаративного электрофореза в агарозном геле и отсеквенировали по Сенжеру, так как на момент проведения работ сиквенс маркера OPJ-09 из работы [9], опубликованный затем в [15], ещё не был доступен. Сиквенс депонировали в базе данных NCBI (KY348696). Реальная длина фрагмента вместе с праймерами оказалась равна 1116 п.н. (рис. 3). Произвели изучение отсеквенированного фрагмента с помощью поиска гомологии в базе данных нуклеотидных последовательностей NCBI. Ввиду наличия в доступе черновых вариантов геномного сиквенса хмеля обыкновенного [8] они также были задействованы. Для геномного секвенирования в работе [8] использовались женские растения, поэтому эти сиквенсы не могут содержать Y-хромосомные последовательности. Однако оказалось, что более половины сиквенса ПЦР-продукта с праймеров STS представлены районом, гомологичным каким-то другим хромосомам хмеля. Каким именно (X-хромосоме или аутосомам), к сожалению, сказать нельзя, так как данные геномного секвенирования в работе [8] являются предварительными и хромосомная принадлежность собранных сиквенсов не определена. Район гомологии начинается от 450 нуклеотида и продолжается вплоть до праймера STSR (рис. 3). Алгоритм поиска обнаруживает в геномных сиквенсах хмеля обыкновенного несколько фрагментов (четыре представленных на рис. 3, б, и ещё четыре с более короткими областями гомологии).
Рис. 3. Выравнивание полученного сиквенса фрагмента Y-хромосомы (KY348696) с праймеров STS (а) и контигов, полученных геномным секвенированием женских растений хмеля [8] (б), а также маркера OPJ-09 [9, 15] (в). Показано положение праймеров STS и компонентов тест-системы для ПЦР-РВ)
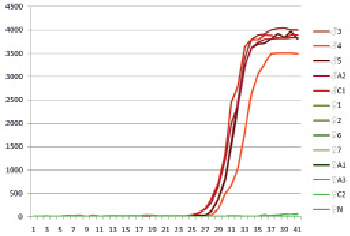
Рис. 4. Результат испытания тест-системы HLRT2 на ДНК растений H. lupulus. Виден рост интенсивности флюоресценции при постановке реакции с ДНК мужских растений
Идентичность этих последовательностей довольно высока и варьирует от 94 до 97 %. По всей видимости, фрагмент, заключенный между STS-праймерами, весьма консервативен, так как полученный нами сиквенс (KY348696) совпадает с опубликованным в [15] сиквенсом маркера OPJ-09 (KX688593.1) почти полностью за исключением трех однонуклеотидных замен. Кроме указанных на рис. 3 последовательностей, обнаружено также несколько более коротких Интересно, что для остальной части сиквенса KY348696 (не гомологичной другим хромосомам хмеля) не удается найти никаких аннотированных гомологичных последовательностей.
Очевидно, что для конструирования тест-системы для ПЦР-РВ ввиду выявленного для части фрагмента отсутствия полоспецифичности пригодна только часть, прилегающая к праймеру STSF. С учетом данного требования нами была сконструирована диагностическая тест-система HLRT2, предназначенная для ПЦР-РВ и состоящая из праймеров HLRT2F, HLRT2R и флюоресцентно меченного зонда HLRT2Pr с красителем FAM и гасителем BHQ1. Тест-система HLRT2 сработала корректно, дав положительный сигнал на всех образцах мужской ДНК и отсутствие положительного сигнала на ДНК женских растений (рис. 4). Результаты работы тест-системы HLRT2 полностью совпадают с результатами работы тест-системы STS. Таким образом, нами разработана тест-система на основе ПЦР-РВ, пригодная для определения пола у хмеля.
Попытки создания тест-системы на основе сиквенса AJ831218.1 [12] с праймерами HLRTF, HLRTR и HLRTPr не увенчались успехом – разработанная тест-система срабатывала на ДНК всех использованных в работе растений, вне зависимости от их пола. По результатам анализа последовательности AJ831218.1 с помощью выравнивания с геномной ДНК H. lupulus обнаружили похожую с KY348696, но ещё более выраженную картину – почти весь сиквенс (304 п.н. из 471) высокоидентичен последовательностям ДНК из женского растения, что объясняет неудачу с изготовлением ПЦР-РВ-тест-системы на базе данного маркера. При этом в данном случае обнаруживается более сорока контигов, содержащих более или менее протяженные области гомологии с AJ831218.1, что может свидетельствовать о высокой копийности данной последовательности.
Выводы
На основе полученного сиквенса нами разработана новая тест-система на основе метода ПЦР в режиме реального времени, которая была испытана на разных растениях различных сортов и показала свою работоспособность. При анализе последовательностей молекулярных маркеров дляопределения пола у H. lupulus с помощью выравнивания на черновой вариант геномного сиквенса женского растения H. lupulus обнаружены области почти полной гомологии с фрагментом хромосом женского растения. В частности, не исключено, что полученный нами сиквенс захватывает границу псевдоаутосомного региона Y-хромосомы.
Авторы работы выражают искреннюю благодарность к.б.н. Д.Е. Полеву за помощь в получении семенного материала и к.б.н. Е.А. Андреевой за всестороннюю помощь и поддержку.
Необыкновенный хмель обыкновенный
Исторические документы свидетельствуют о том, что в России с хмелем были знакомы уже в Х веке. Дикий хмель использовали для приготовления пива, браги и слабых алкогольных напитков.
Сегодня шишки хмеля — незаменимое сырье для пивоваренной промышленности. Содержащиеся в них специфические смолистые и дубильные вещества, эфирные масла придают пиву характерный хмелевой аромат, горький вкус способствуют пеностойкости.
Хмель обыкновенный используют в качестве лекарственного растения. Для этого собирают женские соцветия (шишки), когда они приобретают зеленовато-желтую окраску. Эфирное масло и особые смолы, которые содержатся в соцветиях, обладают мягким успокаивающим действием. Экстракты хмеля входят в состав многих седативных лекарственных препаратов, наиболее известные среди них — валокордин, седавит, уролесан. Травяная подушка, наполненная шишками, — отличное средство от бессонницы, а отвар шишек издавна использовали как средство для укрепления волос. Хмель обладает успокаивающим, снотворным, противосудорожным, болеутоляющим и антибактериальным действиями. Он помогает при отеках, язвенной болезни, воспалении слизистой оболочки желудка.
Что любит хмель
Хмель — многолетняя трудоемкая техническая культура. Растет на одном месте 20 и более лет. Требует умеренно теплого и влажного климата. Оптимальная среднесуточная температура воздуха во время вегетации +15—17°С, без резких колебаний днем и ночью. Слабые весенние заморозки приводят к пожелтению растений. При более сильных заморозках (–5°С) побеги теряют тургор и выглядят увядшими, но со временем восстанавливаются, хотя на стеблях остаются изгибы, сильно уменьшается урожай шишек. Высокие урожаи хмеля получают в местностях, где сумма годовых осадков составляет 500—600 мм с равномерным распределением их по периодам роста и развития растения.
Хмель требует хорошо окультуренных, правильно обработанных плодородных почв (желателен богатый плодородный суглинок, влажный, но не переувлажненный, с песчаной, пропускающей воду подпочвой). Лучше развивается в полутенистых местах, но может расти и на солнце. Для его выращивания используют шпалеры для поддержки надземной части растений и сушилки для обработки готового сырья. Стебли хмеля, своевременно заведенные на поддержки, растут очень быстро. При благоприятных условиях суточный прирост их в июне достигает 20—25 см, а в некоторых случаях и больше.
Всходы — побеги от подземной части стеблей — появляются ранней весной, как только оттает и прогреется почва. В этой фазе проводят обрезку хмеля.
Рост стеблей и развитие листьев начинаются с развития на стебле первой пары листьев. В этой фазе проводят рамование, заводку стеблей на поддержки, подкормку и рыхление междурядий.
Появление и рост боковых ветвей продолжаются до начала цветения. В этот период интенсивно растут стебли, боковые ветви, образуются цветоносные побеги и соцветия. Проводят подкормку, окучивание, рыхление междурядий, пасынкование, удаление нижних листьев и пинцировку боковых ветвей. Продолжительность цветения зависит от биологических особенностей сорта, метеорологических условий, освещения.
Формирование шишек начинается с разрастания прицветковых и покровных чешуек и продолжается до начала технической спелости. Шишки интенсивно растут, образуя лупулиновые железки, в которых накапливаются горькие вещества. Техническая спелость шишек наступает тогда, когда шишки становятся упругими, приобретают золотисто-зеленый цвет и хмелевой аромат. Содержание горьких веществ повышается и достигает максимальной величины. Шишки при сдавливании шелестят, лупулиновые железки приобретают ярко-желтый цвет.
Ежегодно зимой надземная масса ветвей и листьев полностью отмирает, сохраняются только подземные утолщенные корневища. Зимний покой подземной части наступает в зависимости от погодных условий: в октябре или в начале ноября. В этот период на хмельниках проводят обрезку стеблей и окучивание на зиму.
Посадка и уход
С осени готовят ямы или канавы глубиной 50—60 см, которые до половины заполняют навозом, а сверху засыпают землей. Посадку проводят весной саженцами или черенками. Расстояние между растениями — 1 м. После посадки растения пропалывают, рыхлят, подкармливают, поливают.
На второй год стеблей образуется меньше, но они растут быстрее и зацветают раньше. Хмель потребляет много питательных веществ и воды, поэтому для обеспечения хорошего и быстрого роста растения надо дополнительно подкармливать и поливать хотя бы первые 2—3 года.
Декоративность
Хмель — интересная культура, используемая для вертикального озеленения, а также маскировки хозяйственных построек и заборов.
Рост в первой половине лета настолько стремителен, что хмель одним из первых оплетает опоры, намного опережая такие декоративные лианы, как девичий виноград, лимонник, жимолость каприфоль. Ежедневный прирост составляет до 20 см. Стебли хмеля представляют собой тонкие, длинные вьющиеся лианы шестигранной формы. Вдоль граней имеются шипы, которыми хмель цепляется за неровную поверхность опоры, поднимается вверх, завиваясь слева направо по ходу часовой стрелки тремя верхними междоузлиями. Стебли хмеля чувствительны к направлению роста. В вертикальном положении они быстро взбираются по опорам, в горизонтальном темпы роста существенно снижаются. Чтобы вырастить сплошную зеленую стену, растения сажают с интервалом 1,5—2 м. Зная эту особенность, можно быстро задекорировать даже самые невзрачные садовые постройки.
Увитый хмелем забор уже во второй половине июня превращается в густую живую изгородь, а каркас из металлических труб становится ажурной беседкой, лишь только побеги сомкнутся на его вершине. Взрослый, хорошо развитый экземпляр хмеля уже к середине лета образует густое переплетение стеблей и листьев.
У хмеля имеется недостаток, обнаруживающий себя в конце лета: нижние листья на лианах желтеют и опадают, оголяя побеги. Вторая и очень серьезная проблема хмельника в жаркое и сухое лето — атаки тли и клещей. Если дать волю вредителям, они ослабят растение, из-за чего оно приобретет неопрятный вид. И еще: корни хмеля легко распространяются за пределы отведенного для них места, поэтому приходится принимать меры, не давая им такой возможности.
Особенности цветения
Хмель — двудомное растение. До цветения мужские и женские растения не имеют различий.
Женские соцветия хмеля колосообразные, из 20—40 очень мелких цветков, густо собранных на короткой тонкой коленчатой оси соцветия. После цветения все составные части женского соцветия сильно разрастаются, изменяются и после многократного увеличения превращаются в шишку хмеля. Шишки хмеля собраны в метелковидные грозди по 40—50 шт.
Мужские соцветия хмеля представляют собой сильно разветвленную метелку, на которой поодиночке на коротких цветоножках расположены мелкие цветки. Мужские цветки начинают цвести на 3—4 дня раньше женских. Высыпающиеся во время цветения пыльцевые зерна могут переноситься ветром на большие расстояния (от 3 до 20 км). Кроме того, мелкие мужские цветки после цветения засыхают и осыпаются, а потому хозяйственной ценности не представляют.
Ценность хмеля обусловлена наличием в нем специфических горьких, дубильных веществ и эфирного масла. Химический состав шишек разных сортов хмеля варьирует и зависит от зоны возделывания: горькие вещества — от 8 до 24%, альфа-кислоты — от 1,5 до 12%, бета-кислоты — от 3 до 7%. Шишки хмеля содержат горькое вещество лупулин, алкалоид хумулин, эфирное масло (2%), гормоны, хлорогеновую кислоту, флавоноиды (кемпферол, кверцетин-3-глюкозид, лейкоцианидин, лейкодельфинин), кумарины, витамины (B1, В2, В6, РР), дубильные вещества (до 3,4%), макро- и микроэлементы, золу. В побегах и листьях имеется большое количество аскорбиновой кислоты.
Размножение
Хмель размножают делением корневищ, корневыми отпрысками, зелеными черенками, реже семенами. Корневища отделяют от основных корней острой лопатой, не выкапывая куста, прямо в земле.
В отделе биотехнологии Института плодоводства для ускоренного размножения в сочетании с оздоровлением растений разработали методику микроразмножения и адаптации сортов хмеля для закладки промышленных плантаций в условиях Беларуси. Это позволяет получить до тысячи микрорастений с одной меристемы. Саженцы, полученные из этих черенков, свободны от фитопатогенной и вирусной инфекции.
Манана КАСТРИЦКАЯ,
ведущий научный сотрудник Института плодоводства,
кандидат сельскохозяйственных наук