хнзм простаты что это такое
Доброкачественная гиперплазия предстательной железы — разрастание железистой ткани и стромы переходной зоны простаты, приводящее к увеличению органа. Аденома простаты может вызывать нарушения мочевыделения: слабую струю мочи, чувство неполного опорожнения мочевого пузыря, частые или ночные позывы, парадоксальную ишурию. Диагноз устанавливают по данным уровня ПСА, ТРУЗИ, урофлоуметрии и опросника оценки симптомов IPSS. Лечение коррелирует с объемом железы, возрастом, сопутствующей патологией и выраженностью симптомов: применяют тактику ожидания, медикаментозную терапию, оперативные вмешательства, включая малоинвазивные методики.
МКБ-10
Общие сведения
Доброкачественная гиперплазия предстательной железы (аденома простаты, ДГПЖ, ДГП) — общая мировая проблема, с которой сталкивается одна треть мужчин старше 50 лет и 90% пациентов, доживших до 85 лет. По статистике, около 30 млн. мужчин имеют мочеполовую дисфункцию, связанную с ДГПЖ, и эта цифра с каждым годом увеличивается. Патология чаще встречается у афроамериканцев с изначально более высоким уровнем тестостерона, активностью 5-альфа-редуктазы, ростовых факторов и экспрессии рецепторов андрогенов (популяционная особенность). У жителей восточных стран аденому простаты регистрируют реже, что, по-видимому, связано с употреблением в пищу большого количества продуктов, содержащих фитостеролы (рис, соя и ее производные).
Причины ДГПЖ
Патогенез
Тестостерон в организме мужчины содержится в различных концентрациях: в крови его уровень больше, в простате — меньше. У возрастных мужчин происходит снижение уровня тестостерона, но уровень дигидротестостерона остается высоким. Значимая роль принадлежит специфичному для простаты ферменту 5-альфаредуктазе, благодаря которой тестостерон переходит в 5-альфа-дигидротестостерон. К его действию максимально чувствительны андрогенные рецепторы и ДНК ядер клеток простаты, которые стимулируют синтез факторов роста и тормозят апоптоз (нарушение программируемых процессов естественного отмирания). В результате старые клетки живут дольше, а новые активно делятся, вызывая пролиферацию ткани и рост аденомы.
Увеличенная простата способствует затруднению мочеиспускания на фоне сужения простатической части уретры (особенно, если рост аденомы направлен внутрь мочевого пузыря) и повышению тонуса гладкомышечных волокон стромы. На начальной стадии патологии состояние компенсируется за счет усиленной работы детрузора, который напрягаясь, позволяет моче эвакуироваться полностью.
По мере прогрессирования появляются морфологические изменения стенки мочевого пузыря: часть мышечных волокон заменяется соединительнотканными. Емкость органа постепенно увеличивается, а стенки становятся тоньше. Слизистая оболочка также претерпевает изменения: типичны гиперемия, трабекулярная гипертрофия и дивертикулы, эрозивные изъязвления и некроз. При присоединении вторичной инфекции развивается цистит. Доброкачественная гиперплазия простаты и застой мочи приводят к обратному току урины, цистолитиазу, гидронефротической трансформации почек и ХПН.
Классификация
В андрологии принято несколько классификаций ДГПЖ. В зависимости от объема железы (его определяют с помощью УЗИ и измеряют в кубических сантиметрах) выделяют малую (до 25 см³), среднюю (26-80 см³), крупную (более 80 см³) и гигантскую аденому (свыше 250 см³). Классификация Гюйона выделяет три клинических стадии ДГПЖ:
Симптомы ДГПЖ
Симптомы зависят от степени обструкции мочеиспускательного канала. Если увеличенная простата сдавливает уретру, появляются жалобы на учащенное мочеиспускание малыми порциями, особенно, в ночные часы, вялую струю, ощущение неполного опорожнения, независимо от частоты мочеиспускания. По мере роста аденоматозных узлов изменяется иннервация, в результате чего возникают ургентные позывы — неконтролируемое желание помочиться с последующим неудержанием мочи.
На продвинутой стадии развивается парадоксальная ишурия — невозможность полностью помочиться с одновременным подтеканием мочи по каплям, что связано с атонией стенок мочевого пузыря, а также с детрузорно-сфинктерной диссинергией — отсутствием синхронной работы между мышцей, ответственной за изгнание урины, и расслаблением сфинктера мочеиспускательного канала. Чтобы опорожнить мочевой пузырь, некоторые мужчины вынуждены мочиться по женскому типу ‒ сидя. Клинические проявления доброкачественной гиперплазии предстательной железы непатогномоничны и могут сопровождать любую обструкцию, включая стриктуру уретры, дивертикул, опухоль и пр., поэтому только на основании оценки симптомов установить диагноз невозможно.
Осложнения
Осложнения гиперплазированной простаты могут включать ряд состояний. На фоне ДГП в 35% проявляется острая задержка мочеиспускания. Остаточная моча имеет свойство кристаллизироваться, в этом случае в мочевом пузыре формируются конкременты с вторичным воспалением. Повышенное внутрипузырное давление способствует образованию пузырно-мочеточниковых рефлюксов, гидронефроза и ХПН. Если рассматривать осложнения терапии аденомы предстательной железы, то существует вероятность развития стриктур уретры после трансуретральной резекции (5-7%), недержания мочи (1-2%), эректильной дисфункции (9-14%), ретроградной эякуляции (74-87%), шеечного склероза мочевого пузыря (2-4%).
Диагностика
Диагноз устанавливается урологом или андрологом. Ректальный осмотр информативен только при условии достижимого расположения опухоли. При пальцевом обследовании простата увеличена, однородна, безболезненна, консистенция ее эластична, срединная бороздка сглажена. Биопсия предстательной железы не является рутинным способом и показана только при подозрении на рак простаты. Пациенту с подозрением на нарушение функции почек необходима консультация нефролога.
Существует специальный опросник, разработанный для оценки степени выраженности симптомов обструкции нижних мочевыводящих путей. Анкета состоит из 7 вопросов, связанных с распространенными симптомами доброкачественной гиперплазии предстательной железы. Частота каждого симптома оценивается по шкале от 1 до 5. При суммировании получают общую оценку, которая влияет на дальнейшую тактику лечения (динамическое наблюдение, консервативная терапия или операция): от 0-7 — слабо выраженная симптоматика, 8-19 — средняя, 20-35 ‒ серьезная проблема с мочеиспусканием. Инструментальная и лабораторная диагностика при ДГПЖ включает:
Дифференциальную диагностику проводят с опухолевым процессом мочевого пузыря или простаты, цистолитиазом, травмой, интерстициальным и пострадиационным циститом, нейрогенным мочевым пузырем, стриктурой уретры, склерозом простаты, меатостенозом, клапанами уретры, фимозом, простатитом.
Лечение ДГПЖ
Терапия аденомы простаты коррелирует со степенью выраженности обструктивных симптомов и осложнений, на выбор тактики лечения влияет возраст пациента и сопутствующая патология. Все существующие способы лечения направлены на восстановление адекватной деривации мочи. Варианты терапии включают:
Прогноз и профилактика
Прогноз для жизни благоприятный, большинству пациентов достаточно длительного (пожизненного) приема современных лекарственных препаратов для нормализации функции мочеиспускания. Необходимость в операции возникает только у 15-20% мужчин. После аденомэктомии рецидив болезни не превышает 5%, малонивазивные методики не дают 100% гарантии исцеления и могут выполняться неоднократно. Улучшению прогноза в последнее десятилетие поспособствовало внедрение малоинвазивных методов лечения, что позволяет минимизировать осложнения, угрожающие жизни больных. Для нормализации эректильной функции необходима консультация андролога-сексолога.
Данные исследований по профилактике рака простаты показывают, что диета с низким содержанием животного жира и красного мяса и высоким содержанием белка и овощей может снизить риск симптоматической ДГПЖ. Физическая активность хотя бы 1 час в неделю на 34% уменьшает вероятность ноктурии.
Рак предстательной железы: почему возникает, симптоматика, методы диагностики и лечения
Введение
Согласно данным множества исследований, отмечается неуклонный рост случаев обнаружения первичного рака предстательной железы (РПЖ). В России это заболевание находится на 4-м месте среди всей онкологии, выявляемой во время профосмотров. Опережает его рак шейки матки, молочной железы и губы. В западных странах рак простаты составляет 25% от всех онкологических заболеваний.
Что такое рак простаты?
РПЖ представляет собой злокачественное новообразование, которое развивается из тканей предстательной железы.
Предстательная железа, или простата, – мужской репродуктивный орган, по размерам схожий с каштаном. Он находится под мочевым пузырем и охватывает передний отдел мочеиспускательного канала.
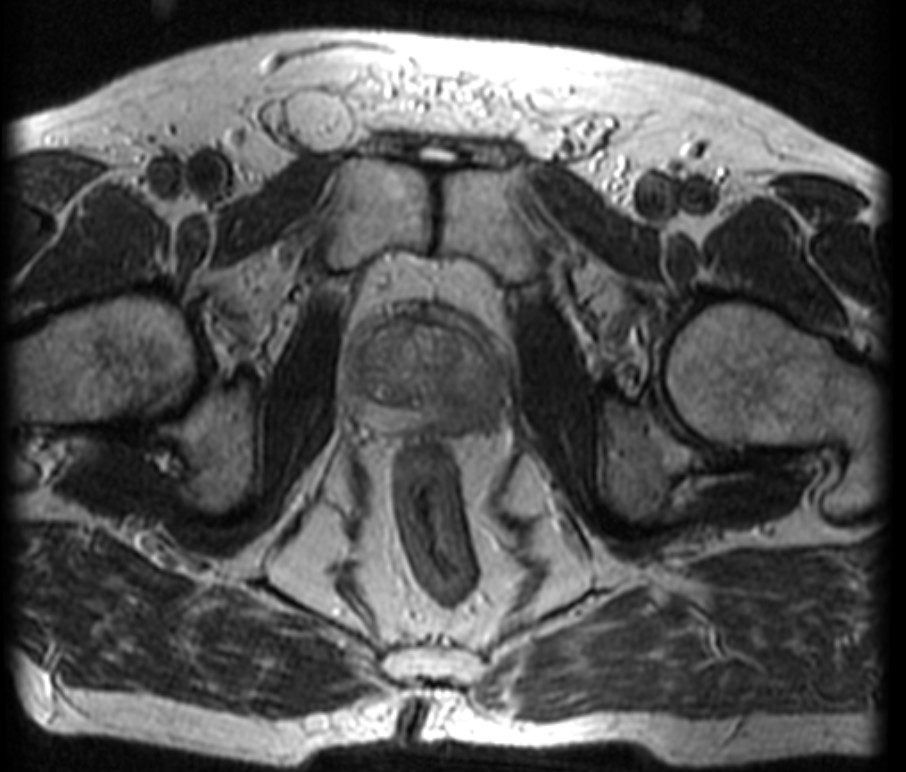
Рис. 1. МРТ (Т2-взвешенные изображения) картина поражения левой доли предстательной железы.
Разновидности рака предстательной железы
В 95% случаев РПЖ развивается из эпителиальных клеток собственных желез (их называют «ацинусы»), из которых сформирована периферическая часть предстательной железы. Эта форма болезни называется «ацинарная аденокарцинома». В остальных 5% случаев диагностируется интрдуктальная разновидность, для которой характерно более агрессивное течение.
Важная характеристика аденокарциномы – степень ее дифференцировки, которая выявляется при гистологическом исследовании биоптата или биоматериала, полученного в ходе операции. Дифференцировка сегодня выражается шкалой Глисона (Gleason), в соответствии с которой присваивается сумма баллов: от 6 (самый благоприятный прогноз) до 10 (самый неблагоприятный вариант).
Характерные признаки заболевания
Риск развития РПЖ растет с возрастом: средний показатель в этой категории заболевших – 68 лет. Существуют также факторы риска, то есть то, что повышает шанс появления онкологического заболевания. Современной медициной не выявлены достоверные факторы, которые приводят к повышению риска развития РПЖ (какие-либо препараты, характер рациона, вредные привычки, плохая экология и др.). Поэтому основным фактором остается возраста, а также возрастной гормональный дисбаланс (между эстрогенами и андрогенами).
Симптоматика, первые признаки
На ранних стадиях злокачественная опухоль обычно не проявляет себя. Кроме аденокарциномы, у людей с повышенным риском развития РПЖ почти всегда присутствуют сопутствующие патологии (простатит, аденома простаты), и они могут давать симптоматику. Чаще всего встречаются следующие симптомы:
Таким образом, чем выше стадия, тем больше вероятность проявления симптоматики. Чаще всего РПЖ обнаруживается во время профилактического обследования (оно рекомендовано всем мужчинам старше 40-ка лет). Такое обследование включает в себя:
ПСА – это маркер, используемый для раннего выявления РПЖ. Он достаточно чувствителен и специфичен, чтобы заподозрить наличие рака на начальной стадии. Кроме ПСА, анализу могут подвергаться его производные – индекс здоровья простаты, плотность ПСА, соотношение свободного ПСА и общего.
Методы диагностики
Основа диагностики РПЖ – биопсия предстательной железы, иными словами, морфологическая верификация.
Показания к биопсии:
Важно! Если уровень ПСА ниже верхней допустимой границы, это не всегда говорит о том, что РПЖ отсутствует. Примерно 25% случаев заболеваемости отмечаются на фоне нормальных значений этого показателя. Поэтому решение о необходимости проведения биопсии должно приниматься после комплексного обследования, которое включает все виды диагностики.
Варианты биопсии простаты:
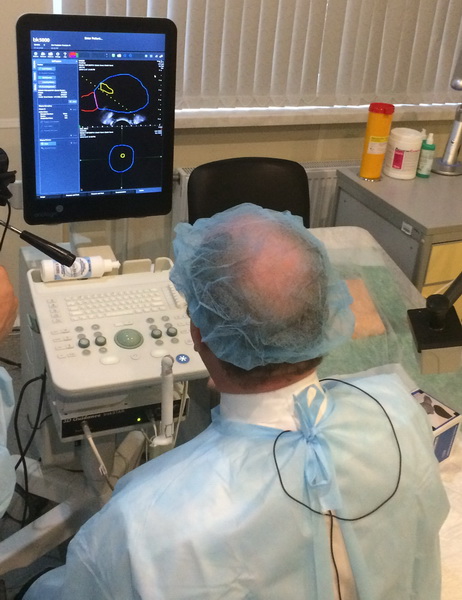
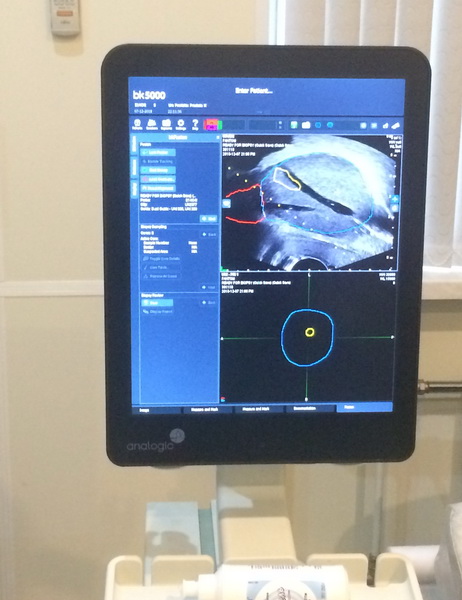
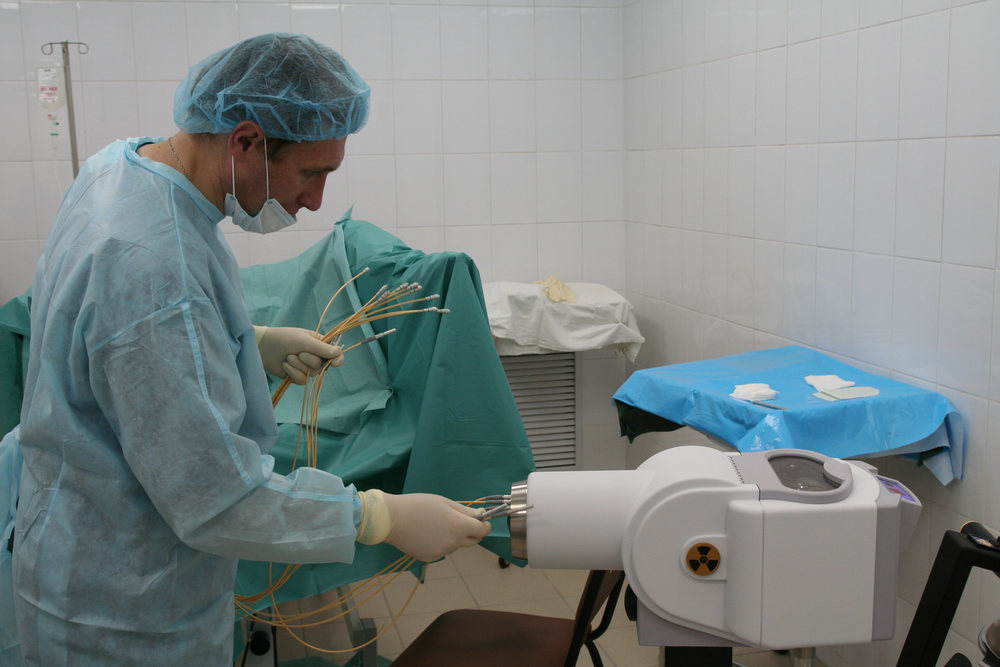
Рис. 2 А., 2 Б. Фьюжн-биопсия. Мастер-класс в НМИЦ онкологии им. Н.Н. Петрова
Стадии рака предстательной железы
Стадирование РПЖ и определение группы риска рецидивирования после возможной терапии производятся после гистологической верификации заболевания.
Стадирование при стандартном подходе подразумевает остеосцинтиграфию и МРТ органов малого таза. Магнитно-резонансная томография нужна, чтобы выявить степень локального распространения процесса в зоне простаты (прорастание в семенные пузырьки, выход новообразования за капсулу железы), а также определить, есть ли поражение регионарных лимфоузлов.
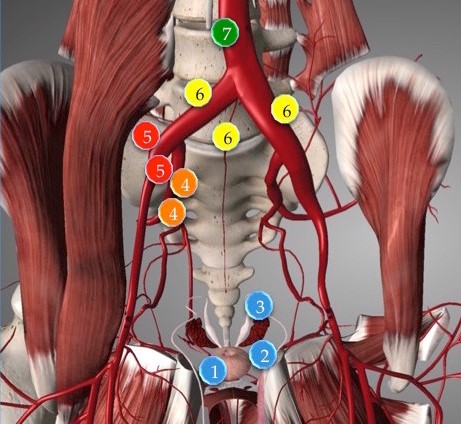
Рис. 3. Пути распространения рака предстательной железы в лимфоузлы таза.
В случае необходимости дополнительно проводится КТ органов груди или брюшной полости.
Цель проведения остеосцинтиграфии – выявление возможного поражения опухолью костей скелета.
Могут назначиться дополнительные исследования – рентгенография (прицельная), УЗИ, урофлоуметрия.
Группа риска определяется, исходя из уровня ПСА на момент до начала терапии, суммы Глисона, согласно данным биопсии, и клинической стадии болезни. Группа риска может быть низкой, промежуточной и высокой. Ее определение крайне важно, чтобы выбрать оптимальный метод лечения.
ПСА от 10 до 20 нг/мл
Методики лечения
В соответствии с результатами многоцентрового проспективного рандомизированного исследования ProtecT (2016) лучевая терапия и хирургическое лечения демонстрируют раную противоопухолевую эффективность и обеспечивают надежный контроль над заболеванием у большинства (более 90%) больных раком предстательной железы с низким и промежуточным риском рецидива заболевания. В настоящее время решающим фактором при выборе противоопухолевого лечения у этой категории больных является безопасность терапии и снижение риска осложнений.
Рассмотрим основные виды терапии: хирургическое лечение, брахитерапия, стереотаксическое облучение, сочетанная лучевая терапия.
Хирургическое вмешательство
РПЭ, или радикальная простатэктомия, представляет собой хирургическое вмешательство по удалению предстательной железы, а также окружающей клетчатки и лимфоузлов. При такой операции с железой единым блоком удаляют семенные пузырьки и участок канала уретры.
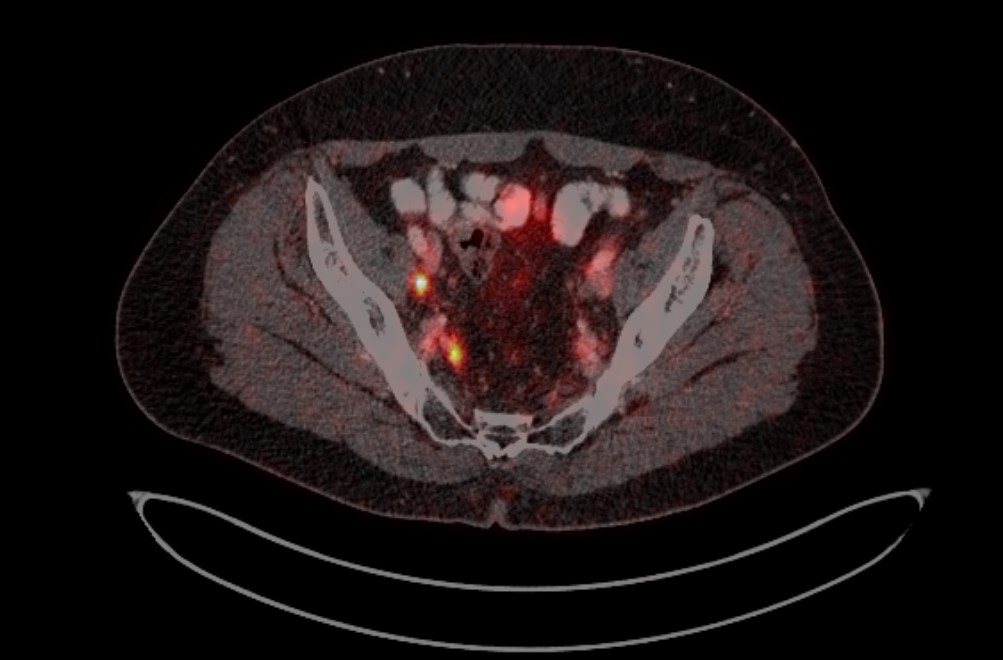
Рис. 4. ПЭТ-КТ изображения больного М. с поражением тазовых лимфоузлов
РПЭ различается по виду доступа и степени инвазивности:
Позадилонный доступ предполагает разрез в нижней части живота, через который удаляется простата и местные ткани.
Промежностная методика – это открытый способ, при котором небольшой надрез делается в зоне между анусом и кожно-мышечным мешком, то есть мошонкой. Методика позволяет удалить простату, но при ее применении нельзя также удалить неблагоприятные ткани и узлы, расположенные около железы. Если после проведения промежностной операции в органах малого таза обнаружатся раковые клетки, нужно будет дополнительно делать лимфаденэктомию. Сейчас промежностная методика применяется крайне редко.
Лапароскопическая методика – наиболее щадящая. Врач имеет доступ к пораженному органу через маленький разрез внизу живота. В него вводится камера и все нужные хирургу инструменты. Камера подает на экран изображение органов малого таза, благодаря чему врач полностью контролирует процесс, а пациент получает минимум вреда. При таком способе минимизированы кровопотери, посторонние органы почти не травмируются, эректильная функция сохраняется частично или полностью и т. д.
Рассмотрим также наиболее распространенные осложнения, которые могут возникнуть после операции на простате:
Брахитерапия
Брахитерапия представляет собой введение в ткани источников излучения. Эта методика – самая «молодая» среди способов лечения РПЖ. Сегодня это один из наиболее востребованных методов облучения простаты, обеспечивающий очень высокую избирательность подведения дозы. Основная особенность брахитерапии заключается в том, что простата облучается изнутри – источник облучения вводится непосредственно в нее. Такой метод дает возможность применять высокие дозы (100-140 Гр и более), при этом избегая высокого риска лучевого поражения не подверженных раку тканей.
Стремительный рост клинического применении брахитерапии, по сравнению с хирургическими вмешательствами, обуславливается высокой эффективностью, которая сопоставима с простатэктомией, при гораздо более низкой частоте возникновения осложнений.
Различают 2 вида брахитерапии, в зависимости от способа введения источника излучения в железу и его мощности:
При проведении низкомощностной брахитерапии в ткани простаты вживляется источник излучения и остается в них до полного распада. Долгое время при РПЖ именно этот вид брахитерапии применялся чаще всего. Наиболее часто для выполнения терапии используется изотоп радиоактивного йода, то есть I125.
Согласно многочисленным исследованиям, брахитерапия низкой мощности обеспечивает не очень высокую точность облучения. Это объясняется смещением источника излучения, изменением формы и размеров простаты, затрагиванием прилежащих здоровых органов. Ввиду этого низкомощностная методика показана в основном пациентам с самыми начальными стадиями, когда опухоль небольшая и не выходит за пределы железы. Такая брахитерапия имеет и другие существенные недостатки. Первый – это высокая частота осложнений, возникающих со стороны мочевыводящих путей, может даже возникнуть острая задержка мочи и необходимость эпицистостомы, то есть формирования надлобкового мочепузырного свища, на долгий срок. В основе осложнений – отек предстательной железы из-за того, что в ней остается несколько сотен зерен (инородных тел). Кроме того, радиоактивные зерна, если они долго находятся в организме, представляют собой источники излучения, представляющие определенную опасность для других людей. Из-за этого контакт пациента с родными ограничен (нельзя близко общаться с маленькими детьми).
Рис. 5. Высокомощностная (высокодозная) брахитерапия
Самая современная методика внутритканевой терапии – высокомощностная брахитерапия. Источники излучения автоматически загружаются и извлекаются. Эта лучевая терапия обладает принципиальным плюсов – высокой точностью облучения, достигаемой путем введения игл под контролем специального УЗ-аппарата. Одновременно в автоматическом режиме рассчитываются дозы и возможность быстрой корректировки плана лучевого лечения. Источник излучения находится в организме пациента временно, поэтому уровень осложнений – самый низкий, по сравнению со всеми радикальными методиками терапии РПЖ, включая низкодозную разновидность брахитерапии.
Технологические особенности методики позволяют предлагать ее большинству больных, вне зависимости от размеров злокачественного новообразования и его распространенности за пределы простаты. Кроме того, высокомощностная брахитерапия – это «золотой стандарт» при комбинированном лечении, то есть одновременном использовании с дистанционным облучением у больных с неблагоприятными характеристиками новообразования.
Самый большой недостаток высокомощностной методики – высокие требования, касающиеся квалификации медицинского персонала, а также необходимость использования высокотехнологичного оборудования. Этим объясняется малая распространенность метода в России.
Противопоказания к брахитерапии подразделяются на общие и урологические. Самые частые урологические противопоказания – это серьезные нарушения процесса мочеиспускания:
Нужно отметить, что большой объем простаты, который имеет значение для низкодозной брахитерапии (50-60 см 3 ), почти не ограничивает возможности лечения в режиме высокомощностной методики.
Данные противопоказания относятся не только к брахитерапии, но и к другим методикам лучевой терапии РПЖ.
Стереотаксическое облучение
СТЛТ (стереотаксическая лучевая терапия) – высокоточная методика лечения очага РПЖ высокими дозами ионизирующего излучения.
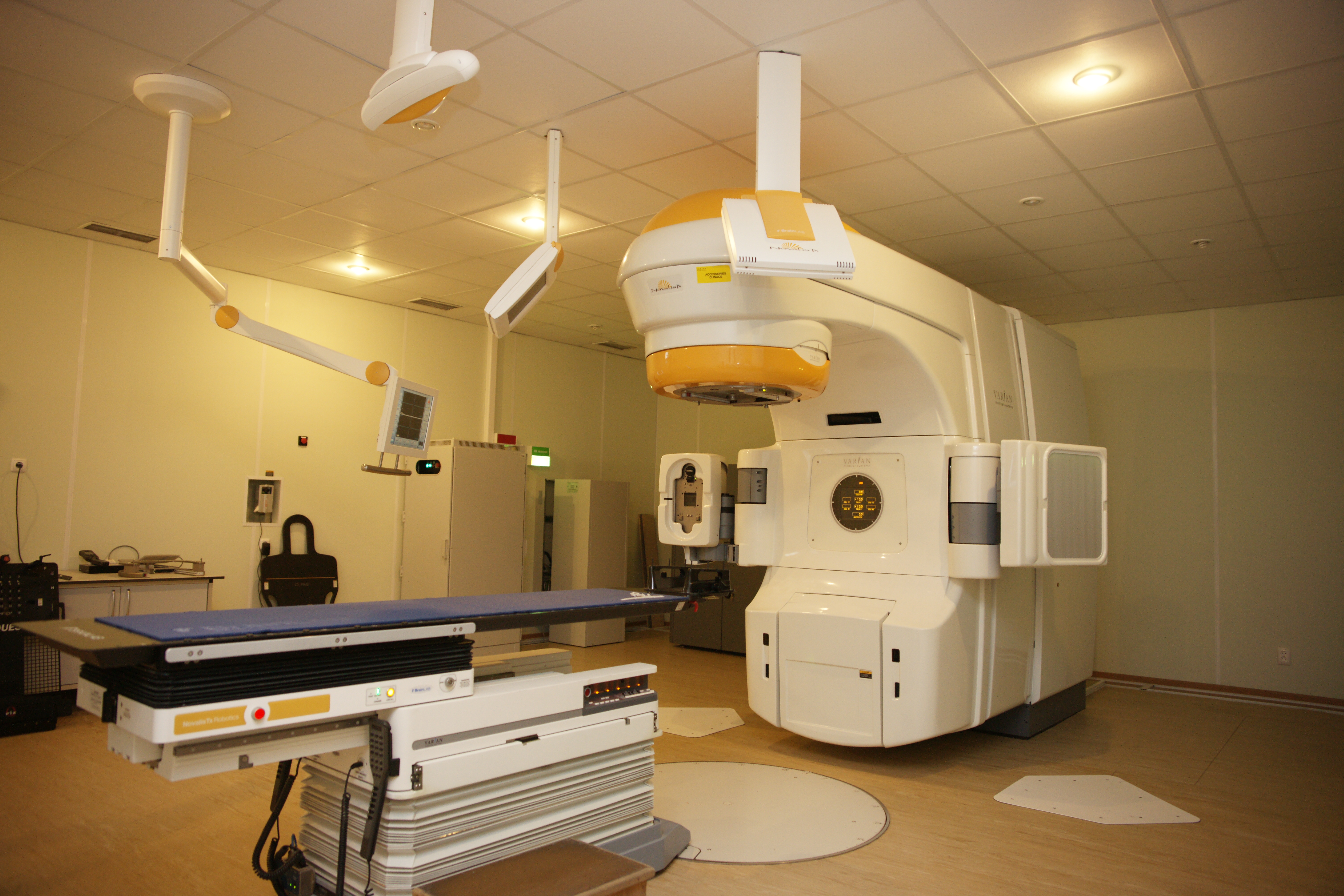
Рис. 6. Стереотаксический лучевой ускоритель
Сегодня СТЛТ при раке простаты реализуется несколькими основными методами, каждый из которых обладает своими особенностями, плюсами и минусами:
Сравнительная характеристика техник СТЛТ простаты
Диагностика и лечение синдрома хронической тазовой боли у мужчин
Одним из наиболее распространенных заболеваний, с которыми сталкивается уролог в своей практике, является хронический простатит (ХП). В общей популяции частота ХП составляет от 5 до 16% (J. C. Nickel, 1999; J. N. Krieger, 2002).
Одним из наиболее распространенных заболеваний, с которыми сталкивается уролог в своей практике, является хронический простатит (ХП). В общей популяции частота ХП составляет от 5 до 16% (J. C. Nickel, 1999; J. N. Krieger, 2002). Столь широкая распространенность ХП отчасти связана с тем, что этот диагноз является так называемой «корзиной для клинически неясных состояний» (Mc. Naughton Collins M., 2000). Подтверждением этому служит тот факт, что более 90% всех случаев ХП относятся к абактериальному простатиту или синдрому хронической тазовой боли (СХТБ) или к категории III простатита, по классификации Национального института здоровья США (National Institute of Health, NIH).
Традиционная классификация простатита предложена G. Drach и соавт. (G. W. Drach, 1978). Согласно этой классификации, в зависимости от наличия лейкоцитов и/или бактерий в моче или секрете простаты простатит разделяли на четыре категории: острый бактериальный, хронический бактериальный, хронический абактериальный и простатодинию.
В 1995 г. рабочая группа по хроническому простатиту NIH утвердила определение СХТБ, как патологического состояния, характеризующегося симптомами боли в сочетании с различными нарушениями мочеиспускания и сексуальными расстройствами. Впоследствии на основании этого определения, а также по данным анализа мочи и секрета простаты в виде воспалительных изменений или бактерий была принята современная классификация простатита (табл.) (J. N. Krieger, 1999).
Несмотря на то что простатит занимает третье место среди заболеваний простаты, до 1990 г. не было проведено ни одного систематического исследования распространенности или частоты встречаемости простатита. Согласно имеющимся в литературе данным, распространенность простатита колеблется от 4 до 14%, а общая частота возникновения составляет 3,1–3,8 на 1 тыс. человек в год (T. D. Moon, 1997; Mc. Naughton Collins M., 1998; R. O. Roberts, 1998; A. Mehik, 2000; J. H. Ku, 2001; J. C. Nickel, 2001). Распространенность СХТБ не зависит от возраста и демографических особенностей. Это состояние встречается в 8 раз чаще, по сравнению с бактериальной формой заболевания, которая составляет около 10% от всех случаев ХП [180]. Заболевание значительно влияет на качество жизни больных, представляя собой важную проблему здоровья мужчин (K. Wenninger, 1996; Mc. Naughton Collins M., 2001; A. J. Schaeffer, 2002).
Вопрос этиологии СХТБ окончательно не решен. Предполагают, что одной из основных причин его возникновения является инфекция нижних мочевых путей. С другой стороны, в литературе появляется все больше доказательств в пользу аутоиммунной теории и химического воспаления простаты в результате интрапростатического рефлюкса мочи. Тем не менее ни одна из этих теорий не является бесспорной, поэтому на сегодняшний день СХТБ принято считать полиэтиологическим заболеванием.
Бактерии являются типичным возбудителем острого и хронического бактериального простатита (W. Weidner, 1991), однако их роль в возникновении СХТБ до сих пор окончательно не определена. Наиболее часто из простаты мужчин с СХТБ выделяются следующие микроорганизмы: грамотрицательные бактерии, такие, как кишечная палочка и энтерококки; также встречаются грамположительные стафилококки, реже — хламидии, микоплазмы и коринобактерии (G. J. Domingue, 1998).
Известно, что течение воспалительных реакций во многом зависит от иммунного статуса организма (J. E. Fowler, 1982; G. J. Domingue, 1998). Не случайно ряд авторов выявили у больных СХТБ повышенную активность Т-клеток на спермальную плазму, что может свидетельствовать об аутоиммунном механизме СХТБ (G. R. Batstone, 2002).
Важную роль в развитии воспалительных реакций у больных СХТБ могут играть цитокины, вырабатываемые в результате нарушенного иммунного ответа. У больных этой категории в спермальной плазме выявлены повышенные количества таких воспалительных цитокинов, как IL-1, IL-1b, IL-6, IL-8 и TNF-a, что указывает на воспалительный процесс в простате и семенных протоках (R. B. Alexander, 1999; W. W. Hochreiter, 2000; I. Orhan, 2001; J. L. Miller, 2002).
В результате изучения экспериментальных моделей интрапростатического рефлюкса мочи у человека (R. S. Kirby, 1985; P. J. Turner, 1996; C. R. Chapple, 1990) и животных (J. C. Nickel, 1990) в настоящее время получено достаточное количество данных, свидетельствующих о том, что повышение внутриуретрального давления во время мочеиспускания и рефлюкс мочи в простатические протоки у ряда мужчин могут служить причиной появления простатитоподобных симптомов (G. A. Barbalias, 1983, 1990; W. J. G. Hellstrom, 1987; A. A. Ghobish, 2000).
Изучая химический состав секрета простаты и мочи, B. Persson и G. Ronquist пришли к заключению, что рефлюкс мочи в протоки предстательной железы вызывает химическое раздражение и воспаление последних (B. E. Persson, 1996). Хроническое воспаление сопровождается высвобождением различных воспалительных медиаторов, таких, как нервный фактор роста, что может обусловливать повышение числа чувствительных С-волокон. Стимуляция этих нервных окончаний приводит к тому, что пациент страдает от постоянных болей. Так, повышение плотности чувствительных окончаний было продемонстрировано на примере процессов, протекающих в мочевом пузыре больных с интерстициальным циститом (при данном состоянии проявления болевого синдрома похожи на боли при ХП) (M. A. Hofmeister, 1997).
Другие аналогичные исследования показали, что конкременты простаты частично состоят из компонентов мочи, попавшей в простатические протоки (C. T. Ramirez, 1980; R. Klimas, 1985). В случае обструкции конкрементом простатического протока повышенное давление внутри протока или непосредственно сам конкремент могут вызвать механическое раздражение и воспаление простатического эпителия.
У ряда больных симптомы СХТБ связывают с миалгией в результате патологического напряжения мышц тазового дна, которое может быть следствием их спастического состояния или поведенческих особенностей. У таких пациентов боль часто возникает в период физической активности или в положении сидя, что сопровождается спазмом мышц тазового дна. При пальцевом ректальном исследовании предстательная железа у этих пациентов чаще нормальная, при этом отмечают спастическое состояние наружного сфинктера ануса и болезненность в парапростатической области (J. W. Segura, 1979; D. A. Shoskes, 1999; D. H. Zermann, 2001).
Иногда причиной СХТБ могут быть ущемление пудендального нерва (V. S. Ricchiuti, 1999), повреждения межпозвоночных дисков в поясничном отделе, опухоли малого таза или спинного мозга и остеит лобковых костей (D. A. Shoskes, 1999).
В настоящее время среди врачей появляется все больше сторонников теории, утверждающей что СХТБ является одним из манифестирующих признаков заболевания, которое можно назвать функциональным соматическим синдромом (J. M. Potts, 2001). Этот синдром включает в себя синдром раздраженного кишечника, хроническую головную боль, фибромиалгию, а также неспецифические дерматологические и ревматологические симптомы.
Психологический стресс играет важную роль при любых хронических болевых синдромах, включая СХТБ (L. Keltikangas-Jarvinen, 1989; J. J. De la Rosette, 1993). Согласно данным A. Mehik и соавт., у мужчин с СХТБ значительно чаще выявляются признаки психологического стресса, чем в контрольной группе здоровых мужчин, сексуальные расстройства отмечают 43% из них и у 17% присутствует канцерофобия (A. Mehik, 2001). У больных с абактериальным простатитом отмечается значительно больше признаков ипохондрии, депрессии и истерии (J. P. Berghuis, 1996).
Клинические проявления и диагностика
Основным симптомом, характеризующим СХТБ, является боль или дискомфорт в области промежности, малого таза, иногда иррадиирующая в нижние отделы спины, живота и наружные половые органы. Одним из типичных признаков является боль во время эякуляции (R. B. Alexander, 1996; J. C. Nickel, 1996; D. A. Shoskes 2004). Симптомы нарушения мочеиспускания стоят на втором месте и встречаются приблизительно у половины больных СХТБ. Следующая группа симптомов — это сексуальные расстройства (A. Mehik, 2001). СХТБ в значительной мере обусловливает возникновение психологических расстройств, снижая тем самым качество жизни больных (L. Keltikangas-Jarvinen, 1989; J. J. De la Rosette, 1993; A. Mehik, 2001). По своей значимости и влиянию на качество жизни СХТБ сравним с такими заболеваниями, как инфаркт миокарда, ишемическая болезнь сердца и болезнь Крона (K. Wenninger, 1996).
Для оценки симптомов хронического простатита в настоящее время используют шкалу NIH-CPPS (National Institutes of Health Chronic Prostatitis Symptom Index) (M. S. Litwin, 1999; J. C. Nickel, 2001), включающую девять вопросов, касающихся всех аспектов СХТБ: боль, нарушение мочеиспускания и влияние на качество жизни. Высокая достоверность шкалы NIH-CPSI была подтверждена в практике первичной медицинской помощи (J. A. Turner, 2003) и в ходе эпидемиологических и клинических исследований (D. A. Shoskes, 1999; A. J. Schaeffer, 2002; P. Y. Cheah, 2003; J. C. Nickel 2003). Шкала NIH-CPSI переведена на ряд иностранных языков и успешно используется (Y. Kunishima, 2002; Mc. Naughton Collins M., 2001; H. Schneider, 2002).
Поскольку диагностировать СХТБ можно лишь методом исключения, целью клинического обследования является исключение каких-либо очевидных заболеваний мочеполовых органов, кишечника, нервной системы и др., способных вызвать имеющуюся боль. Клиническое исследование включает стандартный сбор жалоб и уточнение анамнеза; при этом обращают внимание на ранее перенесенные или рецидивирующие инфекции мочевых путей, заболевания, передающиеся половым путем, и т. д. Также необходимо учитывать имеющиеся сопутствующие заболевания, способные повлиять на возникновение СХТБ (сахарный диабет, нарушения иммунного статуса и т. д.) (R. B. Alexander, 1999).
Клиническое обследование должно включать осмотр и пальпацию наружных половых органов, промежности, паховой области, нижних отделов живота и пальцевое ректальное исследование (R. B. Alexander, 1999). Для уточнения размеров и состояния простаты рекомендуют трансректальное ультразвуковое исследование. Несмотря на отсутствие специфических ультразвуковых признаков СХТБ, у таких больных часто выявляют кальцинаты и конкременты простаты, а также усиление кровотока при допплеровском исследовании (N. F. Wasserman, 1999).
Уродинамическое исследование необязательно проводить всем больных СХТБ, однако при наличии симптомов нарушения мочеиспускания рекомендуются определение объема остаточной мочи и урофлоуметрия. В случае подозрения, возникшего на основании данных урофлоуметрии, на инфравезикальную обструкцию или дисфункциональное мочеиспускание больным показано проведение комплексной уродинамической диагностики, включающей исследование давление/поток с одновременной регистрацией активности поперечно-полосатого сфинктера уретры и профиль внутриуретрального давления.
Анализ мочи является основополагающим тестом в диагностике СХТБ. Общий анализ мочи производят с целью скрининга инфекции мочевых путей и гематурии. Также в диагностический комплекс рекомендуют включать исследование мочи на атипические клетки, позволяющие заподозрить рак in situ (J. C. Nickel, 2002).
Золотым стандартом в диагностике СХТБ остается локализационный четырехстаканный тест, предложенный Е. Meares и Т. Stamey в 1968 г. (E. M. Meares, T. A. Stamey, 1968). В ходе теста исследуют четыре образца: первая порция мочи, средняя порция мочи, ВСП и постмассажная порция мочи. Тест позволяет дифференцировать любую категорию простатита по классификации NIH, а также уретрит. Несмотря на трудоемкость и отсутствие исследований достоверности, исследователи часто ссылаются на этот тест (Mc. Naughton Collins M., 2000).
Более простой тест с исследованием лишь до- и постмассажной порций мочи у лиц с отсутствием уретрита был предложен J. Nickel (J. C. Nickel, 1997). Значительная бактериурия в домассажной порции мочи может быть признаком инфекции мочевых путей или острого бактериального простатита, тогда как преобладание бактериурии в постмассажной порции свидетельствует о хроническом бактериальном простатите. При отсутствии бактерий лейкоцитоз (более 10 в поле зрения), определяемый при микроскопии центрифугированной мочи постмассажной порции, соответствует воспалительной категории СХТБ (IIIA), а отсутствие бактерий и лейкоцитов — невоспалительному СХТБ (IIIБ). Чувствительность и специфичность теста составляют 91%, поэтому он рекомендован в качестве теста первой линии для скрининга простатита.
Определение уровня простатоспецифического антигена (ПСА) является одной из составляющих частей лабораторного диагностического комплекса у больных СХТБ. Как правило, у большинства больных этой категории показатель ПСА в норме, однако у ряда больных возможно повышение уровня ПСА, которое связывают с воспалительным процессом в простате (А. Б. Степенский, 2002; B. S. Carver, 2003). В случае сохранения повышенного уровня ПСА после курса антибактериальной терапии у больных с клиническими проявлениями хронического простатита решают вопрос о биопсии предстательной железы (R. Campo, 1996; C. B. Bozeman 2002).
Методика ПЦР представляет собой современный метод обнаружения прокариотических бактериальных и вирусных нуклеиновых кислот, характеризующийся высокой чувствительностью и специфичностью. Методика позволяет выявить нуклеиновые кислоты в любом материале, взятом из организма, и не требует наличия жизнеспособного микроорганизма, т. е. дает возможность определять внутриклеточные останки погибших бактерий и вирусов. ПЦР можно применять вне зависимости от ранее проведенной антибактериальной терапии. Однако из-за высокой чувствительности и контаминации взятых образцов или реагентов при нарушении технологии возможно получение ложноположительных результатов (S. Keay, 1998; M. A. Tanner, 1998; M. Kawai, 2002).
Лечение СХТБ
При лечении больных СХТБ необходимо отметить значительную роль плацебо-эффекта, благодаря которому может достигаться 30-процентное облегчение симптоматики. Простое наблюдение за такими больными, иногда даже без назначения лечения, позволяет значительно улучшить их состояние (D. A. Shoskes, 1999; Mc Naughton Collins M., 2000; J. C. Nickel, 1996, 2003).
Эффективность антибактериальной терапии при бактериальном остром и хроническом простатитах можно считать общепризнанной. Препаратами первого выбора служат антибиотики из группы фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин), преимуществом которых является широкий спектр действия и способность к высокой концентрации в ткани и секрете простаты (K. G. Naber, 1999). Более высокая эффективность фторхинолонов доказана в ряде сравнительных исследований (W. Weidner, 1991; K. G. Naber, 2000).
Целесообразность применения антибиотиков у больных СХТБ вызывает сомнение. По данным ряда авторов, положительный эффект от антибактериальной терапии наблюдают приблизительно у половины больных СХТБ (G. A. Barbalias, 1998; J. C. Nickel, 2001; D. A. Shoskes, 2003). С одной стороны, выявлена четкая корреляция между положительными данными исследования ПЦР выделенного секрета простаты и результатами лечения антибиотиками (A. R. Shahed, 2000; D. A. Snoskes, 2000), а с другой — до сих пор не ясно, существует ли взаимосвязь между данными бактериологического исследования, количеством лейкоцитов и наличием антител в секрете простаты, а также эффектом от антибактериального лечения (J. C. Nickel, 2001). Фторхинолоны оказывают определенное модулирующее воздействие на медиаторы воспаления (T. Yoshimura, 1996; H. F. Galley, 1997; W. W. Hochreiter, 2000; M.–T. Labro, 2000), а в экспериментах на крысах продемонстрированы обезболивающий и противовоспалительный эффекты антибиотиков (C. Suaudeau, 1993). С учетом отмеченных выше положительных эффектов антибиотиков больным с диагнозом СХТБ, установленным впервые в жизни, в качестве терапии первой линии рекомендуют 4–6-недельный курс антибактериальной терапии (T. Bjerklund-Johansen, 1998; J. C. Nickel, 2001; J. C. Nickel, 2003; D. A. Shoskes, 2003).
Наш опыт применения ципрофлоксацина в терапии 41 больного СХТБ в дозе 500 мг 2 раза в сутки в течение 4 нед свидетельствовал о том, что антибактериальное лечение оказалось действенным у 17% пациентов. Однако продолжительный эффект терапии (более 17 мес) отмечен лишь у 5%, у остальных симптомы рецидивировали в среднем через 5 мес и повторное применение антибактериальных средств не принесло результата. Возможно, у этих больных положительная реакция на прием антибиотиков была связана с эффектом плацебо.
Применение αблокаторов у больных с СХТБ основано на теории дисфункционального мочеиспускания, приводящего к внутрипростатическому рефлюксу. Кроме того, существует еще один механизм действия αблокаторов, заключающийся в улучшении кровотока простаты вследствие снижения давления в ткани простаты за счет расслабления ее гладких миоцитов (A. Mehik, 2003).
Ряд авторов (R. B. Alexander, 1998), располагающих значительным опытом применения α1-адреноблокаторов (альфузозин, доксазозин, тамсулозин, теразозин) при ХП, подчеркивают, что назначение данной группы препаратов на срок менее 6 мес приводит к частому рецидивированию симптоматики. И напротив, более длительное (не менее 8 мес) непрерывное клиническое применение α1-адреноблокаторов приводит к изменению экспрессии α1А-адренорецепторов (уменьшение активности α1А-адренорецептора или увеличению активности конкурентного рецептора), поэтому даже после отмены препарата видоизмененный рецептор демонстрирует свойства α1-адренергической блокады. Неэффективным подобный терапевтический подход главным образом оказывается у больных пожилого возраста, которые чаще имеют ДГП, кроме того, для них характерна большая выраженность воспалительного процесса в предстательной железе. Согласно современным представлениям, назначение αблокаторов относят к эффективным методам лечения больных СХТБ.
По нашим данным, эффективность применения уроселективного αблокатора омника (тамсулозин) 0,4 мг/сут в среднем в течение
6 мес у больных СХТБ составляет 53%. Анализ эффективности в разных категориях СХТБ не выявил статистически значимых различий.
Эффект нестероидных противовоспалительных средств (НПВС) обусловлен их ингибирующим действием на синтез простагландинов. Несмотря на широкое распространение НПВС для лечения больных СХТБ, достоверных исследований их эффективности очень мало. В целом вопрос о применении НПВС у больных СХТБ решается каждым врачом индивидуально (M. A. Pontari, 2002).
Использование ингибитора 5αредуктазы, финастерида (альфинал, проскар, финаст) в лечении больных СХТБ основано на его способности снижать инфравезикальную обструкцию и внутрипростатический рефлюкс за счет уменьшения размеров простаты. Кроме того, уменьшение количества железистого эпителия может приводить к снижению давления в ткани простаты и улучшению ее микроциркуляции. По данным мультицентрового плацебо-контролируемого исследования эффективности финастерида, у больных СХТБ снижение выраженности симптоматики по шкале NIH-CPSI в группе финастерида составило 33%, а в группе плацебо — 16% (J. Downey, 2002).
В литературе также имеются данные, касающиеся использования других медикаментозных препаратов, назначающихся для лечения больных СХТБ. Речь идет о таких лекарственных средствах, как аллопуринол (B. E. Persson, 1996), биофлавоноиды (D. A. Shoskes, 1999), пентосан полисульфат (J. C. Nickel, 2000) и фитопрепараты (D. A. Shoskes, 2002). При использовании этих препаратов отмечен определенный положительный эффект, однако отсутствие контрольной группы не позволяет объективно оценивать полученные данные.
Кроме медикаментозной терапии, для лечения больных СХТБ используют различные методы физиотерапевтического воздействия. Одним из них является локальная гипертермия предстательной железы (В. В. Агаджанян, 1998; S. I. Zeitlin, 2002; А. В. Соколов, 2003). Благодаря минимальной инвазивности и простоте наибольшее распространение получили методики трансректальной (F. Montorsi, 1993; T. Shah, 1993) и трансуретральной микроволновой термотерапии (J. C. Nickel, 1996). По данным различных плацебо-контролируемых исследований, действенность трансректальной микроволновой гипертермии (с использованием аппаратов Primus, Prostatherm, Prostatron, Urawave, Hupertherm Et-100, Termex-2) составляет от 55 до 75%, при этом эффективность плацебо колеблется от 10 до 52% (T. Shah, 1993).
К другим более сложным и инвазивным методикам относят трансуретральную баллонную лазерную гипертермию (T. Suzuki, 1995) и трансуретральную игольчатую абляцию (P. H. Chiang, 1997). Механизм действия локальной гипертермии у больных СХТБ окончательно не ясен. В исследовании A. Zlotta и соавт. в результате проведения трансуретральной игловой абляции продемонстрирован эффект блокады αрецепторов и разрушение ноцицептивных С-волокон (A. Zlotta, 1997). Ближайшие результаты двух небольших неконтролируемых исследований свидетельствуют о высокой эффективности трансуретральной игловой абляции у больных СХТБ (P. H. Chiang, 1997; K. C. Lee, 2002), однако результаты плацебо-контролируемого исследования свидетельствуют об отсутствии различий в улучшении симптомов в группе трансуретральной игловой абляции и плацебо (S. Aaltomaa, 2001). Помимо вышеназванных эффектов отмечают антиконгестивное, бактериостатическое действие, а также активацию клеточного звена иммунитета (A. Sahin, 1998; E. N. Liatsikos, 2000; С. Д. Дорофеев, 2003).
Исторически сложилось так, что основным методом физиотерапии больных простатитом, включая СХТБ, является массаж простаты. Однако до сих пор не существует объективных данных, доказывающих его эффективность. В открытом исследовании комбинации массажа простаты с антибактериальной терапией был отмечен определенный положительный результат, однако в этом исследовании 2/3 больных страдали хроническим бактериальным простатитом, и не были использованы достоверные методики оценки симптомов (J. C. Nickel, 1999). В связи с этим вопрос об эффективности массажа простаты у больных СХТБ остался без ответа. Тем не менее данные исследования, проведенного у 43 мужчин (I. Yavassaoglu, 1999), позволяют говорить о положительном влиянии дренирования простаты в виде регулярных эякуляций на выраженность симптомов СХТБ.
В ряде исследований продемонстрировано определенное улучшение симптомов на фоне биологической обратной связи и упражнений, направленных на расслабление мышц у больных с дисфункциональным мочеиспусканием (G. A. Barbalias, 1990; D. H. Zermann, 2001) и спастическим состоянием мышц тазового дна (S. A. Kaplan, 1997).
Многие исследователи указывают на положительный эффект сакральной нервной стимуляции (H. E. Dijkema, 1993; W. F. Thon, 1999; R. A. Schmidt, 2001) и тибиальной нейромодуляции (M. R. van Balken, 2003) при хронической боли в области таза. Эффективность этих методик колеблется от 21 до 75%. Однако еще не получено убедительных данных, позволяющих говорить о преимуществах этих методов лечения перед плацебо.
Мы применили тибиальную нейромодуляцию у 21 больного СХТБ, у которых отсутствовал эффект от различного вида медикаментозной терапии. Основной курс лечения включал 12 сеансов продолжительностью 30 мин 1 раз в неделю. Субъективный положительный эффект отметили 71% больных. Объективное подтверждение действенности этой методики в виде снижения суммарного балла по шкале NIH-CPSI в среднем с 25,2 до 11,8 получено у 57% пациентов. Также у этих больных было отмечено изменение уродинамических показателей в виде увеличения цистометрической емкости мочевого пузыря, увеличения объема жидкости, вызвавшего первое ощущение наполнения мочевого пузыря и первого позыва на мочеиспускание, снижения максимального детрузорного давления, увеличения среднего показателя максимальной и средней скорости мочеиспускания. Трое больных избавились от симптомов обструктивного типа мочеиспускания, а пятеро пациентов — от ранее имевшихся признаков дисфункционального мочеиспускания. Мы не выявили принципиального различия в эффективности тибиальной нейромодуляции у больных разными видами СХТБ, что косвенно может служить подтверждением единой природы заболевания.
Хирургическое лечение СХТБ применяется крайне редко, однако в ряде случаев, при наличии инфравезикальной обструкции, возможны различные трансуретральные вмешательства. S. A. Kaplan и соавт. (S. A. Kaplan, 1994) представили ретроспективный анализ лечения 34 больных с клиническим диагнозом СХТБ, у которых терапия α1-адреноблокаторами оказалась безуспешной. При видеоуродинамическом исследовании выявлен обструктивный процесс с локализацией в области шейки мочевого пузыря у 31 из 34 больных. Этим пациентам была произведена ограниченная эндоскопическая трансуретральная инцизия предстательной железы на 5 часах, что привело к значительному уменьшению симптоматики в 30 случаях. При последующем наблюдении за данной группой больных в течение двух лет отмечено сохранение положительного клинического результата.
Таким образом, СХТБ в настоящее время остается распространенным, недостаточно изученным и трудно поддающимся лечению заболеванием. Адекватное лечение возможно лишь в случае адекватной диагностики. Отсутствие четко определяемых этиологических факторов развития этого состояния и противоречивые данные в отношении диагностических критериев снижают возможность четкой постановки диагноза. Отсутствует единый подход к выбору оптимальных методов лечения. Оценка огромного числа методов лечения этого заболевания затруднена из-за отсутствия стандартизированной системы оценки результатов лечения. Эти обстоятельства, наряду с упорным течением заболевания, приводят к развитию неврозов. Таким образом, очевидно не только медицинское, но и социальное значение проблемы повышения эффективности диагностики и лечения СХТБ.
Е. Б. Мазо, доктор медицинских наук, профессор, член-корреспондент РАМН
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
М. А. Горчханов
РГМУ, Москва