Гиперинсулинизм у детей что это
Гиперинсулинизм
Гиперинсулинизм — клинический синдром, характеризующийся повышением уровня инсулина и снижением сахара в крови. Гипогликемия приводит к слабости, головокружению, повышению аппетита, тремору, психомоторному возбуждению. При отсутствии своевременного лечения развивается гипогликемическая кома. Диагностика причин состояния основывается на особенностях клинической картины, данных функциональных проб, динамическом исследовании глюкозы, ультразвуковом или томографическом сканировании поджелудочной железы. Лечение панкреатических новообразований – хирургическое. При внепанкреатическом варианте синдрома проводят терапию основного заболевания, назначают специальную диету.
Общие сведения
Причины гиперинсулинизма
Врожденная патология возникает вследствие внутриутробных аномалий развития, задержки роста плода, мутаций в геноме. Причины возникновения приобретенной гипогликемической болезни разделяют на панкреатические, приводящие к развитию абсолютной гиперинсулинемии, и непанкреатические, вызывающие относительное повышение уровня инсулина. Панкреатическая форма болезни встречается при злокачественных или доброкачественных новообразованиях, а также гиперплазии бета-клеток поджелудочной железы. Непанкреатическая форма развивается при следующих состояниях:
Патогенез
Глюкоза является главным питательным субстратом центральной нервной системы и необходима для нормального функционирования головного мозга. Повышенный уровень инсулина, накопление гликогена в печени и торможение гликогенолиза приводит к снижению уровня глюкозы в крови. Гипогликемия вызывает торможение метаболических и энергетических процессов в клетках головного мозга. Происходит стимуляция симпатоадреналовой системы, увеличивается выработка катехоламинов, развивается приступ гиперинсулинизма (тахикардия, раздражительность, чувство страха). Нарушение окислительно-восстановительных процессов в организме приводит к снижению потребления кислорода клетками коры головного мозга и развитию гипоксии (сонливость, заторможенность, апатия). Дальнейший дефицит глюкозы вызывает нарушение всех обменных процессов в организме, увеличение притока крови к мозговым структурам и спазм периферических сосудов, что может привести к инфаркту. При вовлечении в патологический процесс древних структур мозга (продолговатый и средний мозг, варолиев мост) развиваются судорожные состояния, диплопия, а также нарушение дыхательной и сердечной деятельности.
Классификация
В клинической эндокринологии наиболее часто используется классификация гиперинсулинемии в зависимости от причин возникновения заболевания:
Симптомы гиперинсулинизма
Клиническая картина гипогликемической болезни обусловлена понижением уровня глюкозы в крови. Развитие приступа начинается с повышения аппетита, потливости, слабости, тахикардии и ощущения голода. Позже присоединяются панические состояния: чувство страха, тревога, раздражительность, дрожь в конечностях. При дальнейшем развитии приступа отмечается дезориентация в пространстве, диплопия, парестезии (онемение, покалывание) в конечностях, вплоть до возникновения судорог. При отсутствии лечения наступает потеря сознания и гипогликемическая кома. Межприступный период проявляется снижением памяти, эмоциональной лабильностью, апатией, нарушением чувствительности и онемением в конечностях. Частый прием пищи, богатой легкоусвояемыми углеводами, провоцирует увеличение массы тела и развитие ожирения.
В современной практике выделяют 3 степени гиперинсулинизма в зависимости от тяжести течения болезни: легкую, среднюю и тяжелую. Легкая степень проявляется отсутствием симптоматики межприступного периода и органического поражения коры головного мозга. Обострения болезни проявляются реже 1 раза в месяц и быстро купируются медикаментозными препаратами или сладкой пищей. При средней степени тяжести приступы возникают чаще 1 раза в месяц, возможна потеря сознания и развитие коматозного состояния. Межприступный период характеризуется легкими нарушениями поведенческого характера (забывчивость, снижение мышления). Тяжелая степень развивается при необратимых изменениях коры головного мозга. При этом приступы случаются часто и заканчиваются потерей сознания. В межприступном периоде пациент дезориентирован, память резко снижена, отмечается тремор конечностей, характерна резкая смена настроения и повышенная раздражительность.
Осложнения гиперинсулинизма
Осложнения можно условно разделить на ранние и поздние. К ранним осложнениям, возникающим в ближайшие часы после приступа, относят инсульт, инфаркт миокарда вследствие резкого снижения метаболизма сердечной мышцы и головного мозга. В тяжелых ситуациях развивается гипогликемическая кома. Поздние осложнения проявляются спустя несколько месяцев или лет от начала болезни и характеризуются нарушением памяти и речи, паркинсонизмом, энцефалопатией. Отсутствие своевременного диагностики и лечения заболевания приводит к истощению эндокринной функции поджелудочной железы и развитию сахарного диабета, метаболического синдрома, ожирения. Врожденный гиперинсулинизм в 30% случаев приводит к хронической гипоксии головного мозга и снижению полноценного умственного развития ребенка.
Диагностика гиперинсулинизма
Диагностика основывается на клинической картине (потеря сознания, тремор, психомоторное возбуждение), данных анамнеза заболевания (время начала приступа, его связь с приемом пищи). Эндокринолог уточняет наличие сопутствующих и наследственных заболеваний (жировой гепатоз, сахарный диабет, синдром Иценко-Кушинга), после чего назначает лабораторные и инструментальные исследования. Пациенту проводится суточное измерение уровня глюкозы крови (гликемический профиль). При выявлении отклонений выполняют функциональные пробы. Проба с голоданием используется для дифференциальной диагностики первичного и вторичного гиперинсулинизма. Во время теста измеряют С-пептид, иммунореактивный инсулин (ИРИ) и глюкозу в крови. Повышение данных показателей свидетельствует об органическом характере болезни.
Для подтверждения панкреатической этиологии заболевания проводят тесты на чувствительность к толбутамиду и лейцину. При положительных результатах функциональных проб показано УЗИ, сцинтиграфия и МРТ поджелудочной железы. При вторичном гиперинсулинизме для исключения новообразований других органов выполняют УЗИ брюшной полости, МРТ головного мозга. Дифференциальная диагностика гипогликемической болезни проводится с синдромом Золлингера-Эллисона, началом развития сахарного диабета 2 типа, неврологическими (эпилепсия, новообразования головного мозга) и психическими (неврозоподобные состояния, психоз) заболеваниями.
Лечение гиперинсулинизма
Тактика лечения зависит от причины возникновения гиперинсулинемии. При органическом генезе показано хирургическое лечение: частичная резекция поджелудочной железы или тотальная панкреатэктомия, энуклеация новообразования. Объем оперативного вмешательства определяется местоположением и размерами опухоли. После операции обычно отмечается транзиторная гипергликемия, требующая медикаментозной коррекции и диеты с пониженным содержанием углеводов. Нормализация показателей наступает через месяц после вмешательства. При неоперабельных опухолях проводят паллиативную терапию, направленную на профилактику гипогликемии. При злокачественных новообразованиях дополнительно показана химиотерапия.
Функциональный гиперинсулинизм в первую очередь требует лечения основного заболевания, вызвавшего повышенную продукцию инсулина. Всем больным назначается сбалансированная диета с умеренным снижением потребления углеводов (100-150 гр. в сутки). Отдается предпочтение сложным углеводам (ржаные хлебцы, макароны из твердых сортов пшеницы, цельнозерновые крупы, орехи). Питание должно быть дробным, 5-6 раз в день. В связи с тем, что периодические приступы вызывают у пациентов развитие панических состояний, рекомендована консультация психолога. При развитии гипогликемического приступа показано употребление легкоусвояемых углеводов (сладкий чай, конфета, белый хлеб). При отсутствии сознания необходимо внутривенное введение 40 % раствора глюкозы. При судорогах и выраженном психомоторном возбуждении показаны инъекции транквилизаторов и седативных препаратов. Лечение тяжелых приступов гиперинсулинизма с развитием комы осуществляют в условиях реанимационного отделения с проведением дезинтоксикационной инфузионной терапии, введением глюкокортикоидов и адреналина.
Прогноз и профилактика
Профилактика гипогликемической болезни включает в себя сбалансированное питание с интервалом в 2-3 часа, употребление достаточного количества питьевой воды, отказ от вредных привычек, а также контроль уровня глюкозы. Для поддержания и улучшения обменных процессов в организме рекомендованы умеренные физические нагрузки с соблюдением режима питания. Прогноз при гиперинсулинизме зависит от стадии заболевания и причин, вызывавших инсулинемию. Удаление доброкачественных новообразований в 90% случаев обеспечивают выздоровление. Неоперабельные и злокачественные опухоли вызывают необратимые неврологические изменения и требуют постоянного контроля за состоянием пациента. Лечение основного заболевания при функциональном характере гиперинсулинемии приводит к регрессии симптомов и последующему выздоровлению.
ГИПЕРИНСУЛИНИЗМ
ГИПЕРИНСУЛИНИЗМ (греч, hyper- + инсулин) — клинический синдром, проявляющийся симптомами гипогликемии различной степени выраженности, обусловленный усиленной секрецией инсулина. При повышенной резистентности к инсулину Г. может протекать без клин, проявлений гипогликемии (см.).
Содержание
Этиология
Г. наблюдается при инсулинпродуцирующих опухолях, исходящих из бета-клеток панкреатических островков Лангерганса (см. Инсулома), спонтанной идиопатической гипогликемии у детей, в начальных стадиях сахарного диабета (в т. ч. при функциональных реактивных гипогликемиях), при ожирении, демпинг-синдроме, при ряде эндокринных заболеваний (акромегалия, тиреотоксикоз, болезнь Иценко — Кушинга) либо может возникнуть под действием различных алиментарных раздражителей.
Патогенез
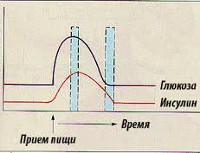
Г. при функциональной реактивной гипогликемии нейрогенного происхождения возникает вследствие чрезмерной реакции бета-клеток панкреатических островков на нормальную углеводную нагрузку и развивается через 1,5 — 4 часа после приема пищи; увеличение содержания в крови иммунореактивного инсулина (гиперинсулинемия) наблюдается через 0,5—1 час, т. е. в те же сроки, что и у здоровых, но абсолютная величина его значительно больше, чем у здоровых. При пробе с нагрузкой глюкозой: уровень сахара в крови увеличивается в пределах нормальных величин,, но через 11/2—4 часа развивается гипогликемия с последующим самостоятельным восстановлением нормального содержания сахара в крови.
Г. при начальных стадиях сахарного диабета (см. Диабет сахарный) связан с усилением секреций инсулина при нагрузках углеводами. При проведении этим больным пробы на толерантность к глюкозе отмечают поздний максимальный подъем иммунореактивного инсулина и последующую более длительную инсулинемию на более высоком по сравнению со здоровыми уровне. Содержание сахара в крови натощак нормально или несколько повышено, но после приема глюкозы остается повышенным в течение 2—2,5 час., а к третьему часу уменьшается до гипогликемического уровня.
При демпинг-синдроме у больных, перенесших резекцию желудка, развитие Г. связано с быстрым всасыванием глюкозы при поступлении ее в кишечник и в кровь. Адекватно этому повышается секреция инсулина, и через 1—2 часа после еды наступает гипогликемия.
Патогенез
Патогенез Г. при повышенной идиопатической чувствительности к лейцину, чаще наблюдающийся у детей, не ясен. Считают, что в ответ на прием лейцина (с пищей) начинает чрезмерно выделяться инсулин. Г. при спонтанной идиопатической гипогликемии у детей чаще связан с гипертрофией и гиперплазией бета-клеток панкреатических островков, что чаще сопутствует наследственным формам сахарного диабета.
Клиническая картина
Клиническая картина характеризуется гипогликемическими состояниями, проявляющимися слабостью, повышенным аппетитом и потливостью, тахикардией, раздражительностью, в тяжелых случаях — появлением судорог, диплопией, психическими нарушениями (неадекватное поведение, неправильная оценка окружающей обстановки и т. д.), потерей сознания.
Однако при формах Г., не связанных с инсулиномой, гипогликемические состояния не бывают тяжелыми и сопровождаются симптомами повышенной активности симпатической нервной системы.
Диагноз
При подозрении на Г. необходимо исследовать кровь на содержание сахара. Обязательны повторные исследования натощак, а также в период приступа гипогликемии. Функциональные реактивные гипогликемии развиваются преимущественно днем, после приема пищи с большим содержанием углеводов. Содержание сахара в крови редко снижается ниже 50 мг%, больные, как правило, не теряют сознания. Содержание иммунореактив-ного инсулина в крови натощак часто повышено.
Важное значение в диагностике Г. имеет проведение функциональной пробы с голоданием в течение 18— 24 час., считая от последнего вечернего приема пищи, и проба с назначением низкокалорийной диеты, богатой белками, но с резким ограничением углеводов и жиров, в течение 72 час. При проведении такой пробы больной получает 200 г мяса, 200 г творога, 30 г масла, 50 г хлеба, 500 г овощей (кроме картофеля и бобовых). Ежедневно исследуют кровь на содержание сахара натощак и в течение дня. У больных с Г. обычно содержание сахара в крови уменьшается до 50 мг% и ниже.
Пробы на толерантность к глюкозе и инсулину у больных Г. могут дать различные результаты, поэтому они не имеют диагностической ценности.
Проводят пробы на чувствительность к толбутамиду и лейцину. После внутривенного введения 1 г толбутамида или лейцина (200 мг на 1 кг веса тела, можно per os) в крови больных Г. обнаруживают увеличение иммунореактивного инсулина и уменьшение сахара.
Лечение
Лечение должно быть направлено на устранение и предупреждение гипогликемии. Рекомендуется частое питание с полноценным содержанием белка в пище и равномерным распределением углеводов в течение дня.
При Г., связанном с повышенной чувствительностью к лейцину, следует ограничивать потребление продуктов, содержащих лейцин (молочные продукты). Больным со спонтанными гипогликемиями рекомендуют частый прием пищи, а в тяжелых случаях назначают препараты глюкокортикоидов, иногда АКТГ, глюкагона, адреналина.
При доброкачественных опухолях поджелудочной железы больным производят неполную резекцию железы, при злокачественных опухолях — расширенную панкреатэктомию (см.).
Гиперинсулинизм у детей
Гиперинсулинизм у детей, как и у взрослых, проявляется гипогликемическими состояниями различной степени выраженности. Однако гипогликемические состояния у детей появляются при более низком содержании глюкозы в крови, чем у взрослых. При частых повторных гипогликемических состояниях у детей быстрее, чем у взрослых, нарушается психика (истинные нарушения вследствие тяжелых гипогликемий с необратимым течением и ложные, которые проходят под влиянием лечения).
Механизм развития функционального Г. у детей, рожденных женщинами, больными сахарным диабетом, не ясен. Полагают, что Г. плода является компенсаторной реакцией на гипергликемию матери; у 60—80% детей, рожденных женщинами, больными сахарным диабетом, обнаруживают Г. У таких детей отмечают гиперплазию клеток поджелудочной железы. После рождения уровень глюкозы быстро снижается, и через 1—2 часа у новорожденного может наблюдаться гипогликемическое состояние. Низкий уровень глюкозы и свободных жирных к-т в крови— следствие тормозящего действия инсулина на липолиз. У этих детей наблюдается избыточный вес, что связано с анаболическим действием инсулина. У женщин с сахарным диабетом, выявленным в период беременности, инсулиновая активность сыворотки крови повышена, у новорожденных от матерей, больных сахарным диабетом, инсулиновая реакция на введение глюкозы более выражена, чем у детей, рожденных здоровыми женщинами.
Патогномоничные симптомы Г. у новорожденных отсутствуют. Судороги, цианоз, остановка дыхания и состояние летаргии могут наблюдаться у детей при наличии внутричерепной травмы, сепсиса, легочносердечных заболеваний, гипокальциемии и других метаболических нарушений. Диагноз Г. устанавливают по содержанию в крови сахара (20 мг% и менее у ребенка с нормальным весом при рождении).
Г., возникающий под действием алиментарных раздражителей, необходимо дифференцировать с врожденной непереносимостью к фруктозе, при к-рой гипогликемия не связана с Г. Это редкое заболевание характерно для детского возраста и проявляется развитием тяжелых гипогликемических состояний и рвоты после приема продуктов, содержащих фруктозу. Оно обусловлено врожденной недостаточностью фруктозо-1-фосфат-альдолазы, приводящей к накоплению фруктозо-1-фос-фата в печени. Исключение из питания продуктов, содержащих фруктозу, устраняет гипогликемию. У детей с тяжелой формой эритробластоза также может развиться функциональный Г.; причина его не ясна. Г. развивается у детей, больных конституционально-экзогенным ожирением. Коэффициент инсулиносекреции у этих больных увеличен. Исследование иммунореактивного инсулина может до нек-рой степени характеризовать функциональное состояние инсулярного аппарата больного ребенка: чем более выражено ожирение, тем выше содержание иммунореактивного инсулина в крови.
У тучных детей, больных диабетом, на ранних стадиях его развития содержание инсулина в крови натощак выше, чем у здоровых детей и у детей с ожирением без диабета, иногда более чем в 3 раза.
Коэффициент инсулиносекреции у этих больных снижен по сравнению со здоровыми, что говорит об относительном Г.
Лечение Г. у детей зависит от его формы. При доброкачественных опухолях поджелудочной железы проводится неполная резекция, а при злокачественных — расширенная панкреатэктомия. При врожденной непереносимости к фруктозе — исключение из пищи продуктов, содержащих ее. При Г. у детей, связанных с другими заболеваниями,— лечение основного заболевания.
Библиография: Николаев О. В. и Вейнбeрг Э. Г. Инсулома, М., 1968, библиогр.; Руководство по эндокринологии, под ред. Б. В. Алешина и др., М., 1973; Hardy J. D. Islet cell tumors, Amer. J. med. Sci., v. 246, p. 218, 1963; Howard J. М., Moss N. H. a. Rhoads J. E. Collective review, hyperinsulinism and islet cell tumors of pancreas with 398 recorded tumors, Int. Abstr. Surg., v. 90, p. 417, 1950; Koutras P. a. White R. R. Insulin-secreting tumors of the pancreas, Surg. Clin. N. Amer., v. 52, p. 299, 1972; Labhart A. Klinik der inneren Sekretion, B. u. a., 1971; RosenbloomA. L. a. Sherman L. The natural history of idiopathic hypoglycemia of infancy and its relation to diabetes mellitus, New Engl. J. Med., v. 274, p. 815, 1966; Textbook of endocrinology, ed. by R. H. Williams, Philadelphia, 1974.
Гипогликемическое состояние у детей
Редкий случай органического гиперинсулинизма у ребенка 3 месяцев Уровень глюкозы в крови натощак у практически здорового человека колеблется от 3,3 до 5,5 ммоль/л при определении глюкозооксидазным методом.
Редкий случай органического гиперинсулинизма у ребенка 3 месяцев
Уровень глюкозы в крови натощак у практически здорового человека колеблется от 3,3 до 5,5 ммоль/л при определении глюкозооксидазным методом. На протяжении суток глюкоза в плазме крови в норме может колебаться от 2,8 до 8,8 ммоль/л. Содержание глюкозы в крови ниже 2,7 ммоль/л принято называть гипогликемией.
Основная причина гипогликемического симптомокомплекса — гиперинсулинизм.
Гиперинсулинизм — патологическое состояние организма, обусловленное абсолютным или относительным избытком инсулина, вызывающим значительное снижение содержания сахара в крови; как следствие возникают дефицит глюкозы и кислородное голодание мозга, что ведет к нарушению в первую очередь высшей нервной деятельности.
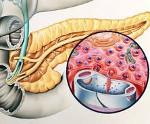
Абсолютный гиперинсулинизм — это состояние, связанное с патологией инсулярного аппарата (первичный органический гиперинсулинизм). Наиболее частыми причинами органического гиперинсулинизма являются инсулинома — опухоль b-клеток островков Лангерганса, секретирующая избыточное количество инсулина (у взрослых и детей старшего возраста) и незидиобластоз — гиперплазия островков поджелудочной железы (у детей первого года жизни). Еще одна нередкая причина гиперинсулинизма у детей младшего возраста — функциональный гиперинсулинизм новорожденных от матерей с сахарным диабетом.
Доброкачественную аденому островков Лангерганса впервые обнаружил в 1902 году во время вскрытия Николлс. В 1904 году Л. В. Соболев описал «струму островков Лангерганса». В 1924 году Гаррис и отечественный хирург В. А. Оппель независимо друг от друга описали симптомокомплекс гиперинсулинизма. В этом же году Г. Ф. Ланг наблюдал множественный аденоматоз панкреатических островков. В России успешная операция удаления инсулиномы была выполнена в 1949 году А. Д. Очкиным, а в 1950 году — О. В. Николаевым. Инсулин-секретирующая опухоль описана во всех возрастных группах, от новорожденных до престарелых, однако чаще она поражает людей трудоспособного возраста — от 30 до 55 лет. Среди общего числа больных дети составляют всего около 5%. 90% инсулином — доброкачественные. Около 80% из них — солитарные. В 10% случаев гипогликемия обусловлена множественными опухолями, 5% из них — злокачественные, а 5% составляет незидиобластоз (Антонов А. В. Клиническая эндокринология, 1991).
Термин незидиобластоз введен Г. Лейдло в 1938 году. Незидиобластоз — это тотальная трансформация протокового эпителия поджелудочной железы в b-клетки, продуцирующие инсулин. У детей первого года жизни это наиболее частая причина органического гиперинсулинизма (лишь 30% гиперинсулинизма у детей обусловлено инсулиномой, 70% — незидиобластозом). Это генетически обусловленное заболевание.
Диагноз устанавливается только морфологически после исключения инсулиномы. Клинически он проявляется тяжелыми, трудно поддающимися коррекции гипогликемиями, вследствие чего при отсутствии положительного эффекта от консервативного лечения придется прибегать к уменьшению массы ткани поджелудочной железы. Общепринятый объем операции — 80 — 95% резекции железы.
Инсулиномы у детей встречаются исключительно редко и располагаются либо в хвосте, либо в теле поджелудочной железы. Их диаметр колеблется от 0,5 до 3 см. Малые размеры инсулином создают сложности для диагностики (информативность УЗИ-метода — не более 30%). Для определения локализации инсулиномы применяют селективную ангиографию, КТ и МРТ или сканирование с изотопом октреотида (аналог соматостатина). Наиболее информативной является ангиография с селективным забором крови из вен поджелудочной железы (60 — 90%).
Инсулинома проявляется более или менее резким падением уровня сахара крови, что обусловлено повышенной секрецией инсулина в кровь. Радикальным методом лечения инсулиномы является хирургический (инсулиномэктомия ), прогноз в большинстве случаев благоприятный (88 — 90%) при своевременном оперативном вмешательстве.
Органический гиперинсулинизм (инсулинома, незидиобластоз) является причиной тяжелых панкреатических гипогликемий с падением сахара крови до 1,67 ммоль/л и ниже (во время приступа). Эти гипогликемии всегда некетотические (ацетон в моче отрицательный за счет подавления процессов липолиза).
Наиболее часто в клинической практике встречаются кетотические гипогликемии (с ацетонурией). Кетотические гипогликемии являются внепанкреатическими и могут быть эндокринно- и неэндокриннозависимыми. Они сопровождаются относительным гиперинсулинизмом, то есть не связанным с патологией инсулярного аппарата поджелудочной железы (вторичный, функциональный, симптоматический гиперинсулинизм). Относительный гиперинсулинизм обусловлен повышением чувствительности организма к нормально выделяемому b-клетками панкреатических островков инсулину или нарушением компенсаторных механизмов, участвующих в регуляции углеводного обмена и в инактивации инсулина.
Эндокриннозависимые кетотические гипогликемии (без повышения уровня инсулина в крови) выявляются при недостаточности контринсулиновых гормонов у больных с гипофункцией передней доли гипофиза (церебрально-гипофизарный нанизм, изолированный дефицит СТГ, гипопитуитаризм), щитовидной железы (гипотиреоз), коры надпочечников (болезнь Аддисона).
Без повышения уровня инсулина могут протекать внепанкреатические гипогликемии, встречающиеся при экстрапанкреатических опухолях (грудной клетки, брюшной полости, ретроперитонеальные и т. д.), гипогликемии, сопровождающие диффузные заболевания печени, хроническую почечную недостаточность. У детей первого года жизни причиной кетотических неэндокринозависимых гипогликемий (без гиперинсулинизма) являются врожденные энзимопатии (гликогенозы).
В клинической практике часто встречаются реактивные гипогликемии — функциональный гиперинсулинизм при вегетососудистой дистонии. Они наблюдаются у лиц с ожирением, у детей-невротиков дошкольного возраста на фоне ацетонемических рвот из-за нарушения процессов глюконеогенеза и т. д.
Нередки также гипогликемии экзогенной природы (вызванные введением инсулина, сахароснижающих средств, салицилатов, сульфаниламидов и других лекарственных средств).
При функциональном гиперинсулинизме гипогликемии клинически менее выражены, содержание сахара крови не падает ниже 2,2 ммоль/л.
Обнаружить гипогликемию можно по клиническим признакам, чаще же сниженный уровень сахара в крови является лабораторной находкой. Достоверным считается выявление гипогликемии в ранние утренние часы или натощак перед завтраком в капиллярной крови не менее 2 — 3 раз (при отсутствии четких клинических данных). Показанием для обследования в стационаре является классическая клиника гиперинсулинизма или трижды подтвержденная утренняя гипогликемия (без клинических проявлений) ниже возрастных показателей (снижение гликемии натощак для новорожденных — менее 1,67 ммоль/л, 2 месяца — 18 лет — менее 2,2 ммоль/л, старше 18 лет — менее 2,7 ммоль/л).
Для гипогликемической болезни патогномоничной является триада Уиппла:
Большинство симптомов гипогликемии обусловлено недостаточным снабжением центральной нервной системы глюкозой. При снижении уровня глюкозы до гипогликемии включаются механизмы, направленные на гликогенолиз, глюконеогенез, мобилизацию свободных жирных кислот, кетогенез. В этих процессах участвуют в основном 4 гормона: норадреналин, глюкагон, кортизол, гормон роста. Первая группа симптомов связана с повышением в крови содержания катехоламинов, что вызывает слабость, тремор, тахикардию, потливость, беспокойство, чувство голода, побледнение кожных покровов. Симптомы со стороны ЦНС (симптомы нейрогликопении) включают головную боль, двоение в глазах, нарушение поведения (психическое возбуждение, агрессивность, негативизм), в дальнейшем наступает потеря сознания, появляются судороги, может развиться кома с гипорефлексией, поверхностным дыханием, мышечной атонией. Глубокая кома ведет к смерти или необратимым повреждениям ЦНС. Частые приступы гипогликемии приводят к изменению личности у взрослых, снижению интеллекта у детей. Отличие симптомов гипогликемии от настоящих неврологических состояний — положительный эффект приема пищи, обилие симптомов, не укладывающихся в клинику.
Наличие выраженных нервно-психических нарушений и недостаточная осведомленность врачей о гипогликемических состояниях часто приводят к тому, что вследствие диагностических ошибок больные с органическим гиперинсулинизмом длительно и безуспешно лечатся под самыми разными диагнозами. Ошибочные диагнозы ставятся у 3/4 больных с инсулиномой (эпилепсия диагностируется в 34% случаев, опухоль головного мозга — в 15%, вегетососудистая дистония — в 11%, диэнцефальный синдром — в 9%, психозы, неврастения — 3% (Dizon A. М., 1999).
Период острой гипогликемии — это результат срыва контринсулярных факторов и адаптационных свойств ЦНС.
Чаще всего приступ развивается в ранние утренние часы, что связано с продолжительным ночным перерывом в приеме пищи. Обычно больные не могут «проснуться» из-за различного рода расстройств сознания. Может быть вялость, апатия по утрам. Наблюдаемые у этих больных эпилептиформные припадки отличаются от истинных большей продолжительностью, хориоформными судорожными подергиваниями, гиперкинезами, обильной нейровегетативной симптоматикой. Распознавание заболевания требует тщательного изучения анамнеза и внимательного наблюдения за больными. Это особенно важно для диагностики органического гиперинсулинизма как причины гипогликемии у детей.
У детей первого года жизни клинически выявить гипогликемию сложно, так как симптомы нечетки и нетипичны. Это может быть цианоз, бледность кожных покровов, снижение мышечного тонуса, остановка дыхания (апноэ), тремор, судороги, «закатывание» глазных яблок (нистагм), беспокойство. При врожденной форме (незидиобластоз) наблюдается большая масса тела (крупный плод), отечность, круглое лицо.
У детей дошкольного и школьного возраста с органическим гиперинсулинизмом чаще регистрируется доброкачественная инсулинома. Для этих детей характерны утренняя неработоспособность, трудности утреннего пробуждения, нарушение концентрации внимания, выраженные чувство голода, тяга к сладкому, негативизм, сердцебиения. Гиперинсулинизм приводит к повышению аппетита и ожирению. Чем моложе ребенок, тем больше выражена склонность к низкому сахару крови в ответ на более продолжительные перерывы между приемами пищи.
Среди лабораторных показателей при подозрении на органический гиперинсулинизм (инсулиному или незидиобластоз) особое место занимает исследование иммунореактивного инсулина (ИРИ). Но, как показала практика, далеко не всегда при доказанной инсулиноме имеются повышенные его значения. ИРИ принято оценивать одновременно с уровнем гликемии. Важным является индекс отношения инсулина к глюкозе — ИРИ мкед/мл/глюкоза венозная ммоль/л. У здоровых людей и на фоне гипогликемии без гиперинсулинизма этот индекс составляет менее 5,4.
Среди функциональных проб, используемых для диагностики органического гиперинсулинизма, наиболее распространена проба с голоданием.
Проба основана на развитии гипогликемии у людей с гиперфункцией инсулярного аппарата поджелудочной железы при прекращении поступления углеводов с пищей. Во время проведения пробы больному разрешается пить только воду или чай без сахара. Чем младше ребенок и чем чаще приступы гипогликемии, тем проба короче.
Длительность пробы:
дети до 3 лет — 8 ч;
2 — 10 лет — 12-16 ч;
10 — 18 лет — 20 ч;
старше 18 лет — 72 ч.
(рекомендации кафедры детской эндокринологии РМАПО, Москва).
У детей 2 лет и старше последний прием пищи должен быть накануне вечером; детям до 2 лет пробу начинают в ранние утренние часы.
У здорового человека ночное, а также более продолжительное по времени голодание умеренно снижает уровень гликемии и, что характерно, уменьшает содержание инсулина в крови. При наличии опухоли, постоянно продуцирующей избыточное количество инсулина, в условиях голодания создаются предпосылки для развития гипогликемии, поскольку поступления глюкозы из кишечника нет, а печеночный гликогенолиз блокирован опухолевым инсулином.
Перед началом пробы определяют содержание глюкозы в плазме крови. Далее гликемия в капиллярной крови (глюкометром) исследуется у детей до 2 лет 1 раз в час, у детей в возрасте 2 лет и старше — 1 раз в 2 часа. При снижении сахара в крови до 3,3 ммоль/л и меньше интервалы исследования сокращаются в 2 — 3 раза. Порог допустимой гликемии, при котором голодание прекращают и проводят исследования, — 1,7 ммоль/л у ребенка до 2 лет, 2,2 ммоль/л у детей старше 2 лет. После регистрации глюкометром пороговой гипогликемии исследуется сыворотка крови на содержание ИРИ и контринсулиновых гормонов, глюкоза крови исследуется биохимическим методом (поскольку после снижения уровня глюкозы до 3,3 ммоль/л и ниже глюкометр дает неточный результат), исследуется уровень липидов крови.
Купируется приступ гипогликемии введением в/в струйно 40% глюкозы; сразу после введения глюкозы и через 3 часа после окончания пробы исследуется моча на содержание кетоновых тел.
Интерпретация результатов пробы
В случае подтверждения гиперинсулинизма как причины гипогликемии необходимо дообследование и лечение в специализированном эндокринологическом отделении.
Во всех случаях инсулином показано хирургическое лечение. При незидиобластозе терапия может быть консервативной и радикальной. Наибольшее признание в настоящее время получил препарат диазоксид (прогликем, зароксолин). Гипергликемизирующий эффект этого недиуретического бензотиазида основан на торможении секреции инсулина из опухолевых клеток. Рекомендуемая доза для детей — 10 — 12 мг на кг массы тела в сутки в 2 — 3 приема. При отсутствии выраженной положительной динамики показано оперативное лечение — субтотальная или тотальная резекция поджелудочной железы (с возможным переходом в сахарный диабет).
С. А. Столярова, Т. Н. Дубовая, Р. Г. Гарипов
С. А. Мальмберг, доктор медицинских наук
В. И. Широкова, кандидат медицинских наук
ДКБ №38 ФУ «Медбиоэкстрем» при МЗ РФ, Москва
Больной Захар З., 3 мес., поступил в отделение психоневрологии ДКБ № 38 ФУ «Медбиоэкстрем» Москвы 01.11.02 с направляющим диагнозом эпилепсия.
Ребенок с умеренно отягощенным перинатальным анамнезом. Беременность у матери первая, протекала с токсикозом в первой половине, анемией. Роды на 40-й неделе, крупный плод (вес при рождении 4050 г, длина 54 см). Оценка по шкале Апгар — 8/9 баллов. С периода новорожденности до 2 мес. периодически отмечался тремор подбородка, с 2-месячного возраста появились приступообразные состояния в виде остановки взора, снижения двигательной активности, подергивания правой половины лица, правой руки (приступы фокальных судорог) — по несколько секунд 3 — 4 раза в сутки. Лечился амбулаторно у невропатолога, получал противосудорожную терапию без выраженного положительного эффекта. Накануне госпитализации появились хореиформные подергивания в утренние часы на фоне нарушенного сознания. Госпитализирован в отделение психоневрологии с направляющим диагнозом эпилепсия.
При поступлении состояние ребенка средней тяжести. В соматическом статусе — кожные покровы с проявлениями атопического дерматита, зев чистый, в легких хрипов нет, тоны сердца звучные, тахикардия до 140 — 160 уд. в мин. Живот мягкий, печень +2 см, селезенка +1 см. Мочеиспускание не нарушено. В неврологическом статусе — вялый, взгляд фиксирует, голову удерживает плохо. ЧН — интактны, мышечный тонус снижен, больше в руках, симметричный. Сухожильные рефлексы невысокие, Д=С, безусловные рефлексы н/р — по возрасту. Вес — 7 кг, рост — 61 см (отмечается избыток веса на фоне средневозрастного показателя роста).
В стационаре при исследовании биохимического анализа крови натощак впервые выявлено снижение сахара в крови до 1,6 ммоль/л при отсутствии кетоновых тел в моче.
Результаты лабораторного и инструментального обследования:
Динамический контроль уровня глюкозы позволил выявить стойкую гипогликемию в капиллярной и венозной крови. Натощак и через 2 часа после кормления грудным молоком в течение суток гликемия колебалась от 0,96 до 3,2 ммоль/л. Клинически гипогликемия проявлялась повышенным аппетитом, вялостью, тахикардией, эпизодами «закатывания» правого глазного яблока, генерализованными эпилептиформными судорогами. В межприступный период самочувствие удовлетворительное. Гипогликемические состояния купировались приемом глюкозы внутрь, а также внутривенным введением 10%-ной глюкозы.
С диагностической целью для подтверждения гиперинсулинизма ребенку проведена проба с голоданием: последнее ночное кормление в 6 часов утра, перед кормлением гликемия — 2,8 ммоль/л, через 3,5 часа после кормления глюкометром отмечено снижение уровня гликемии до 1,5 ммоль/л (ниже допустимого порогового значения). На фоне гипогликемии взята сыворотка крови для гормонального исследования (ИРИ, с-пептид. кортизол, СТГ). Сделан забор венозной крови для биохимического исследования уровня глюкозы и липидов. После купирования гипогликемии в/в струйным введением глюкозы собрана трехчасовая порция мочи на содержание кетоновых тел.
Результаты пробы: ацетонурии нет. Уровень контринсулиновых гормонов не снижен (кортизол — 363,6 при норме 171 — 536 нмоль/л, СТГ — 2,2 при норме 2,6 — 24,9 мкЕ/мл). С-пептид — 0,53 при норме — 0,36 — 1,7 пмоль/л. ИРИ — 19,64 при норме — 2,6 — 24,9 ммкЕ/мл. Глюкоза венозная — 0,96 ммоль/л. Уровень липидов крови на нижней границе нормы (триглицериды — 0,4 ммоль/л, холестерин общ. — 2,91 ммоль/л, холестерин липопр. выс. плотн. — 1,06 ммоль/л, холест. липопр. низк. плотн. — 1,67 ммоль/л. Индекс ИРИ/глюкоза (19,64 /0,96) составил 20,45 при норме менее 5,4.
Данные анамнеза, динамического наблюдения, клинико-лабораторного обследования позволили поставить диагноз: некетотическая гипогликемия. Гиперинсулинизм. Незидиобластоз?
Для уточнения генеза заболевания и тактики лечения ребенок переведен в эндокринологическое отделение РДКБ Москвы, где инсулинома у мальчика исключена. Подтвержден диагноз незидиобластоз. Назначено пробное консервативное лечение прогликемом в дозе 10 мг на кг массы тела. Отмечена тенденция к нормализации показателей углеводного обмена. Планируется дальнейшее динамическое наблюдение для коррекции тактики лечения.
Рассмотренный клинический случай диктует необходимость исследования показателей углеводного обмена у всех детей раннего возраста с судорожным синдромом, ввиду стертости клинических симптомов гипогликемии у детей грудного и раннего детского возраста, для исключения диагностических ошибок.