Гидразин солянокислый что это
Гидразин — токсичный, но широко востребованный реактив
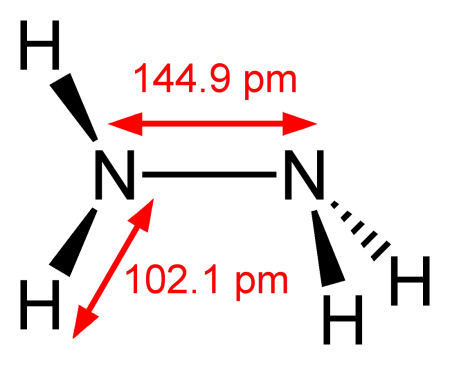
Гидразин — неорганическое вещество с формулой N2H4 (в текстовом виде: H2N—NH2). 
Диамид и его соединения пожароопасны, легко воспламеняются, горят с выделением большого количества высокотоксичных газов. Пламя имеет фиолетовый цвет.
Гидразин химически очень активен:
— Взаимодействует с неорганическими кислотами, образуя соли, например, гидразин-сульфат N2H6SO4 (в другой записи: NH2NH2 •H2SO4) при взаимодействии с серной кислотой; гидразин солянокислый N2H5Cl (N2H4•2HCl) — с соляной.
— Сильный восстановитель — вступает в реакции с окислителями (с перманганатом калия, кислородом, фтором, азотной кислотой, перекисью водорода и другими).
— Восстанавливает металлы из растворов солей.
— Разлагается при нагревании и в присутствии катализатора.
— В присутствии платины, родия или палладия разлагается на безопасные азот и водород.
— Образует органические производные.
— Реагирует с металлами, солями металлов, галогенами, оксидами.
Меры предосторожности, перевозка

Работать с гидразином и его соединениями допускается только в вытяжном шкафу, в помещении с мощной системой приточно-вытяжной вентиляции, с использованием индивидуальных средств защиты.
Перевозят и хранят гидразин в стальных канистрах и цистернах, герметично закрытых, с прокладками из фторопласта-4. Автомобильные и железнодорожные цистерны обязательно снабжаются предупреждающими знаками.
Это интересно
Гидразин и его соединения используются как топливо для мощных разгонных ракет — например, двигатели «Апполонов», летавших на Луну, работали на диметилгидразине и тетраоксиде азота. Гидразин в чистом виде применяется в качестве топлива для маломощных космических двигателей; для изменения орбиты; для поворота, скажем, космического телескопа. Для того, чтобы поджечь гидразин, достаточно ввести нагретый катализатор (окислитель не нужен), что существенно снижает вес аппарата.
Применение гидразина и его производных
— В химической индустрии: в органическом синтезе, в производстве пластиков, 
— В промышленности: в топливных элементах химических источников тока; добавляют в стекольную массу, для того, чтобы сделать стекла прозрачнее; при нанесении покрытий из металла на пластики и стекло.
— В фотографии — как проявитель.
— При извлечении плутония из ядерных отходов.
— Для восстановления чистых металлов (меди, никеля, золота, платиновых металлов, серебра) и их оксидов из растворов.
— Для удаления кислорода и продувки технологических установок; для замедления коррозии промышленных котлов и систем отопления; для очистки промышленных газов от углекислого газа и тиолов.
— В аналитической химии для идентификации некоторых веществ.
— Включают в состав инсектицидов, фунгицидов, ускорителей роста растений.
— Как основа многих взрывчатых смесей, а также самолетного и ракетного топлива высокой надежности.
— В медицине и фармакологии гидразин сернокислый применяют для лечения онкологических больных в поздней стадии, когда операция уже не показана. Применение сульфат-гидразина стабилизирует и улучшает состояние ослабленных больных за счет того, что он нормализует углеводный обмен клеток. Гидразин входит в состав лекарств от туберкулеза. Из производных реактива получают вещества, обладающие антимикробными, антигрибковыми, антивирусными, болеутоляющими, мочегонными, психотропными свойствами. Диамид применяется при проведении анализов крови.
В нашем магазине, наряду с другими хим. реактивами, продаются качественные производные гидразина: гидразин сернокислый и гидразин солянокислый. Есть доставка и скидка оптовым покупателям.
Гидразин
| Гидразин | |
|---|---|
 | |
 | |
 | |
| Систематическое наименование | Гидразин |
| Хим. формула | N2H4 |
| Состояние | бесцветная жидкость |
| Молярная масса | 32,05 г/моль |
| Плотность | 1,01 г/см³ |
| Энергия ионизации | 8,93 ± 0,01 эВ |
| Т. плав. | +2 °C |
| Т. кип. | 114 °C |
| Т. всп. | 99 ± 0 °F |
| Пр. взрв. | 2,9 ± 0,1 об.% |
| Давление пара | 10 ± 1 мм рт.ст. |
| pKa | 8,1 ± 0,01 |
| Растворимость в воде | смешивается |
| Рег. номер CAS | [302-01-2] |
| PubChem | 9321 |
| Рег. номер EINECS | 206-114-9 |
| SMILES | |
| RTECS | MU7175000 |
| ChEBI | 15571 |
| Номер ООН | 2029 |
| ChemSpider | 8960 |
| Пиктограммы СГС |     |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидразин (диамин) H2N—NH2 — бесцветная, чрезвычайно токсичная, сильно гигроскопическая жидкость, с неприятным запахом.
Молекула N2H4 состоит из двух групп NH2, повёрнутых друг относительно друга, что обусловливает полярность молекулы гидразина, μ = 0,62⋅10 −29 Кл · м. Смешивается в любых соотношениях с водой, жидким аммиаком, этанолом; в неполярных растворителях растворяется плохо. Образует органические производные: алкилгидразины и арилгидразины.
Был открыт в 1887 году Теодором Курциусом.
Содержание
Свойства
Термодинамически гидразин значительно менее устойчив, чем аммиак, так как связь N—N не очень прочна: разложение гидразина — экзотермическая реакция, протекающая в отсутствие катализаторов при 200—300 °C:
Переходные металлы (Co, Ni, Cu, Ag) катализируют разложение гидразина. При катализе платиной, родием и палладием основными продуктами разложения являются азот и водород:
(для аммиака Kb = 1,78⋅10 −5 )
Протонирование второй неподеленной пары электронов протекает ещё труднее:
Известны соли гидразина — хлорид гидразиния (Гидразин солянокислый) N2H5Cl, сульфат гидразиния (Гидразин сернокислый N2H6SO4 и т. д. Иногда их формулы записывают N2H4 · HCl, N2H4 · H2SO4 и т. д. и называют гидрохлорид гидразина, сульфат гидразина и т. д. Большинство таких солей растворимо в воде.
Соли гидразина бесцветны, почти все хорошо растворимы в воде. К числу важнейших относится сульфат гидразина N2H4 · H2SO4.
Гидразин как восстановитель
Гидразин — энергичный восстановитель. В растворах гидразин обычно также окисляется до азота:
Окисляется кислородом воздуха до азота, аммиака и воды. Известны многие органические производные гидразина. Гидразин, а также гидразин-гидрат, гидразин-сульфат, гидразин-хлорид, широко применяются в качестве восстановителей золота, серебра, платиновых металлов из разбавленных растворов их солей. Медь в аналогичных условиях восстанавливается до закиси.
В органическом синтезе гидразин применяется для восстановления карбонильной группы альдегидов и кетонов до метиленовой по Кижнеру — Вольфу (реакция Кижнера — Вольфа), реакция идёт через образование гидразонов, расщепляющихся затем под действием сильных оснований.
Обнаружение
Качественной реакцией на гидразин служит образование окрашенных гидразонов с некоторыми альдегидами, в частности — с p-диметиламинобензальдегидом.
Получение
Гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO (метод Рашига):
реакция проводится при температуре 160 °C и давлении 2,5—3,0 МПа.
Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману:
реакция проводится при температуре
100 °C и атмосферном давлении.
Применяется также метод Байера:
2NH3 + H2O2 ⟶ N2H4 + 2H2O
Применение
Гидразин применяют в органическом синтезе, в производстве пластмасс, резины, инсектицидов, взрывчатых веществ, в качестве компонента ракетного топлива, как восстановитель при выделении золота из растворов.
Гидразина сульфат применяется в случае таких заболеваний, как неоперабельные прогрессирующие распространённые формы, рецидивы и метастазы злокачественных опухолей — рак лёгкого (особенно немелкоклеточный), молочных желёз, желудка, поджелудочной железы, гортани, эндометрия, шейки матки, десмоидный рак, саркома мягких тканей, фибросаркома, нейробластома, лимфогранулематоз, лимфосаркома (монотерапия или в составе полихимиотерапии).
Гидразин также применяется в качестве топлива в гидразин-воздушных низкотемпературных топливных элементах.
Жидкая смесь гидразина и нитрата аммония используется как мощное взрывчатое средство с нулевым кислородным балансом — астролит, который, однако, в настоящее время практического значения не имеет.
Гидразин широко применяется в химической промышленности в качестве восстановителя кислорода, содержащегося в деминерализованной воде, применяемой для питания котлов (котельные установки, производства аммиака, слабой азотной кислоты и другое). При этом протекает следующая химическая реакция:
Ракетное топливо
Во время Второй мировой войны гидразин применялся в Германии в качестве одного из компонентов топлива для реактивных истребителей «Мессершмитт Ме-163» (C-Stoff, содержащий до 30 % гидрата гидразина).
Гидразин и его производные (метилгидразин, несимметричный диметилгидразин и их смеси (аэрозин)) широко распространены как ракетное горючее. Они могут быть использованы в паре с самыми разными окислителями, а некоторые и в качестве однокомпонентного топлива, в этом случае рабочим телом двигателя являются продукты разложения на катализаторе. Последнее удобно для маломощных двигателей.
Токсичность
Гидразин солянокислый
Синонимы: Гидразин гидрохлорид, гидразина хлоргидрат, гидразин дигидрохлорид
Международное название:Hydrazine hydrochloride, Hydrazinchlorhydrat
Внешний вид:бесцветные кристаллы
Условия хранения:в сухом проветриваемом помещении, от источников тепла и возгорания
Товар в наличии на складе
Наша компания обеспечит вас продукцией наилучшего качества. У нас вы сможете купить в Пензе химические реактивы и промышленную химию, а также другие химические материалы и химическую продукцию. Мы организуем оперативную доставку и ритмичные поставки по удобному для вас графику. Для постоянных клиентов у нас действует система скидок.
| Спецификация | |
|---|---|
| Молекулярный вес | 104,97 |
| Температура плавления | 198 °С |
| Массовая доля основного вещества, % не менее | 98,5 |
| Массовая доля нерастворимых веществ, % не более | 0,01 |
| Массовая доля сульфатов, % не более | 0,005 |
| Соляная кислота, % не более | 0,5 |
| Содержание тяжелых металлов,%, не более | 0,002 |
| Массовая доля железа, % не более | 0,001 |
| Остаток после прокаливания,%, не более | 0,05 |
Гидразин солянокислый, он же хлорид гидразиния, гидразина гидрохлорид — неорганическое вещество, соль гидразина и соляной кислоты. Его формула N2H4·2HCl.
Гидрохлорид гидразина — твердое вещество в виде игольчатых или октаэдрических кристаллов без цвета или мелкокристаллического белого порошка. В воде растворяется легко, медленно растворяется в спиртах. При нагревании разлагается с образованием и выделением токсичных веществ. Сильно ядовит.
Применение
Гидразин солянокислый используется
• как восстанавливающий агент в органической химии
• для производства пестицидов,
• при производства дезинфицирующих средств и др.
Гидразин солянокислый (гидразин гидрохлорид)
Продажа
Гидразин солянокислый доступен в каталоге АО «Реахим» по самой низкой цене в Москве и других регионах. У нас Вы можете заказать гидразин гидрохлорид с помощью формы на сайте, и в ближайшее время мы свяжемся для обсуждения деталей доставки в удобные сроки. Мы даем гарантию на гидразин хлоргидрат чистый для анализа в соответствии с ГОСТом.
Общее определение
Гидразин солянокислый – твердое вещество в виде кристаллического порошка белого цвета. Хорошо растворяется в воде. Опасное для человека и окружающей среды, может вызывать непоправимые изменения (рак). Ядовито и выделяет токсичные газы.
Применение
Вещество гидразин солянокислый чистый для анализа применяется в качестве восстановителя в органической химии, может применяться в производстве пестицидов и средств дезинфекции.
Получение
Для получения гидразина солянокислого необходимо провести обменную реакцию с гидразином сернокислым и хлористым барием:
Так же для получения используется чистый гидразин гидрат и соляная кислота.
Идентификация
Название: Гидразин солянокислый / Hydrazine hydrochloride (1:2)
Синонимы: Гидразин гидрохлорид; гидразин хлоргидрат; гидразин дигидрохлорид / Hydrazine dihydrochloride; Hydrazine Dichloride; Hydrazinchlorhydrat.
Формула: H4N2·2HCl / Cl6H6N2
ГОСТ: 22159-76
CAS: 5341-61-7
Физические данные
Физическое состояние: твердое
Цвет: белый
Форма: кристаллы
Молекулярная масса: 104.97
Температура кипения: 200°C
Температура плавления: 198°C
Плотность: 1.42 г/см 3
Растворимость: растворяется в воде (50 мг/мл), и в алкоголе (медлено).
Чистота: не ниже 98%
Пожар и взрыв
Если вещество попало в условия пожара, оно начинает разложение с образованием легковоспламеняющихся и/или взрывоопасных смесей.
Подходящие средства пожаротушения: двуокись углерода, сухой химический порошок, пена, песок, асбестовое полотно.
Опасность для человека: гидразин солянокислый может выделять токсичные пары (оксиды азота, водород хлористый газ). При тушении пожара необходим респиратор и защитная одежда.
Влияние на организм
Гидразин солянокислый может вызывать рак. Вещество токсично при вдыхании, контакте с кожей и при проглатывании, вызывает раздражение.
После вдыхания пострадавший выносится на свежий воздух; пораженный участок кожи, при попадании в глаза, при попадании в ротовую полость промывается водой; оказав первую помощь необходимо вызвать врача.
Сенсибилизация: может вызывать аллергическую реакцию органов дыхания.
Симптомы поражения: жжение, кашель, свистящее дыхание, ларингит, одышка, головная боль, тошнота, рвота. Длительное поражение гидразином солянокислым может вызывать угнетение ЦНС, судороги, поражение печени и почек, легких, вызывать спазмы, отеки, пневмонит. Оставляет ожоги, разрушает слизистые оболочки, поражает кровь.
Разлив и очищение
Опасно для окружающей среды и водных организмов, оказывает долгосрочные неблагоприятные изменения в водной среде.
В случае разлива эвакуировать зону. Для сбора необходима защитная одежда, резиновые сапоги, тяжелые резиновые перчатки и респиратор. Разлив собирается в контейнер для утилизации отходов. При сборе избегать образования пыли. После сбора проветрить зону и вымыть участок.
Для утилизации следует предварительно обратиться в лицензированные службы.
Профилактика
Безопасное обращение с гидразином солянокислым заключается во внимательном предварительном изучении инструкции и отсутствии какого-либо контакта с реагентом в жидком, сухом, пылеобразном и газообразном состоянии. Следует избегать многократной экспозиции.
Рекомендуется использование реагента только в химическом вытяжном шкафу.
Реагент стабильный. Следует избегать рядом с ним сильных окислителей и оснований, со множеством известных металлов.
Не допускать разлива в окружающею среду.
Безопасность
Коды риска:
Коды безопасности:
Защитное оборудование и одежда
Средства индивидуальной защиты при работе с гидразином солянокислым включают в себя: респиратор (тип N100), химически стойкие перчатки, защитные очки.
После работы с реагентом одежду следует тщательно вымыть.
Хранение
Главное условие хранения гидразин солянокислого – плотно закрытый контейнер. Температура окружающей среды должна быть средней комнатной.
Упаковка и транспортировка
Перед транспортировкой все объемы, содержащие гидразин солянокислый, маркируются этикеткой «Яд». Перевозят препарат всеми видами транспорта в соответствии с правилами перевозки грузов.
Класс транспортировки: 6.1
Группа упаковки: III, IV, V. Упаковка: 5, 25, 100, 500 г в стеклянной бутыли, мешки 25 кг.
Гидразин солянокислый — очень ядовитый, но нужный реактив
Гидразин солянокислый, он же хлорид гидразиния, 
Свойства
Гидрохлорид гидразина — твердое вещество в виде игольчатых или октаэдрических кристаллов без цвета или мелкокристаллического белого порошка. В воде растворяется легко, медленно растворяется в спиртах. При нагревании разлагается с образованием и выделением токсичных веществ. Сильно ядовит.
Соль проявляет себя как активное химическое вещество. Вступает в реакции с концентрированными кислотами и щелочами, аммиаком, водородом, металлами. На воздухе взаимодействует с кислородом, реакция окисления приводит к потере веществом своих качеств в результате разложения на азот, воду и соляную кислоту.
Получают соль химическим синтезом в результате реакции соляной кислоты с гидразином, или реакцией сернокислого гидразина с хлористым барием.
 |  |  |
| Вытяжной шкаф ВА-104, комплектация «Люкс» | Гидразин солянокислый | Очки защитные закрытые 3Н11 PANORAMA |
Меры предосторожности
Дигидрохлорид гидразина относится к веществам первого класса опасности. Ядовит для человека и окружающей среды, особенно для обитателей водоемов. Токсичны пары и аэрозоли, пыль и растворы, содержащие реактив. Его нельзя вдыхать и глотать, следует остерегаться контакта с кожей.
Отравление сернокислым гидразином вызывает кашель, головную боль, жжение в груди, затрудненное дыхание, воспаление голосовых связок, рвоту. В результате длительного воздействия яда на организм поражаются внутренние органы (печень, легкие, почки), кровь, слизистые оболочки, центральная нервная система. Могут начаться спазмы и судороги, отеки. Обладает свойством накапливаться в организме.
Контакт вещества с кожей или слизистыми рта и глаз вызывает химический ожог, развитие аллергических реакций. Пострадавшего нужно срочно вынести на чистый воздух, промыть места поражения водой и обязательно вызвать врача.
При работе следует использовать противогаз промышленного типа, плотные резиновые перчатки, спецодежду и спецобувь, защитные герметичные очки. Рядом с рабочим местом должен находиться огнетушитель и другие средства тушения пожара: песок, асбестовое полотно. Опыты с солью гидразина проводят только в вытяжном шкафу.
Если реактив попал в зону пожара, то могут образовываться токсичные газы, поэтому пожарные должны использовать респираторы.
Хранят солянокислый гидразин в герметичных мешках, на складах с системой вентиляции, вдали от источников тепла, солнца, легковоспламеняющихся веществ, сильных окислителей и щелочей, металлов. Любые емкости для хранения реактива в лаборатории обязательно должны быть снабжены этикеткой желтого цвета с надписью «Яд».
Применение
Для восстановления и определения золота в весовых методах анализа. Для осаждения золота из цианистых растворов.




